Étude sur la Coenzyme Q10 utilisée pour le traitement de l’ostéoporose
L’ostéoporose (OP) est due à un déséquilibre entre la différenciation des ostéoblastes et la résorption des ostéoclastes. Elle se caractérise par une diminution de la masse osseuse, une détérioration de la microstructure osseuse, un risque élevé de fracture et des complications tardives associées à une morbidité et à une mortalité graves. Elle est fréquente chez les femmes ménopausées et les hommes âgés [1].
Coenzyme Q10 (CoQ10), or ubiquinone, consists of a benzoquinone ring with a redox-active center and a long polyisoprene lipid chain [2]. Coenzyme Q10 is derived from both endogenous synthesis and exogenous intake. In the human body, coenzyme Q10 is synthesized from tyrosine or phenylalanine to form the benzoquinone structure, and the polyisoprene side chain is synthesized from acetyl coenzyme A (CoA) via the methyl valerate pathway. and then the coenzyme Q10 is formed by further modification and condensation of the quinone ring structure by methods such as hydroxylation, methylation, and decarboxylation [3]; while external intake mainly comes from animal protein, vegetables, fruits, and cereals [4].
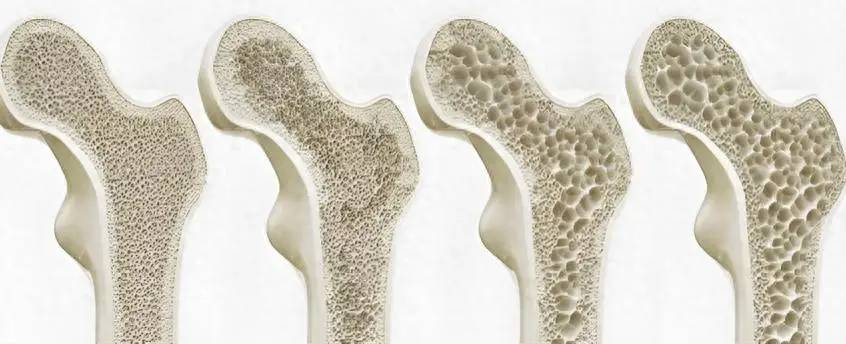
Le traitement conventionnel de l’ostéoporose se concentre principalement sur la pharmacothérapie, et un grand nombre d’expériences ont montré que l’utilisation à long terme de médicaments contre l’ostéoporose peut provoquer des effets indésirables graves. Des études récentes ont montré que la coenzyme Q10 peut réguler le métabolisme osseux et réduire les cas d’ostéoporose. Par conséquent, cet article fournit une nouvelle orientation pour la prévention et le traitement de l’ostéoporose en discutant du traitement conventionnel de l’ostéoporose, du mécanisme, de l’application et de l’innocuité de la coenzyme Q10 pour influer sur le métabolisme osseux.
1. Traitement conventionnel de l’ostéoporose
Le traitement conventionnel actuel de l’ostéoporose est la pharmacothérapie, qui est divisée en deux catégories principales: les médicaments anti-résorption osseuse et les médicaments favorisant la formation osseuse.
1.1. - le système Médicaments anti-résorption osseuse
Les médicaments anti-résorption osseuse empêchent la perte osseuse en inhibant l’activation et la fonction des ostéoclastes. Les médicaments représentatifs comprennent les bisphosphonates (BPs), le denosumab, les modulateurs sélectifs des récepteurs aux œstrogènes (SERMs) et la calcitonine. Les Bisphosphonates comprennent l’alendronate, le risédronate, l’ibandronate et l’acide zolédronique, qui inhibent la résorption osseuse en se liant à l’hydroxyapatite à la surface osseuse. Le Denosumab est un anticorps monoclonal recombinant humain qui bloque la liaison de l’activateur de récepteur du ligand du facteur nucléaire -κB (RANKL) aux cellules ostéoclastes [5] et inhibe l’activité ostéoclaste.
Les modulateurs sélectifs des récepteurs aux œstrogènes exercent leur effet en se liant sélectivement aux récepteurs aux œstrogènes. Activateur de récepteur du Ligand du facteur nucléaire -κB (RANKL) de liaison aux cellules ostéoclastes [5], inhibant l’activité ostéoclaste; Les modulateurs sélectifs des récepteurs œstrogènes exercent un effet semblable à celui des œstrogènes en se liant sélectivement aux récepteurs œstrogènes, réduisant la production et l’activité des cellules ostéoclastes [6]; La calcitonine inhibe la résorption osseuse en inhibant le mécanisme de sortie de calcium de l’os. Les médicaments anti-résorption osseuse ont surtout des effets indésirables, en particulier chez les patients atteints d’ostéoporose qui sont traités pour une résorption osseuse accrue causée par des tumeurs osseuses, combinée avec le diabète, l’immunosuppression, les stéroïdes, le tabagisme et la consommation d’alcool, la nécrose de la mâchoire et les fractures atypiques étant fréquents [7].
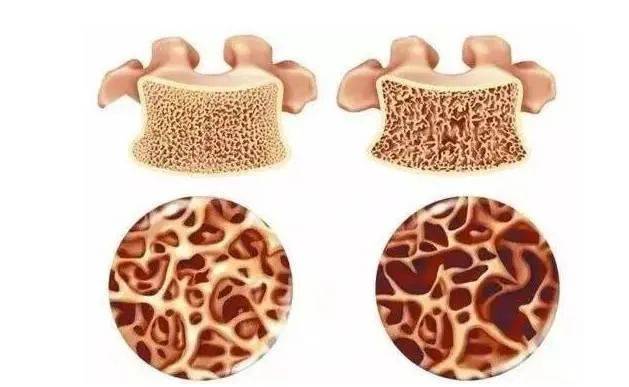
1.2 médicaments ostéogéniques
Les médicaments ostéogéniques augmentent la formation osseuse en favorisant la différenciation des ostéoblastes. Un médicament représentatif est le tériparatide. Le tériparatide est l’hormone parathyroïde humaine recombinante 1-34 (hormone parathyroïde humaine recombinante 1-34, RHPTH 1-34), et la séquence d’acide aminé N-terminal du tériparatide se lie à l’ostéoblaste, à la cellule mésenchymique, et au récepteur d’hormone parathyroïde de type I sur la surface de la membrane basale tubulaire rénale [8], exerçant un effet de formation d’os, et est généralement utilisé chez les femmes post-ménopause avec l’ostéoporose et un risque élevé de fracture. Les inconvénients du tériparatide sont son prix élevé, des réactions indésirables graves et le besoin d’injection.
En résumé, l’inconvénient du traitement médicamenteux contre l’ostéoporose est que l’administration à long terme peut causer des effets indésirables graves. Par conséquent, il est nécessaire d’étudier des médicaments sûrs et efficaces contre l’ostéoporose.
2. Mécanisme de la Coenzyme Q10 affectant le métabolisme osseux
Coenzyme Q10 a de nombreuses fonctions physiologiques, tels que l’anti-oxydation, l’anti-inflammation, l’anti-apoptose, les radicaux libres de récupération et les effets stabilisants de membrane, mais il exerce principalement des effets d’anti-oxydation et d’anti-apoptose dans le métabolisme osseux. Les recherches actuelles montrent que la coenzyme Q10 empêche la perte osseuse en favorisant la formation d’os ostéoblastes, en inhibant la résorption osseuse ostéoclaste, et en inhibant le stress oxydatif et le vieillissement cellulaire.
2.1l’effet de la Coenzyme Q10 sur les ostéoblastes et les ostéoclastes
Les ostéoblastes proviennent de cellules souches mésenchymateuses multipotentes de la moelle osseuse et sont les principales cellules fonctionnelles responsables de la formation des os. Ils sont responsables de la synthèse, de la sécrétion et de la minéralisation de la matrice osseuse. Les ostéoclastes proviennent des cellules multinucléées de la lignée mononucléaire macrophage et sont les principales cellules fonctionnelles responsables de la résorption osseuse. Ils sont responsables du développement, de la croissance, de la réparation et de la reconstruction des os. Des études ont montré que la coenzyme Q10 peut favoriser la formation osseuse.

Zheng et al. [9] ont utilisé la culture cellulaire et un modèle d’ostéoporose chez le rat pour étudier les cellules souches mésenchymateuses de la moelle osseuse extraites de rats expérimentaux et ont confirmé que le CoQ10 peut favoriser la prolifération des cellules souches mésenchymateuses de la moelle osseuse et favoriser la différenciation ostéogénique selon la dose [10]. Dans Wu et al.' S [11] étude, l’antioxydant CoQ10 a été injecté dans l’orchiectomie (ORX) des souris ont été injectés avec l’antioxydant CoQ10 pendant 40 semaines, et les résultats ont montré que le CoQ10 a efficacement empêché la perte osseuse induite par ORX en résistant au stress oxydatif. L’antioxydant CoQ10 a joué un rôle préventif et protecteur dans l’ostéoporose induite par orx en favorisant la formation d’os ostéoblastes, en inhibant la résorption osseuse ostéoclast et le stress oxydatif, et en prévenant la senescence cellulaire.
2.2 la Coenzyme Q10 réduit le Stress oxydatif
Le stress oxydatif se produit lorsqu’il y a une augmentation de la formation d’espèces oxygénées réactives (or) et une diminution de l’activité antioxydante, ou les deux, dans les systèmes biologiques [12]. Les espèces d’oxygène réactives excessives peuvent inhiber la différenciation et la prolifération des ostéoblastes, favoriser la différenciation des ostéoclastes, et finalement conduire à plus de résorption osseuse [13-14]. La supplémentation alimentaire avec des antioxydants est un moyen efficace d’améliorer les dommages causés par des espèces d’oxygène réactives excessives [15].
Coenzyme Q10 est un antioxydant naturelQui a des effets antioxydants et radicaux libres, inhibe et réduit le stress oxydatif, et donc prévient l’ostéoporose. Zhang et al. [16] ont établi un modèle de lésion de la moelle épinière chez le rat et ont administré du CoQ10 (10 mg/kg, gavage) par jour pendant 12 heures pendant plus de 10 jours. Les résultats ont montré qu’après le traitement au CoQ10, le taux de diminution de la densité minérale osseuse et de la teneur en minéraux osseux chez les rats atteints de SCI a été ralendu; Le niveau de malondialdéhyde dans les os a diminué, le niveau de superoxyde dismutase a augmenté et les dommages oxydatifs causés par la blessure ont été atténués; Et le niveau de cytokines inflammatoires a été considérablement réduit. Cela suggère que le traitement au CoQ10 peut réduire efficacement la survenue d’ostéoporose causée par des lésions de la moelle épinière.
2.3 Coenzyme Q10 Inhibe les effets de la sénescence cellulaire
La sénescence cellulaire est un état d’arrêt du cycle cellulaire qui inhibe l’apoptose et sécréte de multiples facteurs bioactifs (phénotype sécrétoire associé à la senescence- SASP), qui jouent des rôles physiologiques dans le développement embryonnaire et le processus de guérison [17]. L’augmentation du ROS est un facteur important des changements liés à l’âge dans tous les tissus, y compris les os [18].
Certaines données cliniques et expérimentales suggèrent que le stress oxydatif peut entraîner une sénescence osseuse. Le stress oxydatif dans les cellules normales peut conduire à la sénescence cellulaire, et la coenzyme Q10 a un effet antioxydant qui peut contrer le stress oxydatif cellulaire. Li et al. [19] ont établi un modèle de lésion de la moelle épinière pour évaluer si la coenzyme Q10 peut réduire le stress oxydatif et prévenir l’apoptose des cellules souches mésenchimateuses de la moelle osseuse. Les résultats ont montré que le traitement par CoQ1 0 réduit significativement l’expression des protéines apoptotiques bax et caspase-3, tout en augmentant l’expression de la protéine anti-apoptotique bcl-2 et des produits antioxydants, indiquant que la coenzyme Q10 a des effets anti-apoptotiques et antioxydants, peut lutter contre l’apoptose cellulaire, et donc prévenir la perte osseuse.
Zhang et al. [20] ont divisé les cellules souches mésenchymateuses de la moelle osseuse en un groupe témoin, un groupe de traitement au D-galactose avec différents gradients de concentration et un groupe de traitement au CoQ10 avec différentes concentrations afin d’évaluer l’effet de la coenzyme Q10 sur l’apoptose des cellules souches. Les résultats ont montré que le CoQ10 réduisait significativement les cellules gal-positives et l’expression de p53, p21 et p16 dans les cellules souches mésenchymateuses de la moelle osseuse traitées au d-galactose, indiquant que le CoQ10 inhibe le vieillissement des cellules souches mésenchymateuses de la moelle osseuse en inhibant la production de ROS.
3. Application de Coenzyme Q10 dans le traitement de l’ostéoporose
Wang Kexin et al. [21] ont divisé au hasard 40 souris mâles en un groupe témoin normal, un groupe modèle de D-galactose, un groupe de calcitriol et un groupe de coenzyme Q10, qui ont été administrés de façon continue pendant 12 semaines. A la fin de l’expérience, les fémures des souris ont été utilisés pour des tests de micro-CT et de biomécanique osseuse, et le gastrocène a été examiné par microscopie électronique à transmission ultramicroscopique.
Les résultats ont montré que, par rapport au groupe témoin normal, la charge maximale et le coefficient de rigidité du fémur dans le groupe modèle étaient sensiblement réduits; La densité de connectivité des paramètres microct (Conn. D) et la destination minérale osseuse (dmo) ont été considérablement réduites, et la séparation trabéculaire (Tb. Sp) a été considérablement augmentée. Par rapport au groupe modèle, le groupe coenzyme Q10 présentait une charge fémorale maximale, un Conn. D., une dmo et une épaisseur trabéculaire significativement plus élevées (Tb. Th), tandis que l’indice du modèle de structure (SMI) et la Tb. La Sp a diminué de façon significative.
In a study evaluating dietary fat unsaturation and coenzyme Q10 supplementation on bone health [22], 48 male rats were randomly divided into four groups: olive oil group, sunflower oil group, olive oil + coenzyme Q10 group, and sunflower oil + coenzyme Q10 group. Bone mineral density of the rats' Les femurs ont été mesurés, et les résultats ont montré que la coenzyme Q10 peut prévenir la perte de densité minérale osseuse.
Dans une autre expérience sur la prévention de la nécrose fémorale hormonale de la tête par la coenzyme Q10 [23], 20 rats ont été divisés en un groupe témoin et un groupe de coenzyme Q10, et la nécrose osseuse a été évaluée. Les résultats ont montré que les changements de la teneur en glutathion (GSH) et en malondialdéhyde (MDA) du groupe coenzyme Q10 n’étaient pas significatifs, que les changements histologiques et l’incidence de l’ostéonécrose précoce étaient plus faibles que dans le groupe témoin, et que la coenzyme Q10 avait un effet protecteur sur les os. Ce qui précède confirme que la coenzyme Q10 a un effet protecteur sur les os, fournissant une base scientifique pour le traitement de l’ostéoporose.

4. Innocuité de la Coenzyme Q10
Coenzyme Q10 is now widely used in the pharmaceutical, food, and cosmetics industries. As research into coenzyme Q10 continues, its safety is also being investigated. Current research shows that coenzyme Q10 is highly safe, with good tolerance and few adverse reactions.
Dans des expériences animales, Hong Yan et al. [24] ont effectué un test d’ames sur 50 souris, et les résultats ont montré que la coenzyme Q10 n’a pas d’effet mutagène sur les gènes. Wu Keqin et al. [25] ont effectué une expérience de toxicité par gavage de 30 jours, et les résultats ont montré que les rats n’avaient pas d’activité anormale évidente ni de symptômes d’empoisonnement.
Honda et al. [26] conducted a subchronic toxicology study of coenzyme Q10, giving rats daily doses of 300, 600, and 1,200 mg/kg for 13 weeks. The results showed that none of the groups showed signs of death or poisoning. In clinical studies, McGarry et al. [27] conducted a randomized double-blind trial in which subjects were given 2,400 mg of CoQ10 per day. The results showed that CoQ10 was well tolerated by the subjects and no serious adverse reactions occurred. In a clinical trial on progressive supranuclear palsy [28], 61 participants were given CoQ10 (2400 mg/d) or a placebo for 12 months, and their daily living abilities and mental states were assessed. The results showed that there was no significant difference between the CoQ10 group and the placebo group in the first or second outcome measurement, and the tolerance was very good.
5. Résumé et perspectives
En résumé, il existe actuellement relativement peu d’expériences animales et d’études cliniques sur l’utilisation de la coenzyme Q10 dans le traitement de l’ostéoporose. Les expériences animales à grande échelle et les essais cliniques sont donc au centre de la prochaine étape. La Coenzyme Q10 joue principalement un rôle dans la prévention et le traitement adjuvant de l’ostéoporose. On pense qu’avec d’autres recherches fondamentales et cliniques, la Coenzyme Q10 pourrait devenir un nouveau médicament pour la prévention et le traitement de l’ostéoporose.
Références:
[1] Vidal M,Thibodaux RJ,Neira LFV,et al. Osteoporosis:a clinical and pharmacological update [J]. Clin Rheumatol,2019,38(2):385-395.
[2]
[3] Hargreaves IP. Ubiquinone: cholestérol et#39; son cousin reclusif. Ann Clin Biochem,2003,40(Pt 3):207-218.
[4] gutiérrez-mariscal FM,Yubero-Serrano EM,Villalba JM,et al. Coenzyme Q(10):From bench to clinic in aging diseases,a translational review [J]. Crit Rev Food Sci Nutr,2019,59(14):2240-2257.
[5] Pang KL,Low NY,Chin KY. A Review on the Role of Denosumab in Fracture Prevention [J]. Drug Des Devel Ther,2020,14:4029-4051.
[6] Du Yanping, Cheng Qun. Mécanisme et stratégie du traitement séquentiel avec des analogues de l’hormone parathyroïde et des bisphosphonates pour l’ostéoporose [J]. Diagnostic théorique et pratique, 2020, 19(3): 219-224.
[7] Compston J,Cooper A,Cooper C,et coll. UK clinical guideline for the prevention and treatment of osteoporosis [J]. ArchOsteoporos,2017,12(1):43.
[8] Dobnig H. A review of teriparatide and its clinical effectiveness in the treatment of osteoporosis [J]. Expert Opin Pharmacother,2004,5(5):1153-1162.
[9] Zheng D,Cui C,Yu M,et al. La Coenzyme Q10 favorise la prolifération et la différenciation des ostéoblastes et protège contre l’ostéoporose induite par l’ovariectomie [J]. Mol Med Rep,2018,17(1):400-407.
[10] Moon HJ,Ko WK,Jung MS,et al. Coenzyme q10 régulatesosteoclast et différenciation ostéoblaste [J]. JFood Sci,2013,78(5):H785-891.
[11] Wu X,Liang S,Zhu X,et al. Erratum:CoQ10 la suppression du stress oxydatif et de la senescence cellulaire augmente la masse osseuse chez les souris orchiectomisées [J]. Am J Transl Res,2021,13(4):3923.
[12] Li R,Jia Z,Trush MA. Définition des ROS en biologie et médecine [J]. React Oxyg Species(Apex),2016,1(1):9-21.
[13] Lee NK,Choi YG,Baik JY,et al. Un rôle crucial pour les espèces réactives d’oxygène dans la différenciation ostéoclaste induite par rankl [J]. Blood, 2005,106(3):852-859.
[14] Fraser JH,Helfrich MH,Wallace HM et al. Le peroxyde d’hydrogène, mais pas le superoxyde, stimule la résorption osseuse dans les calvaries de souris [J]. Bone, 1996,19(3):223-226.
[15] Geng Q,Gao H,Yang R,et al. Pyrroloquinoline Quinone prévient l’ostéoporose induite par une carence en œstrogène en inhibant le Stress oxydatif et la sénescence des ostéocytes [J]. IntJ Biol Sci,2019,15(1):58-68.
[16] Zhang XX,Qian KJ,Zhang Y,et al. Efficacité de la coenzyme Q10 dans l’atténuation de l’ostéoporose causée par des lésions de la moelle épinière [J]. Mol Med Rep,2015, 12(3):3909-3915.
[17] Amaya-Montoya, M., commissionnaire de la santé et de la sécurité au travail, commissionnaire de la santé et de la sécurité au travail, M., commissionnaire de la santé et de la sécurité au travail, M., commissionnaire de la santé et de la sécurité au travail. Cible thérapeutique cellulaire Senescenceasa: maladies liées à l’alimentation: une revue [J]. Adv Ther,2020,37(4):1407-1424.
[18] Corrado A,Cici D,Rotondo C,et al. Base moléculaire du vieillissement osseux [J]. IntJ Mol Sci,2020,21(10):3679.
[19] Li X,Zhan J,Hou Y,et al. La régulation de la Coenzyme Q10 de l’apoptose et du Stress oxydatif dans le H2O2 a induit la mort de BMSC en modulant la voie de signalisation Nrf-2/NQO-1 et son Application dans un modèle de lésion de la moelle épinière [J]. Oxid Med Cell Longev,2019,2019:6493081.
[20] Zhang D,Yan B,Yu S,et al. La Coenzyme Q10 inhibe le vieillissement des cellules souches mésenchymateuses induites par le D-galactose par la signalisation Akt/mTOR [J]. Oxid Med Cell Longev,2015,2015:867293.
[21] Wang Kexin, Chen Cailing, Zheng Xiaoyan et al. Effets de la coenzyme Q10 sur la microstructure osseuse et les myofibrilles chez les souris mâles causés par le D-galactose [J]. Chinese Journal of Pharmacology, 2019, 35(11): 1544-1550.
[22] varela-lemon pez A,Ochoa JJ,Llamas-Elvira JM,et al. La perte de la densité minérale osseuse associée à l’âge chez les Rats mâles nourris avec de l’huile de tournesol est évitée par l’apport d’huile d’olive vierge ou la supplémentation en Coenzyme Q [J]. Int J Mol Sci,2017,18(7):1397.
[23] emon, E,Oktay M,Kaymaz B,et al. Effets préventifs de la coenzyme Q10(CoQ10) sur l’ostéonécrose induite par les stéroïdes chez les rats [J]. Acta Orthop Traumatol Turc,2014,48(2):217-222.
[24] Hong Yan, Zheng Yangbin, Liu Bo. Évaluation expérimentale de l’innocuité toxicologique du coenzyme Q10 chez la souris [J]. Forum sur les soins primaires, 2017, 21(25): 3461.
[25] Wu Keqin, Huang Jianping, Zhong Liyun et autres. Étude de toxicité de la Coenzyme Q10 [J]. Strait Pharmacy, 2012, 24(8): 39-41.
[26] Honda K,Tominaga S,Oshikata T et al. Étude de toxicité orale par administration répétée de treize semaines du coenzyme Q10 chez le rat [J]. J Toxicol Sci,2007,32(4):437-448.
[27] McGarry A,McDermott M,Kieburtz K,et al. Un essai randomisé, en double aveugle, contrôlé contre placebo de la coenzyme Q10 dans la maladie de Huntington [J]. Neurology,2017,88(2):152-159.
[28] Apetauerova D,Scala SA,Hamill RW,et al. CoQ10 dans progressive supranuclear palsy: un essai randomisé, contrôlé contre placebo, en double aveugle [J]. Neurol Neuroimmunol Neuroinflamm,2016,3(5):e266.


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




