Quels sont les avantages de la phycocyanine?
phycocyanine (abbreviated as PC, absorption spectrum 615-640 nm) is a light-trapping pigment protein commonly found in cyanobacteria for photosynthesis[1] . Phycocyanin has many pharmacological activities, such as anti-inflammatory, anti-tumor, anti-allergy, maintenance of homeostasis, and toxicity reduction and potentiation, etc.[2] , and pharmacological experiments have proved that it has a significant role in regulating the metabolism of free radicals in the organism. Free radicals are involved in the development of many diseases, including inflammation, atherosclerosis, cancer, damage caused by reperfusion, and other dysfunctions induced by oxidative stress [3]. In this paper, the antioxidant activity and pharmacological effects of phycocyanin are summarized, and the relationship between the pharmacological activity of phycocyanin and its antioxidant mechanism is inferred, which will provide a reference for the pharmacological study of phycocyanin.
1 Structure et fonction de la phycocyanine
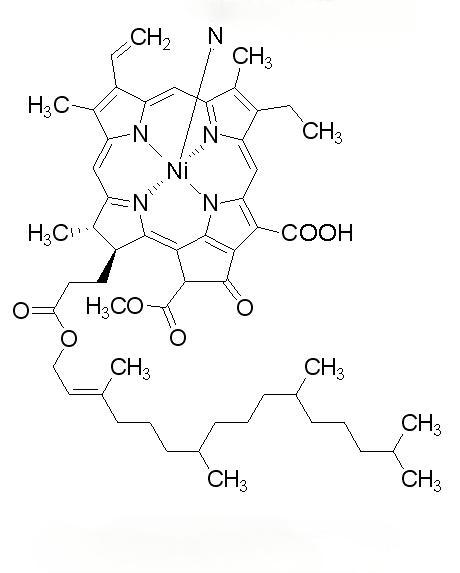
Les algues piègent la lumière en utilisant la structure en forme de baguettes de leur propre complexe de pigments photopiégeants, qui contient des milliers de molécules de pigments photopiégeants qui aident les algues à absorber de très faibles niveaux de lumière du soleil. La c-phycocyanine (C-PC) et l’allophycocyanine (APC) de la vésicule vésicale de spiruline obtusususus sont réticulées de manière non covalente par une protéine connexine, et l’énergie est transférée du CPC à l’apc, puis au centre de réaction photosynthétique pour favoriser la photosynthèse [4]. L’effet antioxydant de la phycocyanine est lié à sa structure unique (Figure 1). Dans la phycocyanine, il existe un phénomène de transfert d’énergie d’excitation entre les pigments piégeant la lumière, les résidus de tryptophan et les chromophores [5], qui a la capacité de passer de l’état de base à l’état excité, et a la capacité de transférer des électrons, ce qui implique le processus redox.
En outre, Stocker et al.[7] ont montré que la bilirubine a pour effet d’éliminer les radicaux peroxyles, et le mécanisme est que la bilirubine peut lier les radicaux peroxyles à un atome d’hydrogène de molécule de tétrapyrrole à la position C-10, de sorte que les radicaux libres peuvent former une stabilisation de résonance avec l’atome de carbone central, puis éventuellement s’prolonger à l’ensemble de la molécule de bilirubine. La chaîne ouverte du tétrapyrrole dans le chromophore (phycocyanine) de la phycocyanine (figure 2A) est très semblable à celle de la bilirubine (figure 2B) et peut contribuer à son activité antioxydante.
Romay[10] a d’abord signalé la propriété antioxydante de l’alginate et évalué le potentiel de l’alginate comme antioxydant in vitro et in vivo, et les résultats expérimentaux ont montré que l’alginate pouvait éliminer efficacement les radicaux hydroxyles et alkylés, ce qui indiquait que l’alginate pouvait être utilisé comme antioxydant in vitro et in vivo. Halliwell[11] a constaté que l’alginate avait également un effet inhibiteur sur la peroxydation des lipides microsomaux hépatiques, et que la quantité de superoxyde dismutase (SOD) était trois fois plus élevée que dans cette expérience, mais l’augmentation de la quantité de SOD ne modifiait pas l’activité antioxydante de l’alginate. Halliwell [11] a constaté que l’alginate inhibait également la peroxydation des lipides dans les microsomes du foie. Dans cette expérience, la capacité antioxydante de la superoxyde dismutase (SOD) était 3 fois plus élevée que celle de la phycocyanine, mais l’augmentation de la quantité de SOD n’a pas modifié la capacité antioxydante de la phycocyanine, ce qui indique qu’ils ont des mécanismes antioxydants différents.
In addition, the antioxidant mechanism of alginate is similar to that of commonly used antioxidants, such as tocopherol and ascorbic acid, and it can inhibit hemolysis of erythrocytes induced by 2, 2-azobis(2-squintylpropane) dihydrochloride.12 Hirata et al.[13] studied the antioxidant effects of alginate on the hydrophobic system in the liposomal modes of methyl linoleate and phosphatidylcholine. They showed that the antioxidant activity of phycocyanin (a component of phycocyanin) per mole was higher than that of α-tocopherol in the same molar amount. Moreover, phycocyanin extracted from spray-dried Spirulina showed similar antioxidant activity to that of fresh Spirulina. Since some of the de-coordinated proteins of phycocyanin are denatured during the drying process, these results suggest that phycocyanin contributes significantly to the antioxidant capacity of phycocyanin. These results suggest that phycocyanin contributes significantly to the antioxidant activity of phycocyanin. This study shows that phycocyanin has good antioxidant activity, et que la phycocyanine séchée est d’une grande valeur commerciale en raison de sa bonne stabilité.
2 activité antioxydante de la phycocyanine Et activité pharmacologique connexe
2.1 activité antioxydante et effet anti-inflammatoire de la phycocyanine
Tout d’abord, l’alginine peut inhiber la luminescence oxydative du luminal dans des conditions alcalines [14], qui agit sur l’éclat respiratoire des phagocytes et réduit les radicaux libres (-OH, H2O2, RO-) et l’excès de peroxydes, ce qui permet d’obtenir un effet inhibiteur. Les preuves [15] suggèrent que des espèces réactives d’oxygène, telles que l’anion superoxyde, le peroxyde d’hydrogène et le radical hydroxyle, peuvent entraîner une cascade d’acide arachidonique, ce qui entraîne une dégranulation des mastocytes et la libération d’histamine, de 5-hydroxytryptamine, de facteur de nécrose tumorale et d’autres médiateurs inflammatoires. La phycocyanine est capable de récupérer le peroxyde, l’hydroxyle et les radicaux alkylés. Spillert et al.[16] ont étudié l’effet inhibiteur de la phycocyanine sur l’inflammation induite par le peroxyde d’hydrogène dans un modèle in vitro afin de comprendre la capacité potentielle de piégeage de la phycocyanine sur H2O2 et -OH. Les résultats ont montré que l’alginate réduisait l’œdème induit par la glucose oxydase chez les pattes de souris. Ainsi, l’effet récupérateur de l’alginate sur -OH lui donne un effet anti-inflammatoire.
Dans la même gamme de doses, l’alginate a montré une activité anti-inflammatoire dans l’œdème de la patte arrière induit par le carraghénane chez les rats et dans le granulome de boule d’ouate chez les rats[17]. L’alginine a réduit de façon significative l’œdème de l’oreille médié par l’acide arachidonique chez les souris et l’œdème du pied et de la plante induit par le carraghénane chez les rats, ce qui a été attribué à la piégation d’espèces réactives d’oxygène et à l’inhibition du métabolisme de l’acide arachidonique. Gonzalez et Fretland et al. [18-19] ont appliqué la phycocyanine à un modèle animal de colite ulcérée induite par l’acide acétique, et ont analysé les tissus du colon et mesuré l’activité de la myéloperoxydase. Les résultats ont montré que l’administration de phycocyanine réduisait significativement l’infiltration d’éosinophiles dans la muqueuse du côlon d’un modèle animal endommagé de colite, et réduisait significativement la production de radicaux libres et d’une variété de substances réactives dans l’activité myéloopéroxydase induisant la maladie. Les résultats ont montré que la phycocyanine était efficace pour réduire l’incidence de la colite induite par l’acide acétique chez les rats, et son mécanisme anti-inflammatoire était lié à son activité antioxydante.
2.2 l’activité antioxydante de la phycocyanine et le rôle de la Protection du foie
Bhat et al [20] ont étudié l’activité pharmacologique de la phycocyanine contre l’hépatotoxicité induite par la R-(+) -longue feuille menthone et la CCl4 chez le rat. Les résultats ont montré que la phycocyanine réduit de manière significative l’hépatotoxicité induite par la production de grandes quantités de radicaux libres par les deux composés. 2002, Remirez et al.[21] ont étudié l’effet de la phycocyanine sur les paramètres liés au stress oxydatif dans les cellules de brûlure hépatique. En 2002, Remirez et al. [21] ont étudié l’effet de l’alginate sur les paramètres liés au stress oxydatif dans les cellules de brûlure hépatique, et les résultats ont montré que l’alginate réduisait de façon significative la phagocytose et l’activité d’éclatement respiratoire des cellules de brûlure, ce qui a été attribué au fait que l’alginate réduisait le facteur de nécrose tumoral tnf-α produit par le stress oxydatif et l’oxyde nitrique produit par l’état hyperthyroïdien. Par conséquent, nous pensons que l’effet hépatoprotecteur de l’alginate est principalement attribué à son inhibition de la production de mmetabolites réactifs dans la réaction oxydative et à son élimination efficace des radicaux libres. En outre, l’alginate peut également inhiber certaines réactions médiées par le cytochrome P450, par exemple, inhiber la production de métabolites réactifs des réactions oxydatives impliquées dans le P450. Bhat et al.[22] ont également prouvé que l’alginate peut inhiber la peroxydation des lipides hépatiques induite par le ccl4 chez les rats.

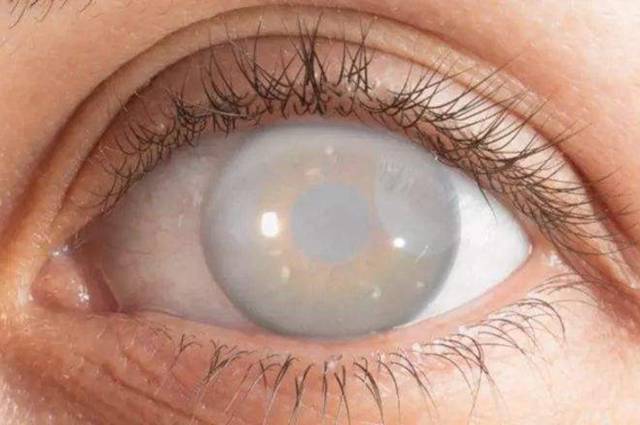
2.3 l’effet antioxydant de la phycocyanine et l’élimination des cataractes
Ou et al[23] ont constaté que la phycocyanine inhibait l’apoptose induite par la d-galactose des cellules épithéliales du cristallin humain par les voies de réponse des protéines mitochondriales et dépliées. L’apoptose des cellules épithéliales du cristallin étant une cause importante de la formation de la cataracte, la prévention de l’apoptose LEC peut être une stratégie thérapeutique pour la cataracte. Kumari et al.[24] ont également étudié l’effet modulateur de la phycocyanine sur les cataractes induites par le sélénium de sodium chez les rats. Les résultats expérimentaux ont montré que la phycocyanine pouvait réduire le stress oxydatif en régulant les niveaux d’enzymes antioxydantes in vivo et ex vivo, réduisant ainsi l’incidence de cataracte induite par la sélénite de sodium.
2.4 activité antioxydante et effets vasoprotecteurs de la phycocyanine
Ross[25] suggested in 1999 that atherosclerosis is an inflammatory disease characterized by chronic inflammatory reaction. Riss et al.[26] demonstrated that phycocyanin in Spirulina can inhibit the production of reactive radicals and cyclooxygenase-2, increase the level of antioxidant enzymes in vivo, effectively improve the inflammatory damage caused by oxidative stress in atherosclerotic animals, and regulate the effect of blood lipids. Since the formation of atherosclerotic lesions is a result of inflammatory-fibro-proliferative response of arteries to endothelial injury, Chu et al.[27] investigated the inhibitory effect of Spirulina obtusususifera alginate on the hyperproliferation of vascular smooth muscle cells, endothelial proliferation and luminal stenosis after vascular injury through in vivo and ex vivo experiments.
Il a été démontré que la phycocyanine peut réduire les dommages inflammatoires oxydatifs dans les vaisseaux sanguins et inhiber le rétrécissement luminal en inhibant le cycle G1/S et en supprimant la prolifération excessive de VSMC et la formation de nouvelles membranes endothéliales, prouvant ainsi que l’activité antioxydante de la phycocyanine a un bon effet préventif et de soins de santé sur la santé vasculaire. Strasky et al[28] ont étudié l’effet d’activation de l’alginate sur l’hémie oxygénase-1, une enzyme qui permet la dégradation de l’hémie pour produire un antioxydant puissant, la bilirubine. Strasky et al. [28] ont étudié l’activation de l’hémie oxygénase-1 par la phycocyanine, une enzyme qui métabolise l’hémie pour produire un puissant antioxydant, la bilirubine. Les résultats expérimentaux ont montré que la phycocyanine dans la spiruline a réduit le stress oxydatif et activé HMOX1 dans les cellules endothéliales, résultant en une expression accrue de HMOX1 dans les lésions athérosclérotiques chez les souris déficientes en apoe. Cela fournit également une nouvelle raison pour l’algin de réduire l’athérosclérose en augmentant l’expression de l’hémie oxygénase-1 pour augmenter l’effet antioxydant.
2.5 activité antioxydante et effets neuroprotecteurs de la phycocyanine
La diminution de la capacité antioxydante et l’augmentation des radicaux réactifs azoté-oxygène sont fortement associées au vieillissement des organes humains et aux maladies neurodégénératives [29-31]. Il a été constaté que les Injections de SOD dans certains modèles animaux inhibent la réponse inflammatoire dans ces modèles et augmentent l’expression de certaines molécules de la fonction immunitaire dans les cellules immunitaires isolées ainsi que dans le corps animal et humain [32]. De nombreux essais cliniques ont rapporté que l’expression de cytokine est significativement augmentée dans le liquide céphalo-rachidien et les tissus cérébraux de patients atteints de lésions cérébrales ou d’infarctus [33-34]. La propriété antioxydante de l’alginate peut agir sur les cytokines pour réparer les lésions cérébrales et inhiber la nécrose cellulaire en temps opportun.
Rimbau et al.[35] ont constaté que l’alginate pouvait réduire les réponses épileptiques induites par l’érythrocyanine dans l’hippocampe des rats et avait un effet protecteur sur les neurones. La raison pour laquelle l’érythrocyanine provoque l’épilepsie est qu’elle génère un grand nombre de radicaux libres oxygénés, et l’alginate peut protéger les dommages neuronaux en réduisant les radicaux libres. Cette expérience suggère que l’alginate peut être utilisé pour traiter les dommages neuronaux induits par le stress oxydatif dans les maladies neurodégénératives, telles que l’alzheimer' S maladie et Parkinson' syndrome S. De plus, Rimbau et al.[36] ont constaté que l’algine protège In vitro la mort des cellules cérébrales granulaires chez les rats de culture déficients en potassium et en sérum en réduisant les radicaux libres d’oxygène, et Marin et al.[37] ont démontré que l’algine protège les cellules neuronales SH-SY5Y contre les dommages oxydatifs, et réduit la déficience fonctionnelle induite par le Ca2+/ le phosphore de l’ischémie transitoire de la rétine et des mitochondries du rat.
2.6 activité antioxydante de la phycocyanine et des reins et des poumons
Shukkur et al. [38] ont constaté que la phycocyanine empêchait les dommages cellulaires induits par le stress oxydatif et provoqués par l’acide oxalique dans les cellules rénales canines, réduisait les espèces réactives d’oxygène (ROS) et la peroxydation lipidique (LPO) induites par l’acide oxalique, et avait un effet protecteur significatif sur la perméabilité de la membrane mitochondriale39. Zheng et al.[40] ont constaté que les protéines de cyanobactérie des algues spirulines et la phycocyanine pourraient prévenir la néphropathie diabétique en inhibant le stress oxydatif, Zeng et al.[39] ont constaté que la spiruline cyanobactérie et la phycocyanine pourraient prévenir la néphropathie diabétique en inhibant le stress d’oxygénation.
L’administration orale d’alginate pendant 10 semaines a empêché la protéinurie et la dilatation mégaïale, a normalisé l’expression du facteur de croissance tumorale -β et de la fibronectine, et a réduit l’expression de la NADPH oxydase, un marqueur du stress oxydatif, chez les souris diabétiques de type 2 (souris db/db). De plus, Gonzalez et al.[40] ont démontré que l’alginate en association avec la kanamycine réduisait la congestion vasculaire tubulaire rénale et l’infiltration inflammatoire chez les souris, et diminuait la néphrotoxicité de la kanamycine, un antibiotique aminoglycoside. L’activité de la SOD, la diminution de l’hydroxyproline (HYP), du malondialdéhyde (MDA) et de la MDA plasmatique dans les tissus pulmonaires, ont réduit le degré d’alvéolite et de fibrose chez les rats intoxiqué au paraquat, et ont eu un effet inhibiteur significatif sur l’alvéolite induite par le paraquat et la fibrose pulmonaire chez les rats.
2.7 activité antioxydante et prévention tumorale de la phycocyanine
The results of o-toluene red bleaching assay[42] showed that algin cofactor had a stronger scavenging effect on peroxynitrite anion than phycocyanin, and that phycocyanin significantly inhibited DNA single-strand breaks caused by peroxynitrite anion in a dose-dependent manner, which may provide a basis for the prevention of cellular carcinogenesis. -Gupta et al. [43] investigated the protective effect of Poudre de phycocyanine on skin oncogenes in mice exposed to 12-O-Tetradecanoylphorbol-13-acetate (TPA). The use of phycocyanin inhibited the TPA-induced expression of key tumorigenic factors, such as ornithine decarboxylase, cyclooxygenase-2, interleukin 6, and phosphorylated signal transducer and activator of transcription 3, in a dose-dependent manner in TPA-induced mice. Thangam et al [44] investigated the antioxidant properties of phycocyanin and its ability to inhibit cancer cell growth. Fluorescence and phase contrast microscopy showed that phycocyanin inhibited the growth of HT-29 (colon cancer) and A549 (lung cancer) cells, and caused DNA arrest and cleavage of cancer cells at G(0)/G(1) phase.
Fernandez et al. [45] ont étudié l’effet de l’alginate sur la néphrotoxicité induite par le cisplatine, et les résultats ont montré que l’alginate pouvait empêcher la diminution induite par le cisplatine de la glutathion réductase, réduire la teneur en peroxyde d’hydrogène, maintenir le niveau d’azote uréique dans le sang et inhiber le stress oxydatif, et avait un bon effet sur la néphrotoxicité induite par le cisplatine. Il a un bon effet inhibiteur sur le stress oxydatif et inhibe la néphrotoxicité causée par le cisplatine. De plus, de nombreuses années de recherche sur le cancer ont prouvé qu’une combinaison appropriée de médicaments peut améliorer efficacement l’innocuité et l’efficacité d’un seul médicament dans le programme de traitement46. En 1998, Xin Huawen et al.[47] ont étudié la potentialisation In vitro du méthotrexate et du cisplatine par l’alginate. Les résultats ont montré que la combinaison d’alginate et de méthotrexate augmentait significativement la cytotoxicité de ce dernier, et l’effet de potentialisation augmentait avec l’augmentation de la concentration de méthotrexate, et il y avait une différence très significative dans la viabilité cellulaire des cellules sans alginate et celles avec l’alginate, qui était semblable à celle du potentiateur existant, le verapamil (un inhibiteur des canaux calciques), mais avec moins de toxicité.
Miroslav et al[48] ont montré que la combinaison de la dose conventionnelle de 10% de topotécan avec la phycocyanine était plus efficace que la dose conventionnelle de topotécan seul, activant de grandes quantités de cystéine aspartate protéinase-9 (caspase-9) et cystéine aspartate protéinase-3 (caspase-3). L’effet du topotécan a été accru tandis que la fréquence des effets secondaires a été réduite. Saini et al.[49] ont également démontré la même année que la combinaison de piroxicam, un ains traditionnel, et de phycocyanine augmentait l’effet de plus de 70% par rapport à celui à usage unique, et que l’expression de la cyclooxygénase 2 (COX-2) et le niveau de prostaglandine E2 (PGE-2) étaient considérablement diminués, et l’inhibition de la casse de l’adn était également démontrée. Il n’est pas difficile de voir que l’effet antioxydant de l’alginate joue un rôle dans l’amélioration de l’immunité et la protection des organes endommagés, et la combinaison de l’alginate comme photosensibilisant avec les médicaments anticancéreux cliniques existants jouera un rôle important dans l’augmentation de l’efficacité de la chimiothérapie.
3 résumé et perspectives
The antioxidant activity of recombinant alloxyalanine in our laboratory[50-51] showed that recombinant alloxyalanine has the ability to scavenge free radicals, but its scavenging effect on different types of free radicals varies greatly. Since the structural composition of albumin is similar to that of alloxan, the cofactor proteins of albumin also have similar antioxidant activities[52] . Subsequently, it was further verified that the scavenging effect of phycocyanobilin (PCB) on DPPH radicals showed a certain quantitative effect relationship[53] ; the latest results of Pleonsil et al.[54] showed that the antioxidant activity of natural phycocyanobilin was greater than that of recombinant phycocyanobilin. The antioxidant activity of phycocyanin is partly attributed to phycocyanin[13] , and cofactor proteins should have different antioxidant effects from phycocyanin[52] , which indirectly confirms that phycocyanin scavenges free radicals at the level of both de-cofactorized proteins and phycocyanin.
Aujourd’hui, il est possible d’obtenirphycocyanins of high purity by means of sophisticated chemical and biological engineering techniques. However, the activity varies depending on the raw material and the extraction process. The good antioxidant activity of algal cyanoproteins can be the basis for applications for nutraceuticals and drug candidates, the success of which depends on good quality control.
While traditional open culture of algal cyanobacteria requires a lot of conditioning to achieve constant quality, industrial recombinant expression is more controllable, but it is difficult to bioengineer the assembly of phycocyanin into the protein subunits of polymers, and further research is needed to determine the activity and quality of the resulting algal cyanobacterial proteins. In addition, the metabolites and derivatives of phycocyanin are complex. To determine whether the active effect of phycocyanin is due to its metabolites as a whole or through oral or injectable routes of administration is the next goal of our research. It is mentioned in the paper that alginate can play an antioxidant role in different disease organs, how alginate enters the cell and how it works is the key to research. The large-scale cultivation of SpirulinaA jeté les bases du développement et de l’utilisation des cyanoprotéines algales, et son alimentation fonctionnelle a exploré son application. Par conséquent, à l’avenir, des recherches approfondies sur l’activité et le mécanisme de la protéine cyanobactérienne algale et des essais cliniques ouvriront plus d’espace pour son application.
Références:
[1] Eriksen N T. Production de phycocyanine - un pigment ayant des applications en biologie, biotechnologie, aliments et médecine [J]. Appl Microbiol Biotechnol, 2008, 80(1): 1-14.
[2] WANG Tingjian, Fan de LIN, chanson QIN. Protéines biliaires algales et leurs applications en médecine [J]. Plant Physiology Letters, 2006, 42(2): 303-307.
[3] Kehrer J P. Free radicals as mediators of tissue injury and disease [J]. Crit Rev Toxicol, 1993, 23: 21-48.
[4] WANG Guangze, ZHOU Baicheng, ZENG Chengkui. Construction d’un modèle de transfert d’énergie pour la c-phycocyanine et l’iso-phycocyanine dans Spirulina obtususus[J]. Science Bulletin, 1996, 40(8): 741-743.
[5] WANG Guangze, ZENG Chengkui. Étude sur le transfert d’énergie entre différents groupes dans la molécule c-phycocyanine de Spirulina obtususus[J]. Oceans and Lakes, 1998, 29(5): 471-475.
[6] Grossman A R, Schaefer M R, Chiang G G. Thephycobilisome, complexes de récolte ponstveto conditions environnementales [J]. Microbiological Reviews, 1993, 57(3): 725-749.
[7] Stocker R, Yamamoto Y, Mcdonagh A F, et al. La bilirubine est un antioxydant d’importance physiologique possible [J]. Science, 1987, 235: 1043-1046.
[8] Gossauer A, Hirsch W. synthèses de bile-pigments. 4. Synthèse totale de la phycocyanobiline racémique (phycobiliverdine) et de l’ahomophycobiliverdine [J]. Annalen Der Chemie- Justus Liebig, 1976, 9: 1496-1513.
[9] Bonnett R, Davies J E, Hursthouse M B. Structure de la bilirubine [J]. Nature, 1976, 262: 327-328.
[10] Romay C, Armesto J, Remirez D, et al. Propriétés antioxydantes et anti-inflammatoires de la c-phycocyanine provenant d’algues bleu-vert [J]. Inflamm Res, 1998, 47(1): 36-41.
[11] Halliwell B. comment caractériser un antioxydant biologique [J]. Freerad Res Comm, 1990, 9: 1-32.
[12] Romay C, Gonzalez R. Phycocyanin est un antioxydant protecteur des érythrocytes humains contre la lyse par les radicaux peroxyles [J]. J Pharm Pharmacol, 2000, 52: 367-368.
[13] Hirata T, Tanaka M, Ooike M, et al. Activités antioxydantes de la phycocyanobiline préparée à partir de Spirulina platensis [J]. ApplPhycol, 2000, 435-439.
[14] Romay C, Ledon N, Gonzalez R. l’extrait de phycocyanine réduit les niveaux de leukotrienes B4 dans le test d’inflammation de l’oreille de souris induit par l’acide arachidonique [J]. J Phar Pharmacol, 1999, 51: 641-642.
[15] Lissi E A, Pizarro M, Romay C, et al. Cinétique des groupes de phycocyanine biline destruction par les radicaux peroxyles [J]. Radic Biol Med, 2000, 28: 1051-1055.
[16] Spillert C R, Pelosi M A, Parmer L P, et al. Un modèle d’inflammation induite par le peroxyde pour le dépistage de drogues [J]. Agents et Actions, 1987, 21: 297-298.
[17] Romay C, Ledon N, Gonzalez R. Further studies on anti-inflammatoire activity of phycocyanine in some animal models of inflammation [J]. Inflammation Research, 1998, 47 (8): 334-338.
[18] gonzález R, Rodriguez S, Romay C, et al. Activité anti-inflammatoire de l’extrait de phycocyanine dans la colite induite par l’acide acétique chez le rat [J]. Pharmacological Research, 1999, 39(1): 55-59.
[19] Fretland D J, Djuric S W, Gaginella T S. Eicosanoids and inflammatoire intestinal disease: regulation and prospects for therapy [J]. Prost Leukotr Ess Fatty Acids, 1990, 41(4): 215-233.
[20] Vadiraja B B, Gaikwad N W, Madyastha K M. Effet hépatoprotecteur de la c-phycocyanine: Protection du tétrachlorure de carbone et de l’hépatotoxicité par R-(+)-pulegone chez le rat [J]. Biochem et Biophys Res Com, 1998, 249(2): 428-431.
[21] Remirez D, fernández V, Tapia G, et al. Influence de la c-phycocyanine sur les paramètres hépatocellulaires liés au stress oxydatif du foie et au fonctionnement des cellules de Kupffer [J]. Inflammation Research, 2002, 51(7): 351-356.
[22] Bhat V B, Madyastha K M. C-phycocyanin: un puissant capteur de radicaux peroxyles in vivo et in vitro [J]. Biochem Biophys Res commun, 2000, 275(1): 20-25.
[23] Ou Y, Yuan Z J, Li K P, et al. La phycocyanine peut supprimer l’apoptose des cellules épithéliales du cristallin humain induite par la d-galactose par les voies de réponse des protéines mitochondriales et dépliées [J]. Toxicology Letters, 2012, 215(1): 25-30.
[24] Kumari R P, Sivakumar J, Thankappan B, et al. La c-phycocyanine module la cataractogenèse induite par le sélénium chez le rat [J]. Biological Trace Element Research, 2013, 151(1): 59-67.
[25] Ross R. athérosclérose une maladie inflammatoire [J]. New Engl J Med, 1999, 340(2): 115.
[26] Riss J, Decorde K, Sutra T et al. La phycobiliprotéine c-phycocyanine de Spirulina platensis est puissemment responsable de la réduction du stress oxydatif et de l’expression de la NADPH oxydase induite par un régime athérogénique chez les hamsters [J]. J Agric Food Chem, 2007, 55(19):7962-7967.
[27] Chu Xianming, Leng Min, Li Bing et al. Mécanisme d’inhibition de l’hyperprolifération des cellules du muscle lisse vasculaire et de la sténose luminale par la phycocyanine [J]. Chinese Journal of Pharmacology, 2012, 28(10): 1383-1388.
[28] Strasky Z, Zemankova L, Nemeckova I, et al. Spirulina platensis et phycocyanobiline activent l’oxygénase de l’hémie athéro-protectrice 1: une implication possible dans l’athérogenèse [J]. Nourriture &; Function, 2013, 4(11): 1586-1594.
[29] Harman D. Aging: to theory based on free radical and radiation chemistry [J]. J Gerontol, 1956, 11(3): 289-300.
[30] Leibovitz B E, Siegel B V. Aspects des réactions des radicaux libres dans les systèmes biologiques: vieillissement [J]. J Gerontol, 1980, 35(1): 45-56.
[31] Ames B N, Shigenaga M K, Hagen T M. Oxydants, antioxydants, et les maladies dégénératives du vieillissement [J]. Proc Nati Acad Sci USA, 1993, 90(17): 7915-7922.
[32] Han S N, Meydani S N. antioxydants, cytokines et infection grippale chez les souris âgées et les humains âgés [J]. J infecte Dis, 2000, 182: 74-80.
[33] Lynch M A. déficience liée à l’âge dans la potentialisation à long terme dans l’hippocampe: un rôle pour la cytokine, interleukine-1 beta? [J]. Prog Neurobiol, 1998, 56: 571-589.
[34] Knoblach S M, Fan L, Faden A I. l’expression neuronale précoce du facteur de nécrose tumorale — quadrature après une lésion cérébrale expérimentale contribue à l’altération neurologique [J]. J Neuroimmunol, 1999, 95: 115-125.
[35] Rimbau C, Camins A, Romay C, et al. Effet protecteur de la c-phycocyanine contre les dommages neuronaux induits par l’acide kainique dans l’hippocampe du rat [J]. Neuroscience Letters, 1999, 276: 75-78.
[36] Rimbau c, Camins A, Pubill D, et al. La c-phycocyanine protège les cellules granules cérébellaires de l’apoptose induite par la privation de potassium/ de sérum faible [J]. Naunyn Schmiedebergs Arch Pharmacol, 2001, 364(2): 96-104.
[37] Marin-Prida J, Penton-Rol G, Rodrigues F P, et al. La c-phycocyanine protège les cellules SH-SY5Y contre les lésions oxydatives, la rétine du rat contre l’ischémie transitoire et les mitochondries du cerveau du rat contre l’insuffisance induite par le Ca2+/ le phosphore [J]. Brain Research Bulletin, 2012, 89(5-6): 159-167.
[38] Farooq Shukkur M, Boppana Nithin B, Asokan Devarajan, et al. La c-phycocyanine confère une protection contre le stress oxydatif induit par l’oxalate et les dysfonctionnements mitochondriaux dans les cellules MDCK [J]. Plos One, 2014, 9(4).
[39] Zheng J, Inoguchi T, Sasaki S et coll. La phycocyanine et la phycocyanobiline de Spirulina platensis protègent contre la néphropathie diabétique en inhibant le stress oxydatif [J]. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2013, 304(2): 110-120.
[40] gonzález núñez, Rodriguez Salgueiro, Barco Herrera, et al. La phycocyanine accélère la récupération du tissu rénal endommagé par une surdose de kanamycine chez les rongeurs [J]. Acta Microscopica, 2012, 21(3): 147-154.
[41] Sun Y X, Zhang J, Yan Y J, et al. L’effet protecteur de la phycocyanine c sur les lésions pulmonaires aiguës induites par le paraquat chez les rats [J]. Environmental Toxicology and Pharmacology, 2011, 32(2): 168-174.
[42] Bhat V B, Madyastha K M. Collecte du peroxynitrite par la phycocyanine et la phycocyanobiline de Spirulina platensis: protection contre les dommages oxydatifs à l’adn [J]. Communications sur la recherche biochimique et biophysique, mars 2011
2001, 285, 262-266.
[43] Gupta N K, Gupta K P. effets de la c-phycocyanine sur les gènes représentatifs du développement de tumeurs dans la peau de souris exposée au 12-o-tétradecanoyl-phorbol -13- acétate [J]. Environmental Toxicology and Pharmacology, 2012, 34(3): 941-948.
[44] Thangam R, Suresh V, Princy W A, et al. La c-phycocyanine provenant d’oscillatoria tenuis présentait une activité antioxydante et antiproliférative in vitro par induction d’apoptose et arrêt du cycle cellulaire G(0)/G(1) [J]. Food Chemistry, 2013, 140(1-2): 262-272.
[45] Fernandez-Rojas, Noel Medina-Campos, Omar Hernandez- Pando, et al. La c-phycocyanine empêche la néphrotoxicité induite par le cisplatine par l’inhibition du stress oxydatif [J]. Nourriture &; Function, 2014, 5(3): 480-490.
[46] Jiang M. Étude des combinaisons régulières de médicaments et de leur importance pharmacologique [J]. Journal of Chinese Medicine Literature, 2006, 47(4): 243.
[47] XIN Huawen, WANG Runbang, OU Yang Sha Huai, et al. Potentialisation In vitro du méthotrexate et du cisplatine par l’alginate [J]. Journal de l’université médicale de Hubei, 1998, 19(1), 22-24.
[48] Gantar M, Dhandayuthapani S, Rathinavelu A. phycocyanine induisent l’apoptose et améliorent l’effet du topotécan sur la lignée cellulaire de la Prostate LNCaP [J]. Journal of Medicinal Food, 2012, 15(12): 1091-1095.
[49] Saini M K, Vaiphei K, Sanyal S N. Chemoprevention of DMH induced colon carcinome initiation by combination administration of piroxicam and c-phycocyanin [J]. Mol Cell Biochem, 2012, 361(1-2): 217-228.
[50] Ge B S, Qin S, Han L. propriétés antioxydantes de l’allophycocyannine recombinante exprimée dans Escherichia coli [J]. Journal of Photochemistry and Photobiology B-Biology, 2006, 84(3): 175-180.
[51] HAN Lu, GE Baosheng, QIN Song et autres. Activité antioxydante de plusieurs cyanoprotéines algales recombinantes [J]. Activité antioxydante de plusieurs cyanoprotéines algales recombinantes [J]. Marine Science, 2007, 31(8): 71-74.
[52] ZHOU Zhan, CHEN Xiu, ZHANG Yuzhong et al. Influence des protéines biliaires algales sur leurs activités antioxydantes [J]. Marine Science, 2003, 27(5): 77-80.
[53] Chen YJ, Liu SF, Qin S, et autres. Interaction des pigments bleus d’algues antioxydants actifs avec l’albumine sérique bovine [J]. Interaction de la phycocyanine active antioxydante avec l’albumine sérique bovine [J]. Journal of Pharmaceutical Analysis, 2011, 31(1): 87-89.
[54] Pleonsil Pornthip, Suphan Soogarun, Yaneenart Suwanwong. Activité antioxydante de holo- et apo-c-phycocyanine et leurs effets protecteurs sur les érythrocytes humains [J]. International Journal of Biological Macromolecules, 2013, 60: 393-398.
-
Précédent précédent
Quelles sont les utilisations de l’astaxanthine dans l’alimentation par couche?
-
Suivant:
Qu’est-ce que la phycocyanine colorante alimentaire naturelle?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




