Qu’est-ce que β 1 3 glucane?
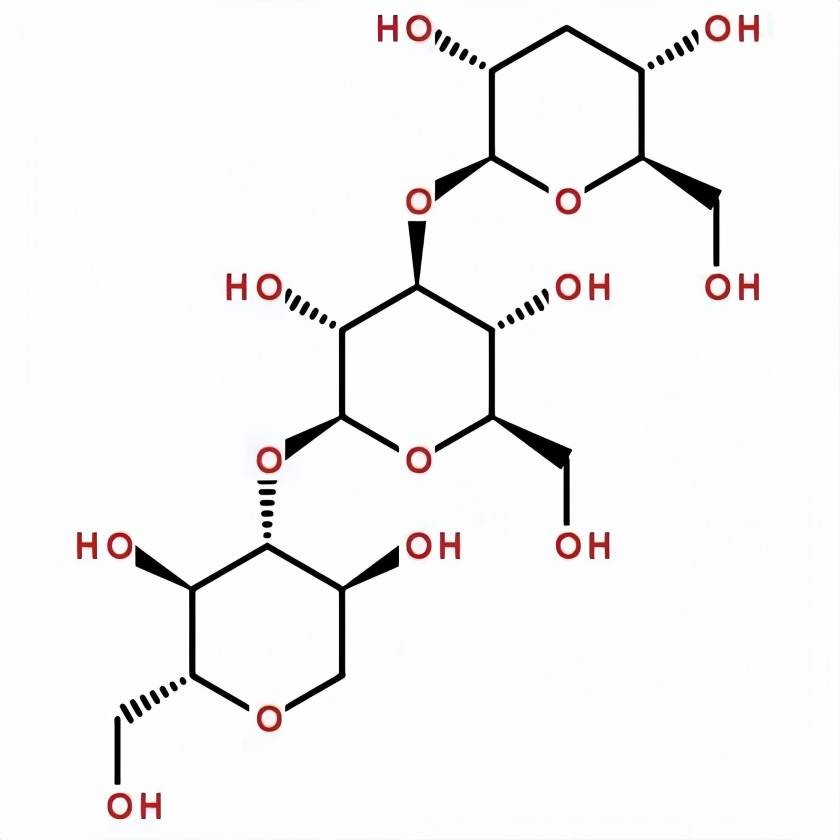
bêta-1,3-glucaneEst une classe de polysaccharides hautement moléculaires largement trouvés dans lA anature, avec une chaîne principale d’unités de glucose liées par des liaisons bêta-1,3-glycosidiques. Certains β-1,3-glucanes naturels contiennent également des chaînes latérales liées par des liaisons β-1,6-glycosidiques dans des proportions Et ettailles variables. Par exemple, les chaînes latérales du fucoidan des algues brunes contiennent environ 30% de structures ramifiées liées au β-1,6 Et etsont donc solubles dans l’eau [1]. Les β-1,3-glucanes naturels sont largement distribués dans les champignons, les bactéries Et etles plantes. Les β-1,3-glucanes communs comprennent le fucoidan, le carraghène, le glucane de levure, le polysaccharide de poria Cocos, le polysaccharide de champignon shiitake, la callose, etc. En raison de la façon dont les liaisons β-1,3-glycosidiques sont reliées Et etdes interactions de liaison hydrogène entre les molécules, les β-1,3-glucanes à longue chaîne présentent généralement différentes structures tertiaires hélicoïdaux dans leur état naturel [2]. Ces structures tertiaires spéciales dotent les β-1,3-glucanes de diverses fonctions biologiques, y compris la régulation de l’immunité [3], la promotion de la prolifération des probiotiques intestinaux [4], la régulation de l’équilibre de la glycémie et la baisse du cholestérol [5]. L’activité biologique du β-1,3-glucane et sa structure tertiaire spéciale ont attiré l’attention répandue dans les domaines de l’alimentation, des produits chimiques quotidiens et de la médecine.
β-1,3-glucanase is a class of enzymes that can hydrolyze glucan linked by β-1,3-glycosidic bonds, and plays an important role dansthe biodegradation, reconstruction, and development and application of β-1,3-glucan. In nature, β-1,3-glucanase is widely distributed in archaea, bacteria, fungi, higher plants and animals. β-1,3-glucanase has a wide range of applications in the food and pharmaceutical industries, such as the preparation of low molecular weight β-1,3-glucan oligosaccharides, reducing the viscosity of beer fermentation broth, and inhibiting post-harvest pathogenic fungi in fruits and vegetables.
Bien que les chercheurs aient fait beaucoup de recherche sur l’expression et la purification, la structure moléculaire, les propriétés enzymatiques, et le mécanisme catalytique de la β-1,3-glucanase, la structure complexe de différents types de β-1,3-glucane limite son application large. La participation synergique des β-1,3-glucanases de différentes familles et avec différents modes d’action est nécessaire pour la dégradation efficace des β-1,3-glucanes complexes. Par conséquent, une compréhension approfondie de la structure, de la fonction et du mode catalytique de différents types de β-1,3-glucanases est d’une grande importance pour l’application et la modification moléculaire ultérieure des β-1,3-glucanases. Cet article résume les progrès de la recherche dans les domaines de la structure, de la fonction et de l’application des β-1,3 glucanases typiques, dans le but de fournir une référence pour les recherches ultérieures sur leurs mécanismes catalytiques et leur application dans les domaines de l’alimentation, de la médecine et d’autres domaines.
1 Classification du β-1,3 glucane et de leurs mécanismes catalytiques
Les β-1,3 glucanases peuvent être divisées en endo-type et exo-type selon leur mode catalytique. Endo-β-1,3-glucanase (EC 3.2.1.39), également connue sous le nom d’enzyme polysaccharidique kombu, est une enzyme qui hydrolyse spécifiquement les liaisons β-1,3-glycosidiques dans les chaînes de sucre β-1,3-glucane. Il joue un rôle biologique clé dans la décomposition et la reconstruction du β-1,3-glucane dans la nature et sa famille. Les endo-1,3 -β-glucanases hydrolysent le β-1,3-glucane de l’intérieur de la chaîne du sucre, produisant une série d’oligosaccharides avec différents degrés de polymérisation. L’exo -β-1,3-glucanase (EC 3.2.1.58) hydrolyse les substrats β-1,3-glucane l’un après l’autre à partir de l’extrémité non réductrice de la chaîne du sucre. Les produits hydrolysés sont généralement du glucose ou des oligosaccharides simples, et ils jouent un rôle de soutien dans la dégradation du β-1,3-glucane. Sur la base de leur relation évolutive, les β-1,3-glucanases découvertes peuvent être classées en 12 familles de glycoside hydrolase (GH) selon la base de données CAZy (http://www.cazy.org/). Parmi elles, les endo-β-1,3-glucanases peuvent être classées en 9 familles de GH (Figure 1): GH16, GH17, GH55, GH64, GH81, GH128, GH152, GH157 et GH158; Les exo-β-1,3-glucanases découvertes peuvent être classées en 6 familles de GH: GH3, GH5, GH17, GH55, GH128 et GH132.
Les β-1,3-glucanases ont deux mécanismes d’hydrolyse, à savoir le mécanisme conservateur et le mécanisme inverse [6]. Le processus catalytique du mécanisme d’hydrolyse retenue est divisé en deux étapes. Tout d’abord, le résidu d’acide glutamique dans le centre actif agit comme un acide général (donneur d’électrons) pour fournir un proton à l’oxygène de la liaison glycosidique pour enlever le groupe restant, briser la liaison β-1,3-glycosidique, et former un intermédiaire enzyme-glycoside.
Par la suite, le résidu d’acide glutamique dans le centre actif agit comme une base large, aidant la molécule d’eau à attaquer la position carbone hétéroatome de l’intermédiaire enzyme-glycoside. Enfin, la liaison β-1,3-glycosidique du substrat est hydrolysée, formant le produit hydrolytique finAl., et al.Le mécanisme de rétention est ainsi appelé parce que la conformation du substrat est retenue par les deux inversions au niveau de l’hétéroatome carbone. Le mécanisme inverse de la β-1,3-glucanase implique deux résidus catalytiques conservés, un acide général et une base générale. Au cours de la réaction, l’acide général donne d’abord un proton au carbone anomérique du substrat, tandis que la base générale retire un proton d’une molécule d’eau, augmentant sa nucléophilicité et favorisant son attaque sur le centre du groupe anomérique, brisant ainsi la liaison glycosidique et générant le produit hydrolytique (Figure 2).
2. Sources et préparation du 1,3-glucane
β-1,3-glucan is mainly derived from fungi, bacteria, plants, insects and molluscs. Table 1 summarizes the typical β-1,3-glucanases from different sources that have been reported to have application potential. The main bacteria that have been reported to produce β-1,3-glucanase are Pyrococcus furiosus [7], Paenibacillus polymyxa [8], Bacillus lehensis G1 [9], Streptomyces sp. [10], etc. Fungi and plants are also important sources of β-1,3-glucanase, including Aspergillus fumigatus [11], Trichoderma asperellum [12], Phanerochaete chrysosporium [13], barley [14], grapes [15], etc.
Natural sources of β-1,3-glucans are abundant, stable in nature, and exhibit specific catalytic activity, showing unique application potential. For example, β-1,3-glucanase produced by Paenibacillus terrae [16] can effectively inhibit the growth of plant pathogenic fungi and play an important role in plant protection. β-1,3-glucanase derived from Arca inflata [17] has β-1,3-glucanase has high activity and exhibits an immune-enhancing effect on tumor necrosis factor.
Le β-1,3-glucane de Trichoderma harzianum [18] est une enzyme candidate idéale pour la production de β-1,3-oligosaccharides et peut être utilisé pour la préparation industrielle d’oligosaccharides. En plus de découvrir des β-1,3-glucanases avec d’excellentes propriétés à partir de sources naturelles, la technologie d’expression recombinante hétérologues peut également être utilisée pour découvrir et préparer des β-1,3-glucanases, élargissant ainsi leurs sources, augmentant les niveaux d’expression, et élargissant la portée des applications de β-1,3-glucanase.

Actuellement, les hôtes de l’expression recombinante du β-1,3-glucanes comprennent principalement Escherichia coli, Pichia pastoris, Bacillus subtilis, etc. Le système d’expression d’e. coli est plus mature technologiquement et relativement simple à utiliser que le système d’expression de levure, et est largement utilisé dans la découverte et la préparation de nouveaux β-1,3-glucane. Par exemple, le β-1,3-glucane provenant de sources telles que la levure antagoniste Pichia guilliermondii [19], le macrogénome des micro-organismes du rumen de l’orignal [20] et Pseudomonas aeruginosa [21] sont tous obtenus par préparation recombinante dans E. coli. Les enzymes sont toutes obtenues par la préparation recombinant d’escherichia coli. Le β-1,3-glucan moglube dérivé de Magnaporthe oryzae peut être exprimé efficacement par le système E. coli et présente une activité antifongique [22].
Bien que l’expression procaryote chez E. coli présente les avantages d’une croissance rapide et d’un faible coût, certains gènes eucaryotes ne peuvent pas s’exprimer efficacement parce que le système d’expression procaryote ne peut pas reconnaître les éléments de transcription et de traduction eucaryotes et n’a pas la fonction de modification post-translationelle. Par conséquent, ces dernières années, les chercheurs ont également couramment utilisé des systèmes d’expression eucaryotes pour exprimer la β-1,3-glucanase, tels que les systèmes d’expression de Pichia pastoris et de Bacillus subtilis [23]. Pendant le processus d’expression inductible de Pichia pastoris, la quantité de protéine sécrétée par elle-même est relativement faible, de sorte que la quantité d’expression de la protéine cible est relativement élevée.
Cependant, comme certains β-1,3-glucane ont un effet hydrolytique sur la paroi cellulaire de la levure, leur applicabilité doit être vérifiée expérimentalement. La technologie d’expression recombinante hétérologue est maintenant devenue une méthode importante pour la recherche et la préparation d’applications du β-1,3-glucane. Pendant ce temps, la combinaison de la biologie structurelle, de la biologie moléculaire, de l’évolution dirigée et d’autres méthodes de recherche pour modifier moléculaire le β-1,3-glucan obtenu par recombinaison hétérologue peut encore améliorer la performance catalytique et la valeur d’application de l’enzyme. Feng Jianwei Et al.[24] ont découvert un β-1,3-glucane thermophile provenant du compost. Par mutagénèse dirigée sur le site, les 160 acides aminés ont été changés de lysine en acide glutamique, ce qui a augmenté son activité enzymatique de 1 7%. Muhammed et al. [25] ont utilisé les programmes modeller et I-TASSER pour effectuer la modélisation homologique d’un β-1,3-glucan de la levure Wickerhamomyces normus NCYC 434. Par la suite, la stabilité thermique du modèle a été améliorée en utilisant SPDBViewer et AUTO-MUTE. On a constaté que le mutant E186R avait la meilleure stabilité thermique et que sa température de fusion était augmentée de 9,58 K.
3 Structure et mécanisme catalytique de l’endo-1,3-glucane
3.1 Endo -β-1,3-glucane
Endo -β-1,3-glucane, également connu sous le nom d’enzyme polysaccharidique kombu, peut spécifiquement hydrolyser et couper des liaisons β-1,3-glycosidiques au sort de l’intérieur des chaînes β-1,3-glucane, produisant des oligosaccharides de différentes longueurs. Il a été rapporté que les endo-β-1,3-glucanases sont principalement distribués dans les quatre familles de GH GH16, GH17, GH64 et GH81. Jusqu’à présent, la structure et le mécanisme catalytique des endo-β-1,3-glucanases de six familles de GH,GH16, GH17, GH64, GH81, GH128 et GH158, ont été résolus. Il y a eu peu de rapports sur la structure des endo-β-1,3-glucanases de GH55, GH152 et GH157, et leurs mécanismes catalytiques détaillés doivent encore être clarifiés.
3.1.1 endo de la famille GH16 -β-1,3-glucane
All GH16 family β-1,3-glucanJusqu’à présent, on a signalé des endotoxines, largement répandues chez les bactéries, les champignons et les archées, avec une prédominance de sources bactériennes. La structure tertiaire des β-1,3-glucanases de la famille GH16 est riche en β-plis. Ces chaînes sont pliées et pliées en deux structures lamellaires parallèles inversées face à face, formant une rainure catalytique longue et étroite pour lier des substrats à longue chaîne. La structure tridimensionnelle de la β-1,3-glucanase de la famille GH16 dans son ensemble est une structure en petits pains de gelée, également connue sous le nom de structure sandwich (Figure 3). Fibriansah et al. [26] ont rapporté en 2007 la structure d’une β-1,3-glucanase de la famille GH16 à action endome (BglF) dérivée de Nocardiopsis sp. et l’ont définie comme une structure de gelée β-pliée classique de type sandwich. Les β-1,3-glucanases de la famille GH16 suivent un mécanisme d’hydrolyse typique conservé, et des intermédiaires enzyme-substrat instables sont formés pendant la réaction [27].
La spécificité du substrat du β-1,3-glucane de la famille GH16 est directement liée à la structure de la rainure catalytique, et ils ont différentes capacités hydrolytiques pour différents substrats. Par exemple, la β-1,3-glucanase ZgLamA de la bactérie marine Zobellia galactanivorans a une efficacité catalytique presque 22 fois plus élevée pour le substrat polysaccharidique de kelp (laminarine) que pour le glucane à liaison mixte (ML G) (β-1,3-1,4-glucane). En effet, le centre catalytique de ZgLamA présente une conformation concave, propice à la fixation du β-1,3-glucane hélicoïdale plutôt que du β-1,3-1, 4-glucane linéaire (Figure 3B).

3.1.2 β-1,3-glucane de type endogène de la famille GH17
The GH17 family β-1,3-glucan includes both endo-type and exo-type, and most of them are endo-type, mainly derived from plants. At present, the GH17 family β-1,3-glucanase with a solved structure is all endo-type. GH17 family proteins have a typical (β/α) 8 TIN ° de catalogue(triose-phosphate isomerase) barrel structure (Figure 4), formed by 8 α-helices and 8 β-folds, which form a long and narrow catalytic groove on the surface of the entire enzyme that can accommodate long-chain substrates and run through. The β-chains in the core region of the barrel structure are highly conserved, and the main differences occur in the loop structures and helical structures on the periphery of the protein. GH17 family endo-β-1,3-glucanases, similar to GH16 family, follow a typical conserved hydrolysis reaction mechanism, and an unstable enzyme-glycoside intermediate is formed during the reaction.
Wojtkowiak et al. [35] ont obtenu la structure cristalline du co-cristal de l’endo -β-1,3-glucane (GLUB20-2) mutant E259A et du fucoidan (Figure 4B), qui est la première structure cristalline complexe d’une glycosidase de la famille GH17 et d’une molécule oligosaccharide obtenue par des chercheurs. Bien que son site actif ait été muté, GLUB20-2E259A avait encore une activité résiduelle. L’analyse par spectrométrie de masse a révélé que le mutant clivait l’hexose de fucoidan de deux façons, produisant deux molécules de trisaccharide à focuse ou une molécule de tétrasaccharide à focuse et une molécule de disaccharide à focuse. La rainure catalytique du GLUB20-2 forme une géométrie en forme de canyon avec des extrémités ouvertes et un milieu courbé, ce qui exclut la possibilité de substrats linéaires tels que le β-1,4-glucane se liant au site de liaison. Cela indique que la géométrie de la fissure du site actif détermine la spécificité du substrat de l’enzyme.
3.1.3 GH64 famille endo -β-1,3-glucane
Actuellement, toutes les protéines de la famille GH64 rapportées sont des β-1,3-glucanases de type endogène, principalement dérivées de bactéries. Les β-1,3-glucanases de type endogène de la famille GH64 sont également connues sous le nom de β-1,3-glucanases de type fucopentaose. Ils sont caractérisés par catalyser l’hydrolyse du β-1,3-glucane pour produire principalement du fucopentaose comme produit d’hydrolyse. La famille GH64 des endo-β-1,3-glucanases suit un mécanisme catalytique typique de l’invertase, avec des résidus d’acide aspartique près du centre catalytique agissant comme des bases à base large et des résidus d’acide glutamique agissant comme des acides à base large pour participer à la réaction d’hydrolyse. Wu et al. [39] ont obtenu une β-1,3-glucanase (LPHase) de la famille GH64 de Streptomyces matensis. LPHase se compose de deux domaines: le C-terminal est un domaine de structure α/β composé de α-hélice et de β-fold, et le N-terminal est un domaine composé de deux ensembles de β-plis parallèles inversés. Les deux domaines forment une rainure catalytique en forme de u (Figure 5).
Qin Zhen et al. [40] ont signalé le mode de liaison d’une β-1,3-glucanase de la famille GH64 (PbBgl64A) de Paenibacillus barengoltzii avec un kombu heptaose, dans lequel les deux chaînes oligosaccharides forment une hélice et se lient au canal catalytique de PbBgl64A en même temps (ill. 5B,C). La conformation de ces deux chaînes est presque identique à celle de la triple hélice dans la triple hélice β-1,3-glucane. Ceci suggère que le β-1,3-glucane peut être directement lié sous forme de triple hélice dans la rainure catalytique de la famille GH64 endo-β-1,3-glucanase. Le mode de liaison de la famille GH64 β-1,3-glucanase à latriple-helix β-1,3-glucan substrate is related to the plant disease process. The binding mode of the antifungal sweet protein to the β-1,3-glucan helical sugar chain is similar, indicating a novel binding mode of glycoside hydrolases directly binding to the substrate of the polysaccharide four-fold structure [41-42].
3.1.4 GH81 famille endo -β-1,3-glucane
Les protéines de la famille GH81 sont largement distribuées dans les bactéries, les champignons, les plantes et les archées, et toutes sont endo -β-1,3-glucane. Jusqu’à présent, les structures cristallines de trois β-1,3-glucanes de la famille GH81 ont été résolus: BhGH81 de Bacillus halodurans, CtLam81A de Clostridium thermocellum [43] et RmL am81A[44]. La β-1,3-glucanase de type endogène GH81 se compose de trois domaines structuraux. Le domaine N-terminal a une structure sandwich β-pliée et contient deux ensembles de feuilles β-pliées antiparallèles. Le domaine C-terminal a une structure typique (α/α) à 6 barils. Le petit domaine structurel entre les domaines N-terminal et C-terminal contient deux β-plis antiparallèles et deux α-hélices. Les trois domaines structuraux forment ensemble une rainure catalytique verticale longue, étroite (Fig. 6).
Ma Junwen et al. [45] ont signalé un β-1,3-glucane de la famille GH81 (RmLam81A) de Rhizomucor miehei et ont révélé sa reconnaissance du substrat et son mécanisme catalytique. Des études ont montré que RmLam81A peut lier le β-1,3-glucane triple-hélice et suivre un mécanisme rétrograde typique d’hydrolyse, qui est habituellement réalisé en une seule étape. Le résidu d’acide aspartique conservé au centre catalytique agit comme un acide général pour protoniser l’atome d’oxygène sur la liaison glycosidique, tandis que le résidu d’acide glutamique agit comme une base générale pour le déprotoner, brisant ainsi la liaison glycosidique et complétant le processus d’hydrolyse. Pluvinage et al. [46] ont signalé une β-1,3-glucanase (BhGH81) de la famille GH81 dérivée de la bactérie halotolérante Bacillus halodurans. La mutation du Glu542 en Gln ou de l’asp466 en Asn inactive complètement le BhGH8, ce qui indique que le Glu542 et l’asp466 sont ses principaux résidus catalytiques. De plus, la structure complexe de l’enzyme avec la chaîne polysaccharidique indique qu’elle peut lier au moins deux chaînes β-1,3-glucane séparées (Figure 6B), ce qui signifie que l’enzyme peut être en mesure de se lier directement à la triple hélice β-1,3-glucane (Figure 6C).
3.2 Exo -β-1,3-glucane
L’exo -β-1,3-glucanase hydrolyse le β-1,3-glucane en clivant les liaisons β-1,3-glycosidiques à la fin des chaînes, séquentiellement, pour produire du glucose ou des oligosaccharides simples. Les β-1,3-glucanases d’exo-type ont été trouvés être classés en six familles de GH: GH3, GH5, GH17, GH55, GH128 et GH132, dont la plupart appartiennent aux familles GH55 et GH5. Les structures cristalliques des β-1,3-glucanases exo-agissant des familles GH5, GH55 et GH128 ont été résolues, tandis que celles de GH3, GH17 et GH132 ont rarement été résolues.
La famille GH55 des β-1,3-glucanases est principalement dérivée de bactéries et de champignons, et la plupart d’entre eux exo-agissent. Les protéines de la famille GH55 ont deux domaines β-hélicoïdaux droitiers parallèles qui forment une structure similaire aux côtes de la poitrine. Les extrémités N-terminal et C-terminal ont chacune 7 et 10 bobines composées respectivement de domaines β-hélicoïdaux droitiers, reliées par un segment de résidus d’acides aminés. Le résidu comporte deux β contre-parallèles et le site catalytique est situé entre les deux domaines (Figure 7A). Bianchetti et al. [47] ont constaté que la structure du complexe de substrat de l’exo-type β-1,3-glucanase (sacteLam55A) dérivée de Streptomyces (Setreptomyces sp.) a montré que l’exo-type β-1,3-glucanases de la famille GH55 a un sillon catalytique de poche avec six sites de liaison glycosidique, ce qui peut successivement isoler les monosaccharides de glucose de l’extrémité non réductrice de la chaîne du sucre (Figure 7b). Les protéines de la famille GH55 suivent un mécanisme catalytique rétroactif. L’acide général donne d’abord un proton au substrat.#39; S hétéroatome carbone, tandis que la base générale retire un proton de la molécule d’eau, augmentant sa nucléophilicité et favorisant son attaque sur le centre de l’hétéroatome, brisant ainsi la liaison glycosidique et produisant le produit hydrolytique. Papageorgiou et al. [48] ont découvert une β-1,3-glucanase (CtLam55) dérivée de Chaetomium thermophilum, et ont déterminé que le Glu654 est un résidu catalytique clé au moyen d’une comparaison structurale et d’une mutagenèse dirigée vers le site.
3.3 GH128 famille β-1,3-glucane
Ces dernières années, de nouvelles β-1,3-glucanases ont été découvertes et sont classées dans la famille GH128 dans la base de données CAZy. Les β-1,3-glucanases de la famille GH128 appartiennent à la superfamille GH-A et ont une région de liaison des glucides et une structure (α/β) de 8 barils [49]. La structure en fût est la plus courte de toutes les familles connues de GH128, avec une moyenne de seulement 240 résidus d’acides aminés [50]. Cette famille comprend les β-1,3-glucanases endo-agissant et exo-agissant.
Santos et al. [50] ont utilisé le regroupement de réseaux de similarité de séquence pour diviser la famille GH128 en sept sous-groupes, et ont analysé le mode de liaison du substrat de chaque sous-groupe. Ils ont constaté que le mode de liaison du substrat des β-1,3-glucanases de la famille GH128 est étroitement lié aux interactions hydrophobes, et que parmi les sept sous-groupes, les chaînes de sucre se lient à l’enzyme de deux manières différentes: «pliées» et «plates» [50]. De plus, la β-1,3-glucanase de la famille GH128 de la troisième sous-famille peut également se lier directement à la chaîne β-1,3-glucane à triple hélice.
3.4 autre β-1,3-glucane de la famille
En plus des β-1,3-glucanases typiques des familles susmentionnées, un petit nombre de β-1,3-glucanases exo-agissant avec une structure typique (β/α) 8 TIM barrel ont également été trouvées dans les familles GH3 et GH5, et elles suivent toutes un mécanisme catalytique conservé. La β-1,3-glucanase de la famille GH132 est connue sous le nom de protéine solaire et a été trouvée dans les champignons filamenteux et la levure [51]. Il y a eu peu de rapports sur les protéines de la famille GH132, et leurs structures protéiques et leurs mécanismes catalytiques ne sont pas encore clairs. La β-1,3-glucanase de la famille GH158 appartient à la superfamille GH-A. Jusqu’à présent, une seule analyse structurelle de la β-1,3-glucanase de la famille GH158 a été rapportée.
4 Applications de 1,3-glucane
4.1 β-1,3-glucane dans les applications antifongiques
The decay and deterioration of fruits and vegetables during postharvest transportation, storage and marketing is an important factor affecting the quality, shelf life and safety of human consumption. Decay caused by plant pathogenic fungi is the main cause of postharvest losses of fruits and vegetables. Fungi are eukaryotic organisms, and the cell wall is essential for the survival of fungal cells. Degradation of the cell wall can cause the fungal cells to lose their osmotic pressure balance, so destroying the integrity of the cell wall has become a potential antifungal measure. β-1,3-glucan is an important antibacterial protein secreted by biocontrol microorganisms, and plants themselves also induce the production of β-1,3-glucanase during the process of resisting fungal infection [53].
La β-1,3-glucanase peut dégrader les chaînes de sucre β-1,3-glucane dans la paroi cellulaire, provoquant la rupture ou la déformation de la mycélie des champignons pathogènes, ce qui entraîne une fuite du protoplasme des champignons pathogènes et inhibe la germination des spores. En outre, ce processus peut également libérer des inducteurs de fragments de paroi cellulaire fongique, induire l’induction immunitaire des plantes et favoriser indirectement l’accumulation de phytoalexines dans la plante hôte, augmentant ainsi sa résistance aux maladies [54]. La méthode de lutte biologique basée sur la β-1,3-glucanase peut efficacement prévenir et contrôler les maladies fongiques chez les plantes. Il présente les avantages de l’absence de résistance aux médicaments, ciblant uniquement l’agent pathogène cible sans nuire à d’autres organismes bénéfiques, aucun résidu de pesticide, et aucune toxicité ou pollution. Par conséquent, l’exploration du rôle de la β-1,3-glucanase dans la conservation post-récolte des fruits et légumes et le développement de nouveaux conservateurs biologiques verts à base de la β-1,3-glucanase est l’une des tendances de développement potentielles dans la technologie de conservation verte des fruits et légumes.
Lou Shubao et al. [55] ont déterminé l’activité de la β-1,3-glucanase dans les feuilles de soja et son effet antibactérien sur les champignons. Les résultats ont montré que l’activité de la β-1,3-glucanase de la plante a atteint un pic 48 heures après l’inoculation avec Phytophthora sojae. L’expérience antibactérienne a été réalisée en utilisant un extrait d’enzyme β-1,3-glucanase brut extrait 48 heures après l’inoculation. Il a été constaté que la solution enzymatique brute de β-1,3-glucanase a un effet inhibiteur significatif sur la croissance mycéliale et la germination des spores de Phytophthora sojae. Chen Xiaoyun et al. [56] ont montré que la β-1,3-glucanase a un effet significatif sur l’inhibition de la croissance de bactéries et de maladies dans les fruits tels que les pommes, les poires et les bananes après la récolte, et peut efficacement prévenir la pourriture post-récolte causée par les champignons. Cette caractéristique peut être utilisée pour le stockage et la conservation des fruits tropicaux. Rajninec et al. [57] ont constaté que la protéine β-1,3-glucanase brute de Drosera binate avait un effet inhibiteur sur la croissance de Rhizoctonia solani, Alternaria solani et Fusarium poae.
4.2 préparation β-1,3-glucane oligosaccharides fonctionnels
β-1,3-glucan, also known as fucoidan oligosaccharides, is a food functional factor with good biological activity, and has the activity of regulating the body' S l’immunité, la résistance aux infections et la régulation de l’équilibre de la flore intestinale. Les oligosaccharides de bêta-1,3-glucane préparés par hydrolyse de polysaccharides disponibles ou de polysaccharides de kelp peuvent être utilisés comme nouveau type de prébiotique dans le développement d’aliments fonctionnels. En outre, certains bêta-1,3-oligosaccharides solubles à petite molécule peuvent être utilisés comme activateurs immunitaires pour induire des réponses immunitaires chez les plantes et ainsi améliorer la résistance aux maladies des plantes. En outre, certains β-1,3-oligosaccharides solubles à petite molécule peuvent être utilisés comme activateurs immunitaires pour induire des réponses immunitaires chez les plantes, améliorant ainsi la résistance aux maladies des plantes. La β-1,3-glucanase hydrolyse le β-1,3-glucane pour préparer des β-1,3-oligosaccharides, qui présentent les avantages d’une grande spécificité et de peu de sous-produits. Il est considéré comme une méthode prometteuse pour produire des oligosaccharides. Wang Yanxin et al. [22] ont constaté que la β-1,3-glucanase (AcGluA) de la famille GH55 peut hydrolyser les polysaccharides de varech en une série d’oligosaccharides oligosaccharides, et des doses élevées d’oligosaccharides peuvent induire une réponse immunitaire dans les semis de riz, conférant ainsi une résistance aux éclats de riz. Cela montre que les produits hydrolytiques de la β-1,3-glucanase ont des effets de biocontrôle importants et fournissent des conseils pour l’application de la β-1,3-oligosaccharides.
Li Kuikui et al. [58] cloned and purified a novel β-1,3-glucanase (GcGluE) from Cellulosimicrobium cellulans....... L’analyse de la spécificité du substrat et des produits hydrolytiques a révélé que l’enzyme présentait l’activité hydrolytique la plus élevée sur les polysaccharides renouvelables, et les principaux produits hydrolytiques étaient les disaccharides et les trisaccharides. En outre, après le prétraitement d’homogénéisation, l’efficacité de dégradation de GcGluE sur xylan augmentera de 7,1 fois, ce qui a un certain potentiel d’application. Gao Minjie et al. [18] ont obtenu la β-1,3-glucanase de Trichoderma harzianum, et l’activité enzymatique pouvait atteindre jusqu’à 198.57 U/mL après 118 h de fermentation. Sur la base des caractéristiques de cette enzyme, un procédé de préparation d’oligosaccharides multifonctionnels par hydrolyse enzymatique du β-1,3-glucane a été établi, ce qui rend l’enzyme β-1,3-glucane a certaines perspectives d’application dans la production industrielle d’oligosaccharides.

4.3 Application du β-1,3-glucane dans l’industrie brassicole
En plus de son rôle important dans la production d’antifongiques et d’oligosaccharides, la β-1,3-glucanase peut également être utilisée dans l’industrie de la brasserie. Dans l’industrie brassicole, l’orge est la principale matière première pour la production de bière. Au cours du processus de production, certains micro-organismes sécrètent du β-1,3-glucane de poids moléculaire élevé dans l’espace extracellulaire, ce qui augmente la viscosité du liquide de fermentation, ce qui entraîne des difficultés de filtration. À terme, des gels floculants peuvent se former dans la bière, ce qui réduit la production de bière et augmente les coûts de brassage. Lili et al. [59] ont constaté que, si la β-1,3-glucanase est ajoutée au cours du processus de fermentation, la teneur en glucane à poids moléculaire élevé peut être considérablement réduite, réduisant ainsi la viscosité du bouillon de fermentation, atteignant ainsi l’objectif de la bière maigre et améliorant le processus de filtration.
4.4 β-1,3-glucane préparation de protoplastes de levure
The main chemical component of the yeast cell wall is β-glucan. One type is the relatively abundant β-1,3-glucan, which forms the skeleton of the yeast cell wall. The other type is the less abundant β-1,6-glucan, which fills the space. The key to preparing yeast protoplasts is to break down the insoluble β-1,3-glucan in the cell wall, so β-1,3-glucanase is an important preparation for protoplasts [60]. Duan Huike et al. [61] used the β-1,3-glucanase produced by the Trichoderma strain LE02 to enzymolyze and solubilize the beer yeast glucan. Macromolecular water-soluble yeast glucan can also be obtained by β-1,3-glucanase enzymolysis technology and ultrafiltration separation technology.
4.5 le β-1,3-glucane élimine les films biologiques
Les Biofilms sont des structures complexes composées de micro-organismes et de leurs sécrétions extracellulaires. Les principales bactéries d’altérer les aliments, comme Salmonella et Pseudomonas aeruginosa, produisent des biofilms qui peuvent réduire l’effet bactéricide des désinfectants et des antibiotiques couramment utilisés, ce qui pose un risque pour la salubrité des aliments. Le β-1,3-glucane est un composant important du biofilm de Candida albicans et joue un rôle important dans la matrice extracellulaire du biofilm. En revanche, la β-1,3-glucanase a un certain effet sur l’élimination du biofilm et peut contrôler les bactéries de détérioration dans l’industrie alimentaire. Nett et al. [62] ont constaté que le traitement du Candida avec de faibles concentrations de β-1,3-glucanase augmentait considérablement l’effet des médicaments antifongiques fluconazole et amphotéricine B sur le champignon. Mitchell et al. [63] ont également démontré expérimentalement que la sensibilité du médicament antifongique augmentait graduellement avec l’hydrolyse du β-1,3 glucane dans la matrice extracellulaire, ce qui indique que la β-1,3-glucanase a un certain effet sur l’élimination des films biologiques.
4.6 effet synergique du β-1,3-glucane et de la chitinase
La β-1,3-glucanase et la chitinase ont pour effet de dégrader le β-1,3-glucane et la chitine ainsi que le peptidoglycane dans la paroi cellulaire fongique. Les deux enzymes ont une résistance à large spectre dans la défense contre les parasites des plantes et les maladies, ce qui peut réduire l’utilisation de pesticides chimiques et réduire la pollution de l’environnement. Mauch et al. [64] ont constaté que l’action combinée de la chitinase et de la β-1,3-glucanase a un meilleur effet antibactérien que les enzymes individuelles, ce qui indique que les deux enzymes ont un effet synergique en inhibant la croissance de bactéries pathogènes. Cota et al. [65] ont constaté que l’effet synergique de la β-1,3-glucanase et de la chitinase peut résister de façon significative à l’impact d’alternaria alternata sur les tomates entreposage. Cela montre que la β-1,3-glucanase et la chitinase ont un effet synergique sur la conservation antibactérienne post-récolte des fruits et légumes, et ont une capacité antibactérienne plus forte qu’une souche simple, ainsi ils ont de bonnes perspectives d’application.
5 Conclusion
Parce que le β-1,3-glucane peut spécifiquement hydrolyser le β-1,3-glucane, il a des perspectives d’application importantes dans les domaines de la préparation fonctionnelle des oligosaccharides, de la conservation des fruits et légumes, de la biomédecine, et de la résistance aux maladies des plantes. Les chercheurs ont déjà étudié la structure, la fonction et l’application d’une série de différentes familles de β-1,3-glucanases. Dans ce contexte, les recherches ultérieures sur les β-1,3-glucanases seront axées sur la façon d’obtenir de nouvelles β-1,3-glucanases ayant de bonnes propriétés d’application et d’obtenir leur préparation de fermentation efficace.
Cependant, en raison de la complexité des substrats naturels du β-1,3-glucane, l’efficacité catalytique des β-1,3-glucanases existantes pour différents types de substrats doit encore être améliorée, et l’hydrolyse enzymatique de certains substrats insolubles du β-1,3-glucane est encore difficile. En outre, la recherche sur la structure et la fonction des enzymes est une base importante pour explorer le mécanisme catalytique des enzymes, pour extraire les propriétés catalytiques des enzymes et pour mener des recherches sur la modification moléculaire des enzymes. Compte tenu de la complexité des substrats naturels de la β-1,3-glucane et de la diversité des familles de la β-1,3-glucanase, il est une tendance de développement d’étudier les différences dans la liaison de substrat et les mécanismes catalytiques de différentes familles de la β-1,3-glucanase, de clarifier le mécanisme de reconnaissance de substrat de la β-1,3-glucanase pour les molécules complexes de glucane, et d’explorer un système catalytique de combinaison multi-enzyme basé sur la β-1,3-glucanase afin de réaliser l’application efficace de la β-1,3-glucanase. La 1,3-glucanase est la tendance de développement pour son application efficace.
Référence:
[1] KADAM S U, TIWARI IB K,o’donnell C P. Extraction, structure et activités biofonctionnelles de laminarine à partir d’algues brunes [J]. International Journal of La nourritureScience and Technology, 2015, 50(1): 24-31. DOI:10.1111/ijfs.12692.
[2] MIYOSHI K, UEZU K, SAKURAI K, et al. Proposition d’une nouvelle forme de liaison d’hydrogène pour maintenir la triple hélice de curdlan [J]. Chimie &; Biodiversity, 2004, 1(6): 916-924. DOI:10.1002/cbdv.200490073.
[3] Fu Yunbin, Zhao Xiaoming, Du Yuguang. Progrès de la recherche sur l’activité biologique et l’application du polysaccharide de cydramon et de ses dérivés [J]. Food Science, 2012, 33(7): 315-319.
[4] SHIMIZU J, J,TSUCHIHASHI N, KUDOH K, et al. Le curdlan alimentaire augmente la prolifération des bifidobactéries dans le cecum des rats[J]. Bioscience Biotechnology and Biochemistry, 2001, 65(2): 466-469. DOI:10.1271/bbb.65.466.
[5] Yu Yonghua, Xu Feifei, Lin Lin, et al. Progrès de la recherche sur l’effet hypolipidémique du β-glucane de l’avoine [J]. Journal des Sciences cliniques et pathologiques, 2022, 42(2): 486-491. DOI:10.3978 / j.issn.2095-6959.2022.02.034.
[6] DAVIES G, HENRISSAT B. Structures et mécanismes des glycosyl hydrolases[J]. Structure, 1995, 3(9): 853-859. DOI:10.1016/S0969- 2126(01)00220-9.
[7] ILARI A, FIORILLO A, ANGELACCIO S,et al. Structure cristalline d’une endoglucanase de la famille 16 à partir de la base hyperthermophile d’un substrat Reconnaissance [J]. FEBS Journal, 2009, 276(4): 1048-1058. DOI:10.1111/ j.1742-4658.2008.06848.x.
[8]YUAN Y, ZHANG X, ZHANG H, et al. Dégradation GH5 β-1,3- 1,4-glucanase PpBglu5A pour le glucane dans Paenibacillus polymyxa KF-1[J]. Biochimie des procédés, 2020, 98: 183-192. DOI:10.1016/ j.procbio.2020.08.008.
[9]JAAFAR N R, KHOIRI N M, ISMAIL N F, et al. fonctionnel Caractérisation et spécificité du produit de l’endo -β-1,3-glucanase De la bactérie alcalophile, Bacillus lehensis G1[J]. Enzyme Et la technologie microbienne, 2020, 140: en milliers de tonnes 109625.
[10] SHI P, YAO G, YANG P, et al. Clonage, caractérisation et activité antifongique d’une endo-1,3-β-d-glucanase de Streptomyces sp. S27[J]. Applied Microbiology and Biotechnology, 2009, 85(5): 1483-1490. DOI:10.1007/s00253-009-2187-1.
[11]HARTL L, GASTEBOIS A,AIMANIANDAV,et al. Caractérisation de la endo β-1,3-glucanase Eng2 ancrée au gpi d’aspergillus fumigatus[J]. Mycogenetics and Biology, 2011, 48(2): 185-191. DOI:10.1016/j.fgb.2010.06.011.
[12]DA SILVA AIRES R,STEINDORFF A S, RAMADA M H S, et al. Caractérisation biochimique d’un 27 kDa 1,3-β-d-glucanase de Trichodermaasperellum induite par la paroi cellulaire de Rhizoctonia solani[J]. Glucides polymères, 2012, 87(2): 1219 — 1223. DOI:10.1016/ j.carbpol.2011.09.001.
[13] ISHIDA T, FUSHINOBU S, KAWAI R,et al. Structure cristalline de la glycoside hydrolase famille 55β-1,3-glucanase du basidiomycète Phanerochaetechrysosporium[J]. Journal of Biological La chimie,2009, 284(15): 10100-10109.
[14] VARGHESE J N, GARRETT T P, COLMAN P M, et al. Trois - Structures dimensionnelles de deux endohydrolases β-glucanes végétales avec des spécificités de substrat distinctes [J]. Actes de l’académie nationale Of Sciences of the United States of America, 1994, 91(7): 2785-2789.
[15]ROMERO Je, fernández-caballero C, GONI O, et al. Fonctionnalité d’une β-1,3-glucanase de classe I provenant de la peau de raisins de table Baies [J]. Science des plantes, 2008, 174(6): 641-648. DOI:10.1016 / j.plantsci.2008.03.019.
[16] YU W Q, ZHENG G P, QIU D DW, et al. Paenibacillus terrae NK3-4: un agent de biocontrôle potentiel qui produit la β-1,3-glucanase[J]. Contrôle biologique, 2019, 129: 92-101. DOI:10.1016/j.biocontrol.2018.09.019.
[17]L lC,WEN Y, Il Y a, Et al. La Purification Et caractérisation D’une nouvelle β-1,3-glucanase d’arca inflata et de son système immunitaire - Améliorer les effets [J]. Food Chemistry, 2019, 290: 1-9. DOI:10.1016/ j.foodchem.2019.03.131.
[18]GAO Minjie, YAN Jiajun, ZHAO Yue et al. Expression d’un β-1,3-glucanase thermostable de Trichoderma harzianum chez Pichia pastoris et utilisation dans l’hydrolyse des oligoglucosides [J]. Le processus Biochemistry, 2021, 107: 74-82.
[19]ZHANG D, SPADARO D, VALENTE S, et al. Clonage, caractérisation et expression d’un gène exo-1,3-β-glucanase de la levure antagoniste Pichia guilliermondii souche M8 contre la moule grise sur les pommes [J]. Biological Control, 2011, 59(2): 284-293. DOI:10.1016/j.biocontrol.2011.06.018.
[20]KALYANI D C, REICHENBACH T, ASPEBORG H, et Al. Une exo-β-1,3-glucanase bactérienne homodière dérivée du microbiome du rumen d’orignaux présente un cadre structural similaire à celui de la levure exo-β-1,3- Glucanases [J]. Enzyme and Microbial Technology, 2021, 143: 109723. DOI:10.1016/j.enzmictec.2020.109723.
[21]YI P, YAN Q, JIANG Z et al. L’invention concerne une première hydrolase glycoside de la famille 50 endo -β-1,3-d-glucanase de Pseudomonas aeruginosa[J]. Enzyme and Microbial Technology, 2018, 108: 34-41. DOI:10.1016/ j.enzmictec.2017.09.002.
[22]WANG Yanxin, ZHAO Yuqiang, WANG Xiaowen et al. La caractérisation fonctionnelle du nouveau β-1,3- glucanase MoGluB produisant des laminaripentaoses et son biocontrôle de Magnaporthe oryzae[J]. Journal of Agricultural and Food Chemistry, 2021, 69(33): 9571-9584.
[23] Cheng Zhengxiang. Expression de la β-1,3-glucanase chez Pichia pastoris [D]. Harbin: Harbin Institute of Technology, 2013: 5-10.
[24] FENG Jianwei, XU Shenyuan, FENG Ruirui, et al. Identification et Analyse structurelle d’une β-1,3-glucanase thermophile à partir de compost[J]. Bioresources and Bioprocessing, 2021, 8(1): 102-112. DOI:10.1186/ s40643-021-00449-4.
[25]MUHAMMED M T, SON ningué D, ningué zgningué F. structure tridimensionnelle Prédiction de la panomycocine, une nouvelle exo-β-1,3-glucanase isolée de Wickerhamomyces anorus NCYC 434 et le calcul Études de mutagénèse dirigées vers le site pour améliorer sa stabilité thermique pour des applications thérapeutiques [J]. Biologie et chimie computationnelle, 2019, 80: 270-2777. DOI:10.1016/j.compbiolchem.2019.04.006.
[26]FIBRIANSAH G, MASUDA S, KOIZUMI N, et al. La structure cristalline de 1,3 angstrom d’une nouvelle endo-β-1,3-glucanase de la famille glycoside hydrolase 16 de la souche F96 d’alkaliphilic Nocardiopsis sp. [J]. Protein, En 2007,69(3): 683-690.
[27]VUONG T V, WILSON D B. hydrolases Glycoside: diversité catalytique base/ nucléophile [J]. Biotechnology and Bioengineering, 2010, 107(2): 195-205. DOI:10.1002/bit.22838.
[28]ILARI A, FIORILLO A, ANGELACCIO S, et al. Structure cristalline d’une endoglucanase de la famille 16 provenant de la base structurale hyperthermophile Pyrococcus furiosus de reconnaissance de substrat [J]. The FEBS Journal, 2009, 276(4): 1048-1058. DOI:10.1111/j.1742-4658.2008.06848.x.
[29]ODA M, INABA S, KAMIYAN et al. Caractérisation structurale et thermodynamique de l’endo-1,3 -β-glucanase: aperçu du mécanisme de reconnaissance du substrat [J]. BBA-Proteins Proteomics, 2018, 1866(3): 415-425.
[30]JENG W Y, WANG N C, LIN C T, et al. Structures cristallines de la Domaine catalytique laminarinase de Thermotoga maritima MSB8 dans un complexe avec des résidus essentiels d’inhibiteurs pour la sélection β-1,3-et β-1,4-glucane [J]. Journal of Biological Chemistry, 2011, 286(52): 45030-45040.
[31]HONG T Y, HSIAO YY, MENG M, et al. Le conseil des ministres 1.5 structure d’angstrom de l’endo-1,3 -β-glucanase de Streptomyces sioyaensis: évolution de la structure du site actif pour la spécificité de liaison de 1,3 -β-glucane et l’hydrolyse [J]. Acta Crystallographica Section D: biologie structurelle, 2008, 64: 964-970. DOI:10.1107/s0907444908021550.
[32]BLEICHER L, PRATES E T, GOMES T C F, et al. Base moléculaire de la thermostabilité et de la thermophilicité des laminarinases: structure aux rayons x de la laminarinase hyperthermostable de Rhodothermus marinus et simulations de dynamique moléculaire [J]. Journal of Physical Chemistry B, 2011, 115(24): 7940-7949. DOI:10.1021/jp200330z.
[33]LABOUREL A, JAM M, JEUDY A, et al. Le β-glucanaseZgLamA de Zobellia galactanivorans a développé un site actif plié adapté à une dégradation efficace de la laminarine algale [J]. Journal des sciences biologiques Chemistry, 2014, 289(4): 2027-2042.
[34]YANG J, XU Y Q, MIYAKAWA T, et al. Base moléculaire pour la reconnaissance et la catalyse de substrat par une laminarinase bactérienne marine [J]. Applied and Environmental Microbiology, 2020, 86(23): 15. DOI:10.1128/aem.01796-20.
[35]WOJTKOWIAK A, WITEK K, HENNIG J et al. Structures d’un mutant à site actif d’une plante 1,3-β-glucanase dans des produits complexes d’hydrolyse avec witholigosaccharides [J]. Acta Crystallographica Section D: Biological Crystallography, 2013, 69: 52-62. DOI:10.1107/s0907444912042175.
[36]RECEVEUR-BRECHO T V, CZJ ZEK M, BARRE A, A, et Al. Structure cristalline à 1,45 -
[37]UNFRIED F, BECKER S, ROBB C S, et coll. Mécanismes d’adaptation qui procurent des avantages concurrentiels aux bactérioidétes marins pendant les proliférations de microalgues [J]. ISME Journal, 2018, 12(12): 2894-2906. DOI:10.1038/s41396-018-0243-5.
[38]TAKASHIMA T, TAKU T, YAMANAKA T, et al. Structure cristalline et caractérisation biochimique de CJP38, une β-1,3-glucanase et allergène du pollen de Cryptomeria japonica [J]. Molecular Immunology, 2019, 116: 199-207.
[39]WU H M, LIU S W, HSU M T, et al. Structure, action mécaniste et résidus essentiels d’une enzyme GH-64, la β-1,3-glucanase productrice de laminaripentaose [J]. Journal of Biological Chemistry, 2009, 284(39): 26708-26715.
[40]QIN Zhen, YANG Dong, YOU Xin, et al. Le mécanisme de reconnaissance du β-1,3-glucane triple-hélicoïdal par une β-1,3-glucanase[J]. Chemical Communications, 2017, 53(67): 9368-9371. DOI:10.1039/c7cc03330c.
[41] GHOSH R, CHAKRABARTI C. Le temps de travail cristal Analyse de structure de NP24-I: une protéine semblable à la thaumatine [J]. Planta, 2008, 228(5): 883-890. DOI:10.1007/s00425-008-0790-5.
[42]HENRISSAT B, Le GARRON M L. : Comment faire? a L’hydrolase glycoside reconnaît un polyglucane hélicoïdal [J]. Structure, 2017, 25(9): 1319 — 1321. DOI:10.1016/j.str.2017.08.004.
[43]KUMAR K, CORREIA M A S, PIRES V l R, et Al. Roman Aperçu de la dégradation du β-1,3-glucane par le cellulosome De Clostridium thermocellum révélé par des études de structure et de fonction d’une hydrolase glycoside de la famille 81 [J]. Revue internationale Des macromolécules biologiques, 2018, 117: 890-901. DOI:10.1016/ j.ijbiomac.2018.06.003.
[44] ZHOU Peng, Peng,Mon - sunZhongzhou, YAN Qiaojuan et al. La structure d’une hydrolase glycoside de la famille 81 endo-β-1,3-glucanase[J]. Acta Crystallographica Section D: biologie structurelle, 2013, 69: 2027-2038. DOI:10.1107/s090744491301799x.
[45]MA Junwen, QIN Zhen, ZHOU Peng, Et al. Aperçu structurel de la reconnaissance du substrat et du mécanisme catalytique d’une hydrolase glycoside fongique de la famille 81 β-1,3-glucanase[J]. Enzyme and Microbial Technology, 2022, 153: 109948. [46] [traduction] PLUVINAGE B, FILLO A, MASSEL P, et al. L’analyse structurelle d’une hydrolase glycoside de la famille 81 implique sa reconnaissance de la structure quaternaire β-1,3- glucane [J]. Structure, 2017, 25(9): 1348-1359. DOI:10.1016/j.str.2017.06.019.
[47] BIANCHETTI C M, TAKASUKAT E, E,DEUTSCH S, et al. Site actif et liaison laminarine dans la famille d’hydrolase glycoside 55[J]. Journal of Biological Chemistry, 2015, 290(19): 11819-11832. DOI:10.1074/ JBC. M114.623579.
[48] PAPAGEORGIOU A C CHEN J, LI D. cristal Structure et implications biologiques d’une glycoside hydrolase de la famille 55 β-1,3- glucanase de Chaetomium thermophilum[J]. Biochimica et Biophysica acta-protéines et protéomique, 2017, 1865(8): 1030-1038. DOI:10.1016/j.bbapap.2017.05.002.
[49] JIA X, WANG C, DU X et al. L’hydrolyse spécifique de curdlan avec une nouvelle β-1,3-endoglucanase glycoside de la famille 128 contenant un module de liaison aux glucides [J]. Glucides polymères, 2021, 253: 117276-117286.
[50] SANTOS C R, COSTA P, VIEIRA P S, et autres. Aperçu structurel du clivage β-1,3-glucane par une famille d’hydrolase glycoside [J]. Nature Chemical Biology, 2020, 16(8): 920-929. DOI:10.1038/s41589-020- 0554-5.
[51] GASTEBOIS A, AIMANIANDA c, BACHELLIER-BASSI S, et al. Les protéines solaires appartiennent à une nouvelle famille d’enzymes modificatrices de β-(1,3) -glucane impliquées dans la morphogenèse fongique [J]. Journal of Biological Chemistry, 2013, 288(19): 13387-13396.
[52] ⊑ Jean G, TAMURA K, CABRERA A, et al. La synergie entre les glycosidases de surface cellulaire et les protéines de liaison au glycane dicte l’utilisation de β(1,3) -glucanes spécifiques par les bactéries intestinales humaines [J]. MBio, 2020, 11(2): 1-21.
[53]YAN F, YE X L, LI C H, et al. Isolement, purification, clonage de gènes Et expression d’une protéine antifongique de Bacillus amyloliquefaciens MG - 3 [J]. Food Chemistry, 2 0 2 1, 1 2 3 4 9: 7. Les droits de l’homme DOI: 1 0. 1 0 1 6 / j.foodchem.2021.129130.
[54] [traduction] FESEL P H, ZUCCARO a.β-glucane: composant crucial de la paroi cellulaire fongique et des plantes mampines incontrôlables [J]. Mycogenetics and Biology, 2016, 90: 53-60. DOI:10.1016/j.fgb.2015.12.004.
[55] Lou Shubao, Peng Dongjun, Wang Hui. Activité bactériostatique de la β-1,3-glucanase de soja [J]. Journal of Heilongjiang Bayi Agricultural University, 2008 (3): 27-29.
[56] Chen Xiaoyun, Li Jianbin, Lin Ying et autres. Application de β-1,3-glucanase et de chitinase dans la conservation des fruits tropicaux [J]. Food Industry Science and Technology, 2008(5): 294-296.
[57]RAJNINEC M, FRATRIKOVA M, BOSZORADOVA E, et al. La β-1,3-glucanase basique de Drosera binata présente un potentiel antifongique dans les plants de tabac transgéniques [J]. Plantes, 2021, 10(8): 1747-1762. DOI:10.3390/plants10081747.
[58]LI Kuikui, CHEN Wei, WANG Wenxia et autres. Dégradation efficace de la poudre de curdlan par une nouvelle endo-β-1,3-glucanase[J]. Glucides polymères, 2018, 201: 122-130. DOI:10.1016/j.carbpol.2018.08.048.
[59] Lv Lili, Wang Ruibin, Wang Jialin et al. Effet de la β-glucanase à haute efficacité sur le taux de filtration du moût [J]. Brewing Science and Technology, 2010(3): 75-77. DOI:10.13746/j.njkj.2010.03.028.
[60] Lin Kaijiang, Ruan Lijuan, Wang Longying. Recherche sur la préparation de protoplastes de levure avec la cellulase [J]. Science and Technology Bulletin, 1996, 12(2): 118-121.
[61] Duan Huike, Xiong Shanbo, Liu Haimei. Solubilisation enzymatique de la levure β-1,3-glucane et analyse du produit [J]. Food Science, 2008, 29(1): 185-189.
[62] NETT J, LINCOLN L, MARCHILLO K, et al. Rôle putatif des β-1,3 glucanes dans la résistance au biofilm de Candida albicans [J]. antimicrobien Agents and Chemotherapy, 2007, 51(2): 510-520. DOI:10.1128/ aac.01056-06.
[63]MITCHELL K F, TAFF H T, CUEVAS MA et al. Rôle de la matrice β-1,3 glucane dans la résistance antifongique des Biofilms non albicans Candida [J]. Antimicrobial Agents and Chemotherapy, 2013, 57(4): 1918-1920. DOI:10.1128/aac.02378-12.
[64] MAUCH F, MAUCH-MANI B, BOLLER T. hydrolases antifongiques dans les tissus de pois: II. Inhibition de la croissance fongique par des combinaisons de chitinase et de β-1,3-glucanase[J]. Physiologie végétale, 1988, 88(3): 936-942.
[65] cte I E, TRONCOSO -ROJAS R, SOTELO -monde R, et al. Chitinase et β-1,3-glucanase enzymatique Activités activités in Réponse à l’infection par Alternaria alternata évaluée dans deux Stades de développement de différentes variétés de fruits à la tomate [J]. Scientia a Horticoles, 2007, Paragraphe 112(1): 42-50.
-
Précédent précédent
Quelles sont les utilisations de la poudre de bêta glucane dans l’alimentation animale?
-
Suivant:
Quelles sont les méthodes de Production du Galacto Oligosaccharide (GOS)?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




