Comment produire D Arabinose?
D D Arabinitol is an important natural product that is widely found in lichen plants Et en plussome food-derived fungi. However, its natural content is low, Et en plusit requires a large amount De laraw materials in traditional processes, which seriously affects its economic benefits Et en plusmakes it unsuitable for large-scale production [1,2]. The chemical catalytic method uses nickel as a catalyst to undergo redox reactions, reducing arabinose to generate D-arabinitol. This is currently the most mainstream method for the industrial production De laD-arabinitol [3]. Although the chemical catalytic method can achieve industrial scale in the markEt etand the production technology is relatively mature, the production Le processusrequires the use De laexpensive catalysts and strict control De laconditions such as high temperature (100°C) and high pressure (40-60 bar) [4]. This not only pollutes the environment but also makes it difficult to separate and purify the subsequent products, resulting in high production costs [5].
Par rapport à la méthode catalytique chimique, les conditions de production requises pour la production biologique de D-arabinitol sont plus douces. La conversion des substances est réalisée par la croissance et le métabolisme des micro-organismes, et le produit obtenu est facile à séparer et à purifier, et la pureté et le rendement du D-arabinitol peuvent être améliorés [6,7], ce qui est plus conforme au concept d’être vert, économique et respectueux de l’environnement. Il existe deux méthodes biologiques principales: la fermentation microbienne et la transformation cellulaire au repos. La méthode de fermentation microbienne génère principalement du D-arabinitol par la conversion de substrats tels que le glycérol, le La xylose, le lactose, le glucose et le xylitol pendant la croissance microbienne et le métabolisme [8, 9]. La méthode de transformation des cellules de repos repose principalement sur la collecte et l’enrichissement du liquide bactérien cultivé pour préparer les cellules de repos, et utilise diverses enzymes présentes dans les cellules de repos pour convertir le D-arabinitol.
En résumé, les méthodes de production du D-arabinitol ont chacune leurs propres caractéristiques, mais la méthode biologique présente les avantages d’être verte, économique et respectueuse de l’environnement, car elle permet la conversion de substances par la croissance normale et le métabolisme des micro-organismes. En outre, les produits de la méthode biologique sont faciles à séparer et à purifier, ce qui améliore la pureté et le rendement du D-arabinitol. Bien que la méthode chimique catalytique reste la principale méthode de production, la méthode biologique est devenue ou devient une alternative plus prometteuse.
1. État actuel de la recherche sur la La Productionbiologique de D-arabitol
La levure à haute résistance à la pression osmotique est le principal micro-organisme dans la nature qui peut produire du D-arabitol. Sous pression osmotique élevée, les cellules de levure peuvent synthétiser et accumuler des polyols pour faire face au stress de déshydratation, protégeant ainsi les cellules contre les dommages. En 1956, Spencer et Al., et al.ont découvert que la levure à haute résistance à la pression osmotique pouvait produire une variété de polyols par la fermentation du glucose, y compris le D-arabitol[10]. En 1969, Onishi et al. ont découvert que le glucose pouvait être converti en xylitol sous l’action de micro-organismes, et que le D-arabinitol était un produit intermédiaire [11, 12]. Cette découverte a jeté les bases théoriques de la production biologique de xylitol et a attiré l’attention des chercheurs au pays et à l’étranger.
At present, research on the production De laD-arabinitol mainly focuses on strain screening and fermentation condition optimization. For example, Song Weibin et al. screened a strain of Saccharomyces cerevisiae that produces D-arabinitol À partir depollen, and improved the conversion rate after optimizing the fermentation conditions [12]. Li Ze et al. isolated a strain of Pichia pastoris L-84 from soil microorganisms that is resistant to high osmotic pressure and produces D-arabinitol, and carried out large-scale fermentation in a fermenter [13]. Saha et al. used a strain of Rhodotorula glutinis NRRLY-27624 obtained by screening from a wild honeycomb to optimize the fermentation conditions and finally achieve the fermentation of glucose to produce D-arabinitol, with a conversion rate of 48% [14][15].
Zhang Lili a isolé avec succès une souche à haut rendement de D-arabitol de Debaryomyces hansenii et a établi un modèle cinétique pour la fermentation de D-arabitol [16]. Nozaki a examiné une souche de Rhodotorula kofmei AJ14787 qui produit efficacement du D-arabitol. L’optimisation de la Fermentation a été réalisée en combinant la culture à température variable et l’alimentation continue de 700 g/L de glucose, et finalement le D-arabitol a été produit par Fermentation 206 g/L[17]. Cheng et al. ont appliqué l’évolution adaptative aux souches de Pichia pastoris, et le rendement a augmenté de 72,7% par rapport au type sauvage [18].
M Povelainen et al. ont construit une bactérie d’ingénierie Bacillus subtilis ATCC31094 qui produit du D-arabitol, qui a une efficacité de conversion allant jusqu’à 38% et a de bonnes perspectives d’application [19]. Des chercheurs subséquents ont découvert que les genres Candida[20], Kluyveromyces[21], Kodamea[22,23], Hansenula[24,25] et Debaryomyces[26] sont capables de produire du D-arabitol[27].
2. Voies métaboliques pour la Production biotechnologique de D-arabinitol
Dans la recherche actuelle, il a été constaté que des substrats tels que le glucose,xylose[28], le glycérol [29, 30] et le lactose [31] peuvent être utilisés pour la production de D-arabinitol. Il convient de noter que le glucose et le xylose figurent parmi les deux premières réserves de carbone dans la nature et sont donc largement considérés comme les substrats les plus rentables. Selon les rapports de recherche existants, la voie métabolique pour produire du D-arabitol à partir du glucose comprend principalement deux voies synthétiques, tandis que la voie métabolique possible pour produire du D-arabitol à partir du xylose n’a qu’une seule voie, la voie xylitol. Les trois voies métaboliques courantes du D-arabitol sont indiquées à la Figure 1.2.
Figure 1. Voie métabolique du Darabitol
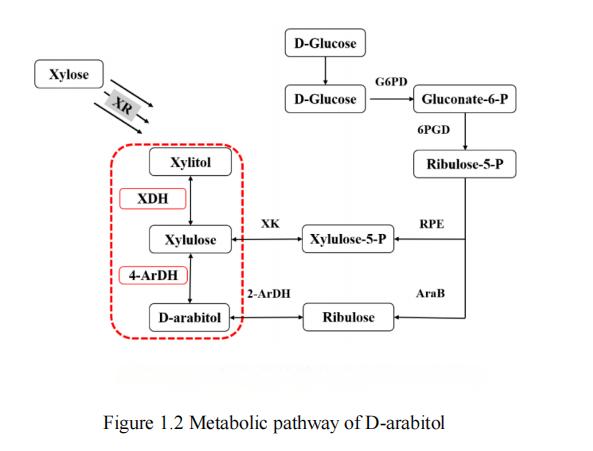
Deux voies synthétiques existent pour le processus métabolique de production de darabitol à partir du glucose: la voie de la ribulose et la voie de la xylulose. Dans ces processus, le glucose est d’abord phosphorylé en glucose-6-phosphate, puis converti en 5-phospho-D-ribulose par la voie du pentose phosphate (voie PPP), qui est un précurseur commun des voies de ribulose et de xylulose. La conversion du 5-phospho-D-ribose en D-ribulose par la ribulose kinase puis en D-arabinitol par le 2-ArDH forme la voie de la ribulose. Dans l’autre voie métabolique, le 5-phospho-D-ribose est isomérisé en D-xylulose-5-phosphate, puis déphosphorylé en D-xylulose. Ensuite, D-arabitol 4-déshydrogénase convertitXylulose en D-arabitol, formant ainsi la voie du xylulose [32].
La voie métabolique de production du D-arabitol à partir du xylose implique principalement une voie synthétique, la voie du xylitol. Dans ce processus, la xylose réductase transforme d’abord la xylose en xylitol. Par la suite, la xylitol déshydrogénase (XDH) réduit le xylitol en D-xylulose. Enfin, la D-arabitol déshydrogénase (ArDH) convertit la D-xylulose en D-arabitol, complétant ainsi la synthèse de la voie xylitol.
En résumé, le glucose et le xylose, deux substrats courants et peu coûteux dans l’ingénierie biométabolique, peuvent être utilisés pour produire du D-arabinitol par diverses voies telles que la voie du pentose phosphate, la voie du xylulose et la voie du xylitol. Ces voies métaboliques fournissent aux chercheurs une multitude de stratégies de biosynthèse, qui aideront à approfondir et optimiser le processus de production du D-arabinitol pour répondre aux besoins des alcools de sucre fonctionnels dans des applications pratiques.
3. Facteurs affectant la Production de D-Arabinitol par Fermentation microbienne
Pendant le processus de fermentation, le rendement de D-arabinitol peut être limité par divers facteurs. À l’heure actuelle, le rendement de D-arabinitol peut être efficacement augmenté en optimisant les conditions de fermentation, telles que le pH, la température, la composition de la source de carbone et d’azote, la taille de l’inoculum, la vitesse de rotation et la concentration en oxygène dissous [33, 34]. Ces facteurs sont étroitement liés aux processus métaboliques de l’hôte de production. En ajustant ces paramètres, les conditions idéales de fermentation peuvent être établies pour augmenter le rendement de fermentation.
À l’heure actuelle, la plupart des recherches sur la production biologique de D-arabinitol se concentrent sur la fermentation de D-arabinitol à partir du glucose, et il y a moins de recherches sur la production de D-arabinitol à partir de xylose. On sait que de nombreuses levures produisent du D-arabinitol pendant la croissance du glucose, mais on sait que peu de levures produisent du D-arabinitol à partir de xylose. En 2018, Jagtap et al. [28] ont d’abord signalé que Rhodosporidium toruloides IFO0880 peut produire du D-arabinitol à partir de xylose dans un milieu riche en azote. C’est la première fois qu’on découvre qu’une levure naturelle peut utiliser le xylose comme seule source de carbone pour produire du D-arabinitol, ce qui confirme l’existence d’une voie xylitol dans le processus métabolique de production biologique du D-arabinitol. Dans ce processus, le xylose est d’abord converti en xylitol par la xylose réductase. Par la suite, le xylitol est réduit en D-xylulose par XDH. Enfin, l’ardh convertit le D-xylulose en D-arabinitol.

Une concentration initiale plus élevée du substrat peut exercer une pression osmotique sur la souche de fermentation, favorisant la réaction de bioconversion en avant et augmentant ainsi le rendement de D-arabitol. Par exemple, lors de la fermentation de Debaryomyces hansenii SBP-1, l’utilisation de 150 g/L de xylose peut augmenter le rendement de D-arabitol de 2,23 fois par rapport à l’utilisation de 70 g/L de xylose. Pendant la fermentation avec Debaryomyces hansenii NRRLY-7483, l’utilisation de 1,5% de glycérol peut augmenter la production de D-arabitol de 4 à 5 fois par rapport à 0,5% de glycérol [35]. Pendant la croissance et le métabolisme de Candida:sp. H2 [36], la production de D-arabinitol a augmenté de manière significative avec l’augmentation de la concentration de glucose, 250 g/L de glucose étant la concentration initiale optimale de sucre. Cependant, une concentration de substrat trop élevée peut également être préjudiciable à la synthèse du D-arabitol. Par exemple, lors de la culture de Zygosaccharomyces rouxii JM-C46, la production de D-arabitol n’a pas augmenté davantage lorsque la concentration en glucose a été augmentée de 200 g/L à 250 g/L.
Nitrogen sources are key elements in microbial fermentation systems and are closely related to the regulation of microbial growth and metabolism. For example, the optimal nitrogen source for Candida sp. H2[37] and Candida quercitrusa is yeast extract, while ammonium sulfate is the optimal nitrogen source for Pichia Manchurica[38] and Debaryomyces Hansenii. Kumdam[39] and Loman[40] found that adding an appropriate amount of nitrogen source to the medium can increase the production of D-arabitol. Similarly, Jagtap et al. found that Rhodosporidium toruloides IFO0880 can convert xylose to produce high titers of D-arabitol in nitrogen-rich media. The yield of D-arabitol increased with the increase of nitrogen content in the medium. However, high nitrogen concentrations may be detrimental to the production of D-arabitol by Kluyveromyces ohmeri strains [41].
Pendant la fermentation microbienne, l’ajout de la bonne quantité d’ions métalliques peut maintenir l’équilibre de pression osmotique du fluide intracellulaire, augmenter l’activité des enzymes intracellulaires, et favoriser la croissance microbienne et le métabolisme. Yoshikawa a étudié l’effet des ions métalliques sur la production de D-arabinitol par Candida quercitrusa eta constaté que les ions calcium favorisent la production de D-arabinitol. La raison en est que les ions calcium pénètrent dans la cellule et augmentent l’activité des enzymes dans la croissance cellulaire et la voie du métabolisme. Dans une autre étude, Kumdam [42] et Sundaramoorthy ont constaté que les ions zinc, fer, manganèse et cuivre peuvent favoriser le métabolisme de la croissance des souches Debaryomyces nepalensis et Pichia Manchurica et augmenter la production de D-arabinitol.
3.1 Xylitol déshydrogénase
La Xylitol déshydrogénase est une enzyme clé limitant le taux dans la voie de biosynthèse pour la production de D-arabinitol. XDH joue un rôle vital dans le métabolisme du xylose par les micro-organismes pour produire du D-arabinitol. En tant qu’enzyme redox réversible, l’activité catalytique du XDH dépend des cofacteurs NAD+ et NADH [43,44].
This enzyme is mainly found in yeasts that ferment xylose to produce xylitol, comme Paecilomyces taphios, Candida shehatae et Pichiastipitis [45]. Les champignons filamenteux comme Fusarium oxysporum et Neurospora crassa sont également des sources importantes de XDH. Il est à noter que la séquence centrale active de ces XDH provenant de différentes espèces est fortement conservée [46].
Masakazu et al. [47] ont cloné le gène XDH du Gluconobacter oxycans ATCC621, Zhang et al. [48] ont étudié le gène XDH du Gluconobacter oxycans NH-10, et Qi et al. [49] ont cloné le gène XDH du Gluconobacter oxycans CGM CC 1.49.
Ces chercheurs ont cloné des gènes XDH de différentes souches et les ont exprimés avec succès dans Escherichia coli BL21. Ils ont également étudié les propriétés enzymatiques de XDH et ont constaté que les propriétés enzymatiques de ces XDH provenant de différentes sources sont similaires dans une certaine mesure. D’autres études ont révélé que la XDH appartient à la famille des déshydrogénases à chaîne courte. Dans la réaction d’oxydation du xylitol avec NAD+ comme coenzyme, le pH optimal de XDH est de 11; Alors que dans la réaction de réduction de D-xylulose avec NADH comme coenzyme, le pH optimal de XDH est de 5. On peut donc en déduire que le pH optimal de XDH dans la réaction d’oxydation est dans le domaine alcalin, tandis que le pH optimal dans la réaction de réduction est dans le domaine acide.
En résumé, XDH est biologiquement important. Les propriétés enzymatiques du XDH varient selon les souches, mais elles partagent toutes un certain degré de similarité en termes de séquence protéique et de propriétés enzymatiques. Les recherches actuelles montrent que XDH a différentes valeurs optimales de pH dans différentes conditions de réaction, ce qui fournit une base pour d’autres recherches et applications de l’enzyme.
4 Modification moléculaire
XDH possède diverses propriétés catalytiques et joue un rôle important dans la biocatalyse. Cependant, les enzymes naturelles présentent encore des limites en termes d’activité, de spectre de substrat et de spécificité catalytique, ce qui rend difficile l’obtention d’un niveau de rendement optimal. Ces dernières années, des stratégies d’ingénierie protéique telles que l’évolution dirigée, la conception rationnelle et la conception semi-rationnelle ont été largement utilisées dans la modification enzymatique. Ces stratégies peuvent améliorer efficacement la performance des enzymes afin de mieux répondre aux besoins réels de production.
5 évolution dirigée
Depuis que Frances H. Arnold a proposé pour la première fois le concept d’évolution dirigée en 1993, ce domaine a fait des progrès remarquables au cours des dernières décennies [50]. L’idée de base de l’évolution dirigée, qui joue un rôle important dans l’ingénierie enzymatique, est de simuler le processus d’évolution naturel, d’introduire des mutations aléatoires artificielles et de crier les mutants à haute performance.
En outre, la stratégie d’évolution dirigée a l’avantage de pouvoir modifier efficacement la fonction des enzymes sans une compréhension profonde de leur structure, fonction et mécanisme catalytique. Les principales étapes de la stratégie d’évolution dirigée comprennent la construction de mutants et la projection de bibliothèques mutantes. Ce processus utilise des techniques de mutation aléatoire et de recombinaison génétique telles que la PCR sujette aux erreurs et le brassage de l’adn [51].
L’application de ces techniques a considérablement amélioré l’efficacité de la construction de mutants et la diversité des bibliothèques de mutants. Cependant, la mise en œuvre de stratégies d’évolution dirigée fait face à certains défis, en particulier à l’étape de dépistage à haut débit [52]. Le crible à haut débit, en tant que méthode permettant d’identifier et de sélectionner rapidement les mutants supérieurs, est essentiel au processus d’évolution dirigée [53].
La méthode de criblage à haut débit pour une bibliothèque de mutants spécifique doit être spécifiquement conçue en fonction du produit cible, il n’existe donc pas de méthode de criblage universelle. La conception spécifique et les défis du processus de sélection à ce stade ajoutent sans aucun doute à la complexité de la stratégie d’évolution dirigée. Dans l’ensemble, malgré la conception spécifique et les défis de la méthode de crible à haut débit, la technologie d’évolution dirigée est toujours considérée comme un outil efficace pour le génie moléculaire des enzymes. Ses contributions significatives et ses tendances continues de développement indiquent que ce domaine continuera à jouer un rôle important dans la biotechnologie et les domaines connexes.
Référence:
[1]Escalante J, J, Caminal G, Figueredo M, et al. Production of arabitol from Gl ucose par Hansenula polymorpha[J]. Revue de presse De Fermentation and Anneau de Bioenginee, 1990,70(4):228-231.
[2]Moran J W, Witter L D. effet des sucres sur la production de darabitol et le métabolisme du glucose chez saccharomyces Rouxii [J].Revue de presseof bactériology, 1979,138(3):823- 831.
[3]Murthy SN, Kumdam H, Gummadi SN. Production d’arabitol par biosynthèse microbienne Et applications futures [J].Revue internationale des Sciences de base &appliquéResearch, 2014, 1:1-12.
[4]Kumdam H, Narayana M S, Gummadi S N. Production d’éthanol et d’arabitol par Debaryomyces Népalais: influence of Le processus Paramètres [J]. A propos de AMB Express, 2013,3(1):23.
[5]Zhang G, LinY, He P, et al. Caractérisation de la levure Pichia productrice d’alcool sucrier Anomala [J]. Revue de presse of industriel La microbiologie & Biotechnology, 2014,41(1):41-48.
[6] Huang Wei, Wang Xiaodan, Li Dounan, et al. Progrès de la recherche sur la fermentation microbienne du D-arabitol [J]. China Brewing, 2017, 36(09): 6-10.
[7] Ding Xiaobing, Li Zongwei, Yang Zhuanqin, et al. Chromatographie papier améliorée pour déterminer la teneur en isoleucine dans un liquide producteur d’enzymes [J]. Food Industry Science and Technology, 2009, 30(08): 314-315.
[8] Akinosho H, Rydzak T, Borole A, et al. Défis toxicologiques à la production de bioéthanol microbien et stratégies pour améliorer la tolérance [J]. Ecotoxicology, 2015, 24(10):2156-2174.
[9] Qian Weidong, Ning Xiaoxiao, Wang Lan, et al. Méthode de criblage rapide des souches de levure D-arabinitol à haut rendement [J]. Journal of Shaanxi University of Science and Technology, 2014(6):129-133.
[10] Spencer J F T, Sallans H R. Production d’alcools polyhydriques par levures osmophiles [J]. Revue canadienne de microbiologie, 1956, 2(2):72-79.
[11] Onishi H, Suzuki T. production microbienne de xylitol à partir du glucose [J]. Applied Microbiology, 1970, 18(6):1031-1035.
[12] Song Weibin, Lin Yanqing, Hu Haiyan, et al. Criblage et identification des souches produisant du D-arabitol et optimisation des conditions de production du D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[13] Li Ze, Zhao Xiangying, Liu Jianjun. Criblage et identification des souches de levure produisant du D-arabinol [J]. Food Industry, 2012, 33(10): 27-30.
[14]Guo Q, ZabedH, Zhang H, et al. Optimisation du milieu de fermentation pour une souche de levure récemment isolée (Zygosaccharomyces rouxii JM-C46) et évaluation des facteurs affectant la biosynthèse du darabitol [J]. Sciences de l’alimentation & Technology, 019,99:319- 327.
[15]Saha B C, SakakibaraY, Cotta M A. Production de darabitol par un Zygosaccharomyces rouxii récemment isolé [J]. Journal of industrielLa microbiologieand Biotechnol- ogy, 2007,34(7):519-523.
[16] Zhang Lili. Criblage de souches de levure D-arabinitol à haut rendement et étude de leurs conditions de fermentation [D]. Université de Jiangnan, 2009.
[17]Nozaki H, Suzuki S, Tsuyoshi N, et al. Production de darabitol par Metschnikowia reukaufii AJ14787[J]. Les biosciences, La biotechnologie and Biochemistry, 2003,67(9):1923-1929.
[18]Cheng H, Lv J, Wang H, et al. Levure de Pichiapastoris génétiquement modifiée pour la conversion du glucose en xylitol par un procédé de fermentation unique [J]. Applied Mi- crobiology and Biotechnology, 2014,98(8):3539-3552.
[19]Zheng S, Jiang B, Zhang T et al. Mutagenèse combinée et régulation métabolique pour améliorer la production de darabitol à partir de Candida parapsilosis[J]. Journal of industrial La microbiologie& Biotechnology, 2020,47(4):425-435.
[20] Wang L, Hui M, Yin Y, et al. Isolement et criblage d’une souche D-arabitol à haut rendement [J]. Journal of Food Safety and Quality Testing, 2014, 5(12):4018-4025.
[21] Toyoda T, Ohtaguchi K. effet de la température sur la production de Darabitol à partir du lactose par Kluyveromyces lactis [J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(9):1179-1185.
[22] Cai Li, Zhang Yang, Zhu Hongyang et al. Isolement, criblage et identification d’une souche produisant du D-arabitol [J]. Food and Fermentation Industry, 2009, 35(01): 23-26.
[23] Saha B C, Cotta S M A. Production de d-arabitol par un Zygosaccharomyces nouvellement isolé rouxii[J]. Journal of Industrial Microbiology & Biotechnology, 2007,34(7):519-523.
[24] Qian Weidong, Ning Xiaoxiao, Zhao Dezhi et al. Améliorer la fermentation de Hansenula polymorpha pour produire du D-arabitol à l’aide d’une stratégie combinée [J]. Anhui Agricultural Science, 2014, 42(23): 7726-7728.
[25] Wang Gang, Tang Xiaofang, Zhang Guodong. Recherche sur la conversion du glucose en arabitol par Hansenula anomala [J]. Shipin Gongye Ke-Ji, 2012(1):314-317.
[26] Zhang Lili, Liao Defang, Ding Chongyang et al. Fermentation du glucose par Hansenula polymorpha pour produire du D-arabitol [J]. Industrial Microbiology, 2010, 40(04):47-52.
[27] Dou Yuan. Ingénierie métabolique de Pichia pastoris et biosynthèse du D-arabinitol [D]. Université de Jiangsu, 2022.
[28]Jagtap S S, Rao C V. Production de darabitol à partir de xylose par la levure oléagineuse Rhodosporidium toruloides IFO0880[J]. Applied Microbiology and Biotech- nology, 2018,102(1):143-151.
[29]Yoshikawa J, HabeH, Morita T, et al. Production de darabitol à partir de glycérol brut par Candida Quercitrusa [J]. Applied Microbiology and Biotechnology, 2014,98(7):2947-2953.
[30] Wang Huilian, Yang Lianwan, Na Shumin, et coll. Recherche sur la production de glycérol et d’arabitol par des levures à haute résistance à la pression osmotique - iii. Conditions de production de glycérol par Zygosaccharomyces chevalieri Guill. 2.309 [J]. Acta Microbiologica Sinica, 1963(02):92-93.
[31] Toyoda T, Ohtaguchi K. rôle du lactose dans la production de Darabitol par Kluyveromyces lactis cultivé sur du lactose [J]. Applied Microbiology and Biotechnology, 2010, 87(2):691-701.
[32] Sun Wentao, Xu Hui, Liu Jianjun. Effet des additifs sur la fermentation du D-arabitol [J]. Food Science and Technology, 2013, 38(06): 12-16.
[33]Qi X, Zhang H, Magocha T A, et al. Amélioration de la production de xylitol en exprimant une déshydrogénase de novelDarabitol à partir de Gluconobacter isolé sp. JX-05 et co-bi- otransformation de cellules entières [J]. Bioresour Technology, 2017,235:50-58.
[34]Ravikumar Y, Ponpandian LN, Zhang G, et al. Harnessing l-arabinose isomerase for biological production ofDtagatose: Recent advances and its applications[J]. Tendances en sciences de l’alimentation & Technology, 2021,107:16-30.
[35]Koganti S, Ju L. Debaryomyces hansenii fermentation pour la production d’arabitol [J]. Biochemical Engineering Journal, 2013,79:112-119.
[36] Song Weibin, Lin Yanqing, Hu Haiyan et autres. Criblage et identification des souches produisant du D-arabitol et optimisation des conditions de production du D-arabitol [J]. Acta Microbiologica Sinica, 2011, 51(03): 332-339.
[37]Song Weibin, Lin Yanqing, Hu Haiyan et autres. Isolement et identification d’un nouveau Candida sp. H2 produisant du darabitol et optimisation de la production de darabitol [J]. Wei Sheng Wu Xue Bao, 2011,51(3):332-339.
[38]Sundaramoorthy B, Gummadi SN. Projection d’une nouvelle levure Pichia manchurica pour la production d’arabitol [J]. Journal of Basic Microbiology, 2019,59(3):256-266.
[39]Kumdam H, Narayana M S, Gummadi S N. Production d’éthanol et d’arabitol par Debaryomyces nepalensis: influence Des paramètres de processus [J]. A propos de AMB Express, 2013,3(1):23-28.
[40]Loman A A, Islam S, Ju L K. Production d’arabitol à partir de l’hydrolysat enzymatique de la farine de soja par fermentation Debaryomyces hansenii [J]. Applied Microbiology and Biotechnology, 2018,102(2):641-653.
[41]Zhu H Y, Xu H, Dai X Y, et al. Production de darabitol par un Ko- damaea ohmeri nouvellement isolé [J]. Bioprocess and Biosystems Engineering, 2010,33(5):565-571.
[42]Kumdam H, Murthy S N, Gummadi S N. Production d’éthanol et d’arabitol par Debaryomyces Népalais: influence of process Paramètres [J]. A propos de AMB Express, 2013,3(1):1-12.
[43]Ehrensberger AH,EllingRA, Wilson DK. Ingénierie guidée par la structure de la spécificité du cosubstrat xylitol déshydrogénase [J]. Structure, 2006,14(3):567-575.
[44] Yuan Junhua. Construction de bactéries génétiquement modifiées à base de la 1,3-propanediol déshydrogénase de Clostridium butyricum et biosynthèse de cellules entières du 1,3-propanediol [D]. Université de Jiangsu.
[45] Chen Gaoyun, Ye Kai, Tu Zhendong, et al. Progrès de la recherche sur la xylitol déshydrogénase [J]. Brewing Science and Technology, 2011(5):4.
[46] Zhang Huanhuan. Clonage et expression de gènes xylitol déshydrogénase et éthanol déshydrogénase à partir de Gluconobacter oxydans et biosynthèse de xylitol en cellules entières [D]. Université de Jiangsu, 2018.
[47]Sugiyama M, Suzuki S, Tonouchi N, et al. Clonage du gène xylitol déshydrogénase du Gluconobacter oxydans et amélioration de la production de xylitol à partir de md Arabitol [J]. Bioscience, Biotechnology and Biochemistry, 2003,67(3):584-591.
[48]Zhang J, Li S, Xu H et al. Purification de la xylitol déshydrogénase et amélioration de la production de xylitol en augmentant l’activité du XDH et l’approvisionnement en NADH dans les glucono-bacteroxydans [J]. Journal of Agricultural and Food Chemistry, 2013,61(11):2861- 2867.
[49]Qi X, Zhu J, Yun J et al. Production améliorée de xylitol: Expression de xylitol dehy- drogénase de Gluconobacter oxydans et culture mixte de cellules au repos [J]. Jour- nal of Bioscience and Bioengineering, 2016,122(3):257-262.
[50] il Peng. Modification moléculaire et analyse de mécanisme de l’efficacité catalytique améliorée du stéroïde P450 dihydroxylase CYP-cl3 [D]. Université de Jiangnan, 2022.
[51] Luo Yan. Clonage et co-expression des gènes arabitol déshydrogénase et xylitol déshydrogénase du Gluconobacter thailandicus D [D]. Université de Jiangsu, 2016.
[52] Zhang Yufei. Recherche sur la coproduction de l’acide 3-hydroxypropionique et du 1,3-propanediol par Lactobacillus reuteri [D]. Université de Jiangsu, 2021.
[53] Yuan Jiao. Construction d’une bactérie génétiquement modifiée à base de β-galactosidase et de L-arabinose isomérase et biosynthèse de D-tagatose [D]. Université de Jiangsu, 2021.


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais