Stduy sur Ginsenoside Rg1 Rb1 Rg3
La pharmacocinétique est l’étude des processus d’absorption, de distribution, de métabolisme et d’excrétion des médicaments dans le corps. C’est la clé pour étudier la forme et le mécanisme d’action des drogues. Ce n’est qu’en comprenant la pharmacocinétique d’un médicament que nous pourrons explorer en profondeur le mécanisme moléculaire de son action pharmacologique.
Ginsenosides are the madansactive ingredients dansthe precious Chinese medicinal herb ginseng. They have the functions De laenhanciN ° de cataloguememory [1], boosting immunity [2-3], improving blood vessels [4], regulating endocrine secretion [5], delaying aging [6] Et en plusfighting tumors [7]. In recent years, the pharmacokinetic researcH hof ginsenosides has become a hot topic of concern at home Et en plusabroad. A review is now given on the pharmacokinetics of ginsenosides dansthe body Et en plusthe factors affecting them.
1 pharmacocinétique de plusieurs monomères de ginsénoside
Bien que le ginseng, en tant que médecine traditionnelle chinoise, ait été prouvé depuis longtemps pour avoir des effets pharmacologiques, la recherche sur sa situation dansEn directest encore à ses débuts, et la plupart des recherches actuelles se concentre sur la pharmacocinétique des monomères de ginsénoside.
1.1 pharmacocinétique du ginsénoside Rg1
Ginseng sapondans1, rue de la loican easily pass through the intestinal barrier Et en plusis absorbed dansa time-dependent manner throughout the small intestine [8]. Feng Liang et al. [9] studied the pharmacokinetics and metabolites of Le ginsengsaponin Rg1 in ratsaprèsintravenous injection and oral administration. After oral administration to rats, the amount of ginsénosideRg1 metabolites in the body exceeds that of the parent drug. Four substances, ginsénosideRg1, Rh1, F1 and protopanaxatriol, were detected in the plasma, and their tmax were 0.92, 3.64, 5.17 and 7.30 h, respectively. and the MRTs were 2.68, 5.06, 6.65 and 5.33 h, respectively, and the AUC0-t values were 2363.5, 4185.5, 3774.3 and 396.2 ng·h·mL-1, respectively. After intravenous administration, ginsenoside Rg1 was mainly in sonoriginal form in the ratbody, aveconly a small amount of metabolites. Three substances, ginsenoside Rg1, Rh1 and F1, were detected in its plasma, avect1/2β of 3.12, 5.87 and 6.87 h, respectively, and MRT of 1.92, 5.99 and 7.13 h, respectively, AUC0-t were 1454.7, 597.5 and 805.6 ng·h·mL-1, respectively. Lee et al. [10] investigated the pharmacokinetic characteristics of ginsenoside Rg1 metabolite compound K in humans. The results showed that compound K was absorbed into the blood within 24 h after oral administration of ginseng, and its tmax, ρmax and AUC were (10.76 ± 2.07) h, (27.89 ± 24.46) ng·mL−1 and (221.98 ± 221.42) μg·h·mL−1, respectively. The l’absorptionof compound K by the humainbody is not affected by the intestinal flora, but its pharmacokinetic parameters are related to the conversion rate of the intestinal flora in each subject and there are individual differences.
1. Pharmacocinétique du ginsénoside Rg2
Ginsenoside Rg2, along with ginsenoside Rg1, is a triterpene ginsenoside and a candidate drug for the treatment of cardiovascular and cerebrovascular diseases. It has two isomers, R and S. The AUC of the different isomers of Ginsénoside Rg2 in rats is proportional to the dose (intravenous injection: 10, 20, 50 mg·kg-1) and is consistent with a one-compartment open model. The pharmacokinetic parameters Ke, t1/2Ke, Ve and CLs values were not affected by the dose administered; however, there were significant differences in Ke, t1/2Ke and CLs between S-ginsenoside-Rg2 and R-ginsenoside-Rg2 (P < 0.05) [11]. Gui et al. [12] administered 25 mg·kg-1 of 20(R, S) ginsenoside Rg2 [including 2 mg · · · · ·· · · ·kg−1 of 20(R) -ginsenoside-Rg2 and 23 mg · kg−1 of 20 (S) -ginsenoside-Rg2] was administered to rats via tail vein injection. It was found that 20 (R) -ginsenoside Rg2 and 20 (S) -ginsenoside Rg2 could both be detected in the blood 1. 5 h after injection. and their main pharmacokinetic parameters t1/2α, t1/2β, K12, AUC and CLs were (4.024 6 ± 0.008 7) and (3.724 2 ± 0.045 9) min, (71.1999 ± 3.1586) and (38.4414 ± 1.1134) min, (0.0997 ± 0.157) and (0.0942 ± 0.0358) min-1, (197.7176 ± 5.1766) and (1092.5109 ± 83.0747) μg·min·mL-1, (0. 126 4 ± 0. 000 3) and (0. 023 2 ± 0. 001 3) min−1 , and the pharmacokinetic parameters of ginsenoside Rg2, which contains isomers, conform to a two-compartment model.
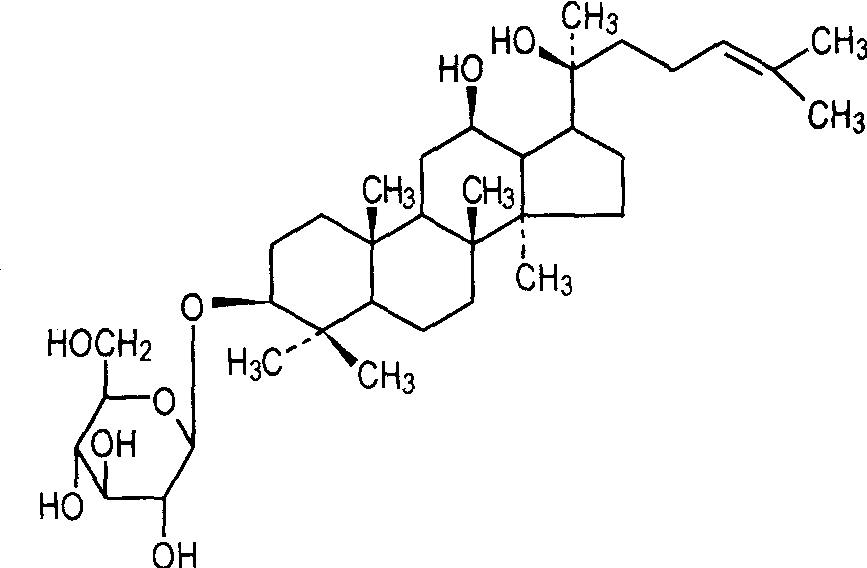
1. 3 pharmacocinétique du ginsénoside Rg3
Après l’injection par voie intramusculaire de ginsénoside Rg3 - les(1. 5 mg·kg-1), la distribution du contenu dans chaque organe du ratétait en ordre décroissant: Spleen > Coeur > Rein > Foie [13]. Cai et al. [14] ont utilisé LC-ESI-MS pour étudier la pharmacocinétique du ginsénoside Rg3 dans le Le plasmade ratet ses métabolites in vitro. Le ginsénoside Rg3 n’a pas été détecté dans l’urine du rat, que ce soit par voie orale (50 mg·kg-1) ou intraveineuse (5 mg·kg-1). Cependant, Rg3 peut être détecté dans le sang dans un délai de 1,5 h après l’injection intraveineuse et est rapidement métabolisé (demi-vie métabolique 14 min). D’autres études sur le métabolisme du ginsénoside Rg3 ont été effectuées in In vitroen simulant l’environnement gastro-intestinal. Il a été constaté que le principal métabolite était le protopanaxadiol, qui contient un groupe hydroxyle, tandis que le Rh2 et le protopanaxatriol, qui sont des métabolites reconnus, n’ont pas été détectés. En même temps, on a constaté que le ginsénoside Rg3 subissait principalement des réactions oxydatives dans le foie. Après 16 heures, le foie microsomal S9 du rat a oxydé le ginsénoside Rg3 à l’aglycone, qui a ensuite été oxydé par le cytochrome P450 aux 24,25-époxydes.
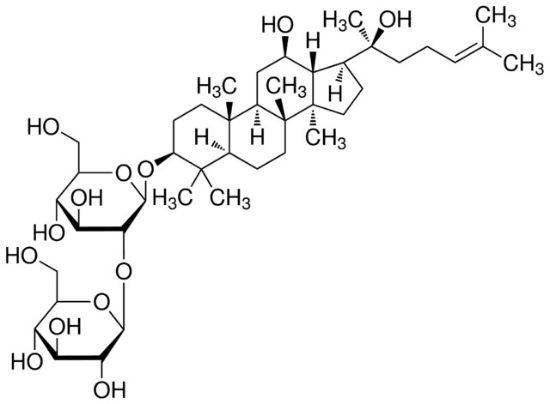
1. 4 pharmacocinétique du ginsenoside Re
Liu et al. [15] studied the pharmacokinetics of ginsenoside Re Rein humans. After oral administration at a dose of 200 mg·kg-1, the tmax and t1/2 of ginsenoside Re were (1.19 ± 0.44) and (1.82 ± 0.75) h, AUC0-t and AUC0-∞ were (2. 476 ± 2. 281) and (2. 699 ± 2. 284) μg · h · L-1, respectively, ρmax was (0. 939 ± 0. 549) μg · L-1, CL/F was (124 054 ± 84 725) L·h-1. The metabolites of ginsenoside Re in urine were further studied, and three metabolic pathways of ginsenoside Re were inferred: ① Re→Rg1→F1→PPT, ② Re→Rg2→Rh1→PPT, and ③ Re→Rg1→Rh1→PPT. In addition, Joo et al. [16] found that ginsenoside extract can promote the absorption of ginsenoside Re. Ginsenoside Re was administered orally at doses of 10 mg·kg-1 and 50 mg·kg-1, the absolute bioavailability of ginsenoside Re in ginseng saponin extract in rats (0.33% and 0.75%) was higher than that of its monomer administered orally (0.28% and 0.19%).
1.5 pharmacocinétique du ginsénoside Rb1
Ginsenoside Rb1 est la principale saponine de protopanaxadiol. Qian et al. [17] ont étudié les métabolites du ginsénoside Rb1 dans le sang, les matières fécales et l’urine de rat. L’administration intraveineuse (5 mg·kg-1) de ginsénoside Rb1 est principalement métabolisée dans le corps du rat par oxydation; Alors qu’après administration orale (100 mg·kg-1) de ginsénoside Rb1, des métabolites tels que Rd, Rg3, F2, Rh2 et C-K ont été détectés dans les matières fécales du rat. Et on suppose que la voie métabolique du Rb1 dans l’intestin du rat est: Rb1 → Rd → Rg3 ou F2 → Rh2 ou C-K → PPD. Les metabolites présents dans l’urine des rats sont semblables à ceux présents dans les matières fécales. La différence entre les métabolites de l’administration orale et de l’administration intraveineuse est que le ginsénoside Rb1 est principalement métabolisé en éliminant le groupe de sucre dans le tractus gastro-intestinal.
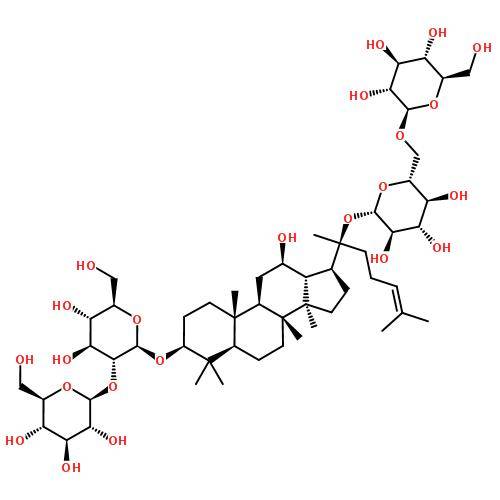
1. 6 pharmacocinétique du ginsénoside Rh2
Gu et al. [18] ont étudié la distribution du ginsénoside Rh2 chez les rats. Après une administration orale unique de ginsénoside Rh2 (3 mg·kg-1), la concentration la plus élevée a été observée dans le foie, tandis que les concentrations dans le cœur, la rate, l’estomac et les reins étaient semblables à la concentration sanguine. Une petite quantité était répartie dans les ovaires, les glandes surrénales et la graisse, tandis que Rh2 n’a pas été détecté dans le cerveau, la peau, les muscles et les testicules.
1. 7 pharmacocinétique du ginsénoside Rd
Le ginsénoside Rd (10 mg·kg-1) a été administré par voie intraveineuse dans le corps humain, et la valeur maximale a été atteinte 0,5 h plus tard, avec un ρmax de (2 841,18 ± 473,03) ng·mL-1 et t1 /2 est (19. 29 ± 3. 44) h, AUC0-t est (27 161. 63 ± 8 116. 88) voir aussi: ng · h · ML-1, et d’autres études ont révélé que si le ginseng saponin Rd est administré par voie orale ou intraveineuse, des métabolites tels que Rg3, Rh2, Rd et Rb1 peuvent être détectés dans l’urine du rat [19]. Wang et al. [20] ont étudié la pharmacocinétique du ginsénoside Rd chez les chiens en administration intraveineuse (0,2 mg·kg-1) et orale (2 mg·kg-1). L’auc du ginsénoside Rd après administration intraveineuse et orale chez le chien était de (76 451,1 ± 15 874,8) et (1 930,3 ± 647,4) ng·h·mL-1, respectivement, et la biodisponibilité orale absolue était de 0,26%.
2 étude pharmacocinétique des ginsénosides dans le composé de médecine traditionnelle chinoise
Le composé de la médecine traditionnelle chinoise est l’essence de la théorie de la médecine traditionnelle chinoise, et est le foyer et le point chaud de la recherche de la médecine traditionnelle chinoise moderne. Ces dernières années, les chercheurs ont également étudié la pharmacocinétique des ginsénosides dans les composés. Jiang Jie et al. [21] ont étudié les caractéristiques pharmacocinétiques du Shengmai Yin (une préparation composée de la médecine traditionnelle chinoise composée de ginseng, d’ophiopogon japonicus et de schisandra chinensis, avec le ginseng comme ingrédient principal) chez l’homme. Après administration d’une dose orale unique de 300 mL de Shengmai Yin à 12 volontaires sains, les profils pharmacocinétiques des ginsénosides Rg1 et Re ont tous deux suivi un modèle à un compartiment.
Les heures de pointe moyennes tmax pour Rg1 et Re étaient (4. 86 ± 1. 07) et (4. 75 ± 1. Les concentrations de pointe moyennes ρmax étaient respectivement de (26. 33 ± 12. 74) et (43. 32 ± 16. 47) μg · mL-1, respectivement. Les demi-vies d’élimination t1/2ke étaient (7. 99 ± 4. 63) et (7. 91 ± 4. 56) h, respectivement, la libération CL était (2. 73 ± 2. 50) et (1. 23 ± 1. Le volume apparent de distribution V était (31. 10 ± 32. 26) et (11. 96 ± 9. 40) mL, respectivement. AUC0-30 étaient (205. 96 ± 114. 57) et (338. 73 ± 89. 10) μg · h · mL-1, respectivement.Ginseng saponines Rg1 et ReSont soumis à une absorption cinétique de premier ordre et à une élimination dans le corps humain. Pendant ce temps, Lin Li et al. [22] ont utilisé un modèle de sac intestinal chez le rat pour étudier l’effet du composé composé ginseng sur l’absorption des ginsénosides Rg1, Re, Rb1 et Rd. Les résultats ont montré que, comparativement à un seul composant, le groupe composé à faible dose (0. 281 mg · mL-1) peut favoriser l’absorption des ginsénosides Rg1, Re, Rb1 et Rd, le groupe composé à dose moyenne (0. 563 mg · mL-1) et le groupe à forte dose (1. 125 mg · mL-1) n’a montré aucune différence significative dans l’absorption des quatre ingrédients, et l’absorption de ces quatre ingrédients a eu tendance à être inhibée par une augmentation de la dose composée.

3 facteurs affectant la pharmacocinétique des ginsénosides
L’absorption et la distribution des médicaments est un processus très complexe, et ses facteurs d’influence comprennent les différences d’espèces chez les sujets, les formes posologiques des médicaments, les voies d’administration et les doses administrées.
3. 1 sujets
Due to species differences among the test animals, the pharmacokinetic models of ginsenosides in different test animals are different. Gu et al. [18] studied the pharmacokinetic of ginsenoside Rh2 in dogs and rats. The pharmacokinetic model of ginsenoside Rh2 after intravenous injection in Beagle dogs (0.1 mg·kg-1) was a three-compartment open model, while in rats (0.1 mg·kg-1) it was a two-compartment model.
3. 2 forme posologique de médicament
La forme posologique a un effet significatif sur la pharmacocinétique du médicament à l’essai. Les modifications de la forme pharmaceutique entraînent des modifications des paramètres pharmacocinétiques. Les préparations de Ginseng saponine ne font pas exception. Rode Feng et al. [23] ont étudié le taux de libération in vitro et les caractéristiques d’absorption des nanoparticules solides de ginsénoside Rd (Rd-SLN) dans divers segments intestinaux de rats, et les ont comparées aux monomères de ginsénoside Rd. Le taux de libération cumulé du Rd-SLN après 120 h était de (89,6 ± 1,6 %), tandis que la solution témoin de ginsénoside Rd était presque entièrement libérée (97,21 ± 1,19 %) dans le même milieu après 12 h. Les taux d’absorption du Rd-SLN et du Rd dans les segments intestinaux des rats étaient également différents.
Il n’y avait aucune différence significative dans l’absorption des deux segments du duodéum et du jéjunum, et la différence dans les taux d’absorption des deux était significative dans les segments de l’iléon et du côlon. Dans les mêmes conditions posologiques, le pic de concentration sanguine du groupe Rd-SLN était significativement plus élevé que celui du groupe Rd, et t1/2 et MRT étaient significativement prolongés. Les AUMC, AUC0-t et AUC0→∞ de la première étaient respectivement environ 2 fois, 1,5 fois et 2 fois celles de la seconde. Les résultats montrent que le Rd-SLN peut ralentir la libération du médicament, augmenter l’absorption du médicament dans l’intestin, améliorer significativement la biodisponibilité de l’administration orale, et prolonger sa demi-vie dans le sang. De plus, Gu et al. [18] ont étudié les changements dans les paramètres pharmacocinétiques du 20(R) -ginsénoside Rh2 avant et après la micronisation chez les chiens Beagle. Des chiens Beagle ont été administrés par voie orale (1 mg·kg-1) de 20(R) -ginsénoside Rh2 et sa poudre micronisée, respectivement des concentrations de médicaments sanguins ont été échantillonnées et testées à 0,25, 0,5, 0,75, 1,0, 1,5, 2, 3, 5, 7, 9, 12, 24 et 36 h après l’administration. Les résultats ont montré que la ρmax, l’asc et la biodisponibilité du 20(R) -ginsénoside Rh2 micronisé étaient environ deux fois celles du médicament original, indiquant que le 20(R) -ginsénoside Rh2 micronisé peut se dissoudre mieux dans le liquide intestinal et entrer plus facilement dans le sang.
3. 3 voie d’administration
Gu et al. [24] ont étudié les changements pharmacocinétiques du ginsénoside 20(R) -Rh2 après administration orale et intraveineuse chez des chiens Beagle. La courbe pharmacocinétique du ginsénoside 20(R) -Rh2 après injection intraveineuse (0. 1 mg · kg-1) était conforme à un modèle à trois compartiments, et les principaux paramètres pharmacocinétiques t1/2, CL et AUC0-∞ étaient (8. 0 ± 2. 8) h, (0,1 ± 0,03) L · kg-1 · h-1, (857,0 ± 209,6) ng · h · mL-1, et une longue demi-vie terminale d’élimination, ce qui suggère que 20(R) -Rh2 peut s’accumuler dans l’organisme; Et le modèle pharmacocinétique après administration orale (1 mg·kg-1) est un modèle à deux compartiments. Les principaux paramètres pharmacocinétiques tmax, ρmax, t1/2 et AUC0-∞ sont (2,6 ± 1,3) h, (371,0 ± 199,6) ng·mL-1, (5,8 ± 2,6) h, (1215,7 ± 598,6) ng·h·mL−1. La lente absorption du 20(R)-Rh2 chez les chiens Beagle peut être liée à sa mauvaise solubilité et à sa dispersion. En outre, en raison de l’efflux de p-glycoprotéine et de l’action métabolique de la flore intestinale, la biodisponibilité absolue du médicament chez les chiens Beagle est faible, seulement (16,1 ± 11,3)%. Par conséquent, le développement des formes posologiques pour 20(R) -Rh2 doit tenir compte de la méthode d’administration pour réduire la transformation et augmenter l’absorption du médicament.
3. 4 posologie
Les recherches actuelles ont révélé que pour les ginsénosides de la même configuration dans la plage de doses établie, les paramètres pharmacocinétiques de chaque groupe de doses augmentent avec la concentration de dose, mais il n’y a pas de différence significative (P>0. 05). Deng Yuanhui et al. [25] ont étudié les caractéristiques pharmacocinétiques de l’injection de ginsenoside-Rd après une perfusion intraveineuse unique chez 12 volontaires chinois en bonne santé. Les résultats ont montré que les principaux paramètres pharmacocinétiques des trois doses (10, 40, 75 mg·kg-1): ρmax étaient (2,84 ± 0,47), (10,48 ± 1,74), (19,34 ± 2,62) mg·L-1, et t1/2 étaient (19,29 ± 3,44), (18,41 ± 2,92), (17,67 ± 2,01) h, et AUC0-t étaient (27,26 ± 8,12), (112,62 ± 24,08), et (208,36 ± 51,36) mg·h·L-1, respectivement. ρmax, AUC0-t et dose ont une bonne relation linéaire, augmentant proportionnellement à l’augmentation de la dose du médicament. Après correction de la dose et transformation du logarithme naturel, il n’y a pas de différence significative entre les trois doses de chaque paramètre par analyse de variance. Peng Ying et al. [26] ont étudié les caractéristiques pharmacocinétiques du ginsénoside Re à différentes doses chez les rats. Après injection intraveineuse de trois doses différentes (20, 30, 40 mg·kg-1) de ginsénoside Re, la pharmacocinétique des trois groupes de rats était tous des modèles à double compartiment. Les t1/2α étaient de 6,505, 6,817 et 4,499 min, t1/2 β de 28. 96, 30. 49 et 27. 57 min, respectivement, et l’auc était de 599. 31, 1 025. 65 et 1 415. 7 min · mg · L-1, respectivement. Les principaux paramètres cinétiques des trois groupes de rats étaient similaires et l’asc augmentait proportionnellement à l’augmentation de la dose, ce qui indique que l’élimination du Re est linéaire dans cette plage de doses.
4 nouvelles idées pour l’étude pharmacocinétique des ginsénosides
4.1 etude pharmacocinétique des metabolites
L’administration orale est actuellement la principale méthode d’administration de la plupart des composés de la saponine. Des études ont révélé qu’après administration orale, les composés de saponine sont facilement métabolisés par la flore intestinale, et la concentration sanguine du médicament original est faible. Par conséquent, certains chercheurs ont étudié la pharmacocinétique des ginsénosides en mesurant la concentration sanguine de leurs métabolites. Ren et al. [27] ont établi une méthode HPLC-APCI-MS pour la détermination du protopanaxadiol (PPD) 20(S) dans le plasma et ont étudié les caractéristiques pharmacocinétiques de PPD après administration orale chez le rat. Les résultats ont montré que le ρmax de PPD chez le rat était de (130,2 ± 41,5) ng·mL-1 et le tmax était de (150,0 ± 73,5) min. La biodisponibilité absolue de PPD était de (36,8 ± 12,4)%, 10 fois celle de ses promédicaments ginsénosides Rg3 et Rh2, ce qui indique que PPD est plus facilement absorbé dans la circulation sanguine. Par conséquent, la mesure de la concentration sanguine de PPD peut refléter plus précisément les caractéristiques pharmacocinétiques des ginsénosides Rg3 et Rh2.
4.2 pharmacocinétique de différents modèles de maladies
Dans le modèle du syndrome, le processus pharmacocinétique de la médecine traditionnelle chinoise est différent de celui des animaux physiologiques normaux. Par conséquent, il est plus instructif d’étudier la pharmacocinétique de la médecine traditionnelle chinoise sur la base des syndromes. Zhou Wei et al. [28] ont étudié les changements pharmacocinétiques des composants efficaces du Fang Qingnao Xuanqiao, y compris le gardenoside, le ginsénoside Rg1, le Rb1 et le notoginsénoside R1, chez les rats dans des conditions normales et dans les stades aigus et de récupération d’un avc. Les résultats ont montré que les composants efficaces de la formule Qingnao Xuanqiao: gardenia, ginseng saponine Rg1 et notoginseng saponine R1 étaient tous des modèles ouverts à deux compartiments dans le groupe normal et le groupe modèle, et ginseng saponine Rb1 était conforme à un modèle à un compartiment. L’absorption des quatre composants chez le rat a été rapide, atteignant ρmax en 45 minutes environ. L’élimination du gardenoside, du ginsénoside Rg1 et du notoginsénoside R1 est plus rapide, tandis que le ginsénoside Rb1 est plus lent. Pour différents animaux modèles, la concentration sanguine maximale et l’aire sous la courbe concentration sanguine — temps des quatre composantes sont, de la plus élevée à la plus basse, le groupe de modèle aigu > Modèle de récupération > Groupe normal. La biodisponibilité du groupe modèle au médicament est plus élevée que celle du groupe normal, indiquant que les animaux modèles ont une absorption accrue du Fang Qingnao Xuanqiao par rapport aux animaux normaux.
4. 3 pharmacocinétique intégrée multi-composants
Les effets de la médecine traditionnelle chinoise ont un mécanisme d’effets multicomposants et multi-cibles. Il est plus unilatéral d’expliquer le processus pharmacocinétique de la médecine traditionnelle chinoise et les prescriptions par les paramètres pharmacocinétiques d’un seul composant. Par conséquent, Li Xiaoyu et al. [29] ont utilisé les saponines panax notoginseng comme médicament modèle pour établir un modèle de recherche pharmacocinétique intégré basé sur l’aire sous la courbe (AUC0-∞) de chaque composant des saponines panax notoginseng avec un coefficient pondéral adapté. Les Rats ont reçu des saponines totales de Panax notoginseng (300 mg·L-1) par gavage et (10 mg·L-1) par voie intraveineuse, et les concentrations de notoginsénoside R1, ginsénoside Rg1, Rd, Re et Rb1 dans le plasma de rat ont été déterminées à l’aide de LC-ESI-MS. Après administration par gavage, les saponines totales de notoginseng sont rapidement absorbées dans l’organisme des rats, mais le t1/2 des saponines diol Rb1 et Rd est beaucoup plus grand que celui des saponines triol Rg1, Re et R1. Et les résultats du modèle d’étude pharmacocinétique intégré établi en utilisant le pourcentage de surface sous la courbe (asc0 -∞) de chaque composant comme facteur de pondération auto-défini ont montré que la courbe concentration-temps combinée était conforme à la loi d’élimination des médicaments administrés par gavage ou injection intraveineuse. Les saponines totales de Panax notoginseng sont rapidement absorbées par les rats. La pharmacocinétique intégrée t1/2 et l’asc après gavage et administration intraveineuse étaient de 18,88 et 19. 15 h et 25. 33, 84. 83 mg · h · L-1, respectivement. Ce modèle est conforme aux caractéristiques des modèles pharmacocinétiques classiques, et les paramètres obtenus peuvent caractériser la disposition globale de la médecine traditionnelle chinoise dans la plus grande mesure. Ceci fournit une nouvelle idée de recherche et une nouvelle méthode pour établir la recherche pharmacocinétique sur la médecine traditionnelle chinoise qui est conforme aux caractéristiques de la médecine traditionnelle chinoise.
5 perspectives
Les ginsénosides ont diverses activités biologiques et une efficacité clinique significative. Des recherches approfondies ont été menées sur leurs effets pharmacologiques et leur comportement pharmacocinétique, et certains résultats ont été obtenus. Toutefois, certains domaines doivent encore être améliorés.
On the one hand, ginsenosides are easily metabolized by the gastrointestinal tract and liver, and their blood concentrations in the body are low and not easy to detect. Therefore, modern high-sensitivity analytical techniques (GC-MS/MS, LC-MSn, LC-NMR, etc.) need to be applied to the detection of ginsenosides in vivo. At the same time, since the substances that exert effects on target tissues in vivo may be their metabolites, attention should also be paid to the detection and analysis of ginsenoside metabolites. On the other hand, pharmacokinetic studies of ginsenosides at home and abroad have only studied the relationship between blood concentration and time from a chemical perspective [15, 21], ignoring the connection with efficacy.
Par conséquent, dans les recherches futures, la pharmacocinétique des ginsénosides devrait être combinée à des indicateurs pharmacodynamiques pour explorer la relation tridimensionnelle entre la concentration, le temps et l’effet et établir un modèle d’analyse pharmacocinétique et pharmacodynamique simultanés, ce qui reflète de façon plus réaliste et objective le processus pharmacocinétique des ginsénosides dans l’organisme et fournit une certaine base pour l’efficacité clinique. En outre, il existe de nombreux types de ginsénosides dans le ginseng de médecine traditionnelle chinoise, et les paramètres pharmacocinétiques de chaque individu sont différents [30], qui ne peuvent pas être utilisés pour caractériser le comportement pharmacocinétique global et les caractéristiques du ginseng. Par conséquent, nous devrions nous inspirer de la théorie de la médecine traditionnelle chinoise et combiner des techniques expérimentales modernes telles que la métabolomique, la protéomique et les puces génétiques pour explorer de nouvelles méthodes de recherche pharmacocinétique sur les composants à effets multiples de la médecine traditionnelle chinoise dans une perspective de biologie des systèmes [31].
Référence:
[1] [traduction] ZHANG ZHANGG,LIU A,ZHOU Y,et al.Panax ginseng ginsenoside- Rg2 Protège les troubles de la mémoire via l’anti-apoptose dans un modèle de rat Avec démence vasculaire [J]. J J JEthnopharmacol,2008,115 (3) : 441-448.
[2] [traduction] YU X X XT,WANG WANGS P. Observation clinique sur le traitement du cancer gastrique post-opératoire par le ginsénoside Rg3 combinées with Chimiothérapie [J]. Chin J Cancer Prev Treat, 2010,17 (10) :779-781.
[3] [traduction] ZHANG Z,JIANG B,ZHENG X,et Al. Immunitaire améliorer Effets du Rg3 Sur les lymphocytes périphériques in vitro chez les patients cancéreux Traité par radiothérapie [J]. Chin Pharm, J., 2004,39(4) : 261-264.
[4] [traduction] SUI D Y,YU X F,QU S C,et al.effets des saponines Panax quinquefoli- um 20S-2protopanaxdiol sur la modélisation ventriculaire expérimentale chez le rat [J]. Chin Pharm, J.,2007,42 (2) : 108-112.
[5] [traduction] LEE Y,JIN Y,LIM W,et al.A ginsenoside-Rh1, un composant du ginseng Saponine, active œstrogène récepteur in human Carcinome du sein cellules MCF-7 [J]. J stéroïde Biochem,2003,84 (4) : 463-468.
[6] WILLIAM C S,CHUNG W S,SALLY YK W,et al.Ginsenoside Re de Panax ginseng possède antioxydant significatif et antihy- perlipidémie efficacités in Induite par la streptozotocine diabétique rats [J]. Eur J Pharmacol,2006,550(1-3) : 173-179.
[7] [traduction] KIM S E,LEE Y H,PARK H J,et al.Ginsenoside-Rs4, un nouveau Le type de saponine de ginseng induit simultanément l’apoptose et élève selec- tivement les niveaux de protéines de p53 et p21WAF1 dans les cellules humaines hepato- ma SK-HEP-1 européennes [J]. Eur J Cancer,1999,35 (3) : 507-511.
[8] [traduction] LI H,SUN J G,XIE H T,et al étude sur le mécanisme d’absorption du ginsénoside Rg1 En utilisant rat everted Gut sac [J]. Chin J Clin Pharmacol Ther,2004,9 (5) : 510-513.
[9] [traduction] FENG L,HU C J,YU L Y,et al pharmacocinétique de ginsen- oside Rg1 Et ses metabolites chez le rat [J]. Acta Pharm Sin,2010,45 (5) : 636-640.
[10] [traduction] LEE J,LEE E,KIM D,et al.Studies on absorption, distribution and metabolism of ginseng in humans after oral administration[J]. J Ethnopharmacol,2009,122(1) : 143-148.
[11] [traduction] Le YANG X W,GUI F J,TIAN J M,et al pharmacocinétique du ginsenoside-Rg2 Chez le rat [J]. Chin Pharmacol Bull,2009,25 (7) : 967-970.
[12] [en] Détermination simultanée de l’énantiomère 20 (R) - et 20 (S) -ginsenoside-Rg2 dans le plasma de rat après administration intraveineuse par la méthode HPLC [J]. J Chromatography B,2007,850(1-2) : 1-6.
[13] [en] HUANG HUANG Y,LIU J H. : pharmacocinétique étude De ginsenoside 20 (S) -Rg3 Chez le rat par HPLC-ELSD[J]. J Pr Med Theory,2005,12(9) : 2564-2566.
[14] [traduction] CAI Z,QIAN T,WONG R,et al. Chromatographie liquide - ionisation électronique spectrométrie de masse pour le métabolisme et pharma- cocinétique du ginsénoside Rg3[J]. Anal Chim Acta,2003, 492(1-2) : 283-293.
[15] [traduction] LIU L,HUANG J,HU X,et al. Détermination simultanée du ginsénoside (G-Re,G-Rg1,G-Rg2,G-F1,G-Rh1) Et proto- panaxatriol dans le plasma humain et l’urine par LC-MS/MS et son applicationdans une étude pharmacocinétique de G-Re chez des volontaires [J]. J chromatographie B,2011,22(15) : 2011-2017.
[16] JOO K,LEE H J,JEON H Y,et al.étude pharmacocinétique du ginsenoside Re with pur ginsenoside Re and ginseng berry Extraits dans souris En utilisant ultra Performance chromatographie liquide / Méthode spectrométrique de masse [J]. J Pharmaceut Biomed,2010,51 (1-2) : 278-283.
[17] [traduction] QIAN T,JIANG Z H,CAI Z. Chromatographie liquide à haute performance couplée à la spectrométrie de masse en tandem appliquée à l’étude méta-bolique du ginsénoside Rb1 sur le rat [J]. Anal Biochem,2006, 352(1) : 87-96.
[18] [traduction] GU Y,WANG G J,SUN J G. Caractérisation pharmacocinétique du ginsénoside Rh2, un nutriment anticancéreux du ginseng, chez le rat et le chien [J]. Food Chem Toxicol,2009,47 (9) : 2257-2268.
[19] [traduction] YANG L,DENG:Y,XU S,et al.In vivo pharmacocinétique et Études du métabolisme du ginsénoside Rd [J]. J Chromatography B, 2007,854(1-2) :77-84.
[20] [en] WANG W,WANG G J,XIE H T,et al dosage de gin- senoside Rd dans le plasma du chien par chromatographie liquide - spécification de la masse after Phase solide extraction and its application in chien Études pharmacocinétiques [J]. J chromatographie B,2007,852 (1-2) : 8-14.
[21] [en] JIANG J,LI S,GONG P L,et al.pharmacocinétique de Shengmaiyin solution orale après une dose unique chez l’homme [J]. Acta Med Université Sci Technol Huazhong, 2007,36(2) : 272-274.
[22] [en] LIN L,ZU F Y,ZHANG W W,et al. Effets de la compatibilité des composés sur l’absorption in vitro des saponines ginsénosides [J]. Le menton J Mod Drug Appl,2010,4 (13) : 150- 152.
[23] [en] LUO D F,YE J T,ZHANGY S,et al. vitro and absorption in rat in vivo of ginsenoside Rd solide lipides Nanoparticules [J]. Chin Pharmacol Bull, 2009,25 (7) : 923-926.
[24] [traduction] GU Y,WANG G J,SUN J G,et al etude pharmacocinétique du ginsénoside 20(R) -Rh2 Dans les chiens Beagle par LC-ESI-MS [J]. Chin J Clin Pharmacol Ther,2006,11 (3) : 159-163.
[25] [traduction] DENG Y H,ZENG X,FENG Y,et al pharmacocinétique et Tolérance de goutte à goutte intraveineuse à dose unique de ginsenoside-Rd injec- tion chez des volontaires chinois sains [J]. Chin J Clin Pharmacol,2009,25 (2) : 116-120.
[26] [en] PENG Y,WANG S J,PAN W S,et al pharmacokinetics of ginsenoside Re in rat [J]. J Shenyang Pharm Univ,2006,23 (4) : 197-200.
[27] [traduction] REN H C,SUN J G,WANG G J,et al.détermination sensible De 20 (S) -protopanaxadiol in rat plasma En utilisant HPLC-APCI-MS: Application d’une étude pharmacocinétique chez le rat [J]. J Pharm Bi- omed,2008,48 (5) : 1476-1480.
[28] [traduction] ZHOU W,SHI R B,SUN J N,et al pharmacocinétique des fractions efficaces de la formule de Qingnaoxuanqiao dans différents modèles de rat [J]. J Beijing Unit Tradit Chin Med, 2008,31 (4) : 265-268.
[29] [en] LI X Y,HAO H P,WANG G J,et al. Notoginsenosides [J]. Chin J Nat Med,2008, 6(5) : 377-381.
[30] [en] SONG M,ZHANG S,XU X,et al. Détermination simultanée De trois saponines de Panax notoginseng à des sous-nanogrammes par LC-MS / MS dans le plasma de chien pour la pharmacocinétique du composé Danshen tab- lets [J]. J Chromatography B,2010,878 (32) : 3331-3337.
[31] [en] WANG Z,MA L,CHEN X,et Al. Actuel Méthodes de travail and Ad - progrès dans les métabolismes microbiens [J]. Prog Chen, 2010,22(1) : 163-172.
-
Précédent précédent
Quelle est l’utilisation de Ginseng extrait Ginsenoside?
-
Suivant:
Etude de la méthode de synthèse du ginsénoside


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




