Etude sur la technologie de préparation d’extrait actif de Centella Asiatica
Centella asiatica (L.......) Urbain. is the dried whole herb of the plant Centella asiatica (L.) Urban. in the family Apiaceae. Its active ingredients are mainly triterpene saponins and their derivatives [1], such as asiaticoside, madecassoside and madecassic acid, of which asiaticoside has the highest content. Asiaticoside has various pharmacological effects, such as promoting wound healing, treating scars, inhibiting breast hyperplasia, anti-tumor, anti-depression, and treating Alzheimer' S maladie [2]. Les activités pharmacologiques de l’acide asiatique et du madecassoside sont similaires à celles de l’asiaticoside, tandis que le madecassoside a également pour effet de protéger les systèmes cardiovasculaire et cérébrovasculaire [3]. Afin de mieux appliquer les principes actifs de Centella asiatica dans la pratique clinique, des chercheurs nationaux et étrangers ont préparé diverses préparations sûres, stables et efficaces pour ses diverses activités pharmacologiques. Cet article résume la recherche de préparation, résume les technologies clés dans le processus de préparation et les caractéristiques des préparations obtenues, et analyse et résume l’efficacité correspondante.

1 Injection
L’extrait titré de Centella asiatica (TECA) injection peut être utilisé pour traiter la sclérose systémique. Cependant, dans une solution aqueuse commune, la solubilité de TECA est faible, et parce que le composant principal est une saponine triterpène, l’injection directe peut provoquer une hémolyse et une forte sensation douloureuse. Pour résoudre les problèmes ci-dessus, Chong-Kook et al. ont préparé une nouvelle injection TECA en ajoutant Tween-20 et Tween-85 à la solution pour améliorer la solubilité de l’asiaticoside et réduire ses effets secondaires toxiques [4]. Des études ont montré que plus la proportion de Tween-20 dans le tensioactif est élevée, plus la solubilité du TECA, jusqu’à 18 mg/ml, est grande. Lorsque le rapport entre Tween-20 et Tween-85 est de 6:4, la taille des particules de la phase dispersée dans l’émulsion préparée est la plus petite. Par rapport à l’injection ordinaire de propylène glycol TECA, après que l’injection a été administrée à des souris par injection intramusculaire, le nombre de torsions des souris a été significativement réduit, indiquant que l’injection a produit moins de douleur, ce qui est bénéfique pour augmenter l’observance du patient et est plus approprié pour une application clinique.
2 préparations orales
2.1 tablettes
2.1.1 comprimés à libération prolongée
Afin de résoudre les problèmes de l’existantCentella asiatica tablettesComme la grande dose par dose et le grand nombre de doses quotidiennes, Gan Kelin et d’autres ont augmenté la dose de trois fois en se basant sur des comprimés de Centella asiatica disponibles dans le commerce, et ont ajouté de l’hydroxypropylméthylcellulose (HPMC) comme substance à libération soutenue pour préparer les comprimés de glycoside total à libération soutenue de Centella asiatica [5]. En utilisant 20% de K100M de HPMC comme support à libération soutenue et en ajoutant une solution d’éthanol éthylique cellulose à 10% comme agent d’adhésion, des comprimés à libération soutenue ont été préparés, chacun pesant environ 1,5 g et contenant 18 mg de glycoside total de Centella asiatica. Les résultats de l’étude sur la libération in vitro ont montré que les comprimés ordinaires de saponines totales de Centella asiatica se sont essentiellement complètement désintégrés et ont libéré tout le médicament après environ 1 h, tandis que les comprimés de saponines totales de Centella asiatica à libération soutenue pouvaient effectivement libérer le médicament pendant 12 h, atteignant ainsi l’objectif d’une libération lente et contrôlée. Zheng Xiaochun et al. ont utilisé K15M hydroxypropylméthylcellulose comme support à libération soutenue, cellulose microcristalline comme régulateur de libération, et une solution d’éthanol povidone comme liant pour produire également un comprimé à libération soutenue de glycoside total de Centella asiatica qui peut effectivement libérer le médicament pendant jusqu’à 12 heures [6].
2.1.2 comprimés de désintégration orale
Afin de résoudre le problème des difficultés de déglutition chez certains patients, Song Xuyin et al. ont préparé des comprimés de désinfection orale d’asiaticoside [7]. En ajoutant de la cellulose microcristalline, de la carboxyméthylcellulose de sodium réticulée et du mannitol, et en utilisant une conception de test orthogonale pour optimiser la prescription, les comprimés de désintégration orale finale peuvent complètement se désintégrer en 1 minute. En même temps, le processus de mise en table est simple et facile à réaliser, facilitant la production industrielle.

2.1.3 comprimés flottants gastriques
Des études ont montré que l’asiaticoside a un bon effet thérapeutique sur les ulcères gastriques [8]. Sur cette base, Shi et al. ont préparé des comprimés flottants gastriques asiaticoside qui peuvent rester dans l’estomac et prolonger le délai de livraison du médicament [9]. En utilisant l’amidon de carboxyméthyle de sodium comme aide au blanchiment, le polyéthylène glycol 20 000 comme formage interstitiel et une méthode de conception de mélange pour optimiser la prescription, on a finalement obtenu des comprimés flottants de glucoside total de Centella asiatica pouvant floter efficacement jusqu’à 12 h. La mise en comprimés a un impact significatif sur l’apparence, la performance flottante et la performance de libération de médicament de la tablette. Augmenter la pression peut prolonger le temps de flottement, ralentir le taux de libération de médicament et réduire la quantité de médicament libérée.
2.2 Suspension
Centella asiatica total glucoside has poor solubility in water, so it is often prepared as a suspension for oral administration. Literature shows that when used as a suspending agent with hydroxypropyl methylcellulose, it is administered to mice by gavage (30 mg/kg), and the degree of anxiety in mice is reduced in the elevated plus-maze experiment, the black box experiment, and the open field experiment. The anxiolytic effect of the drug becomes more pronounced with increasing dose [10]. At the same time, the preparation had a certain effect on the body weight of mice and the adrenaline content in the serum, but when the same dose of asiaticoside (10 mg/kg) or madecassoside (16 mg/kg) was used alone, there was no significant effect, indicating that the two may have a synergistic effect when used together, but it is also possible that the single use of a component is not sufficient in terms of dosage to produce an effect.

3 préparations topiques
3,1 Gels
Xia et al. ont utilisé le taux d’absorption transdermique et la pénétration cumulative comme indicateurs pour améliorer l’absorption transdermique de l’asiaticoside en ajoutant de la lauricine et du géraniol à la prescription à différentes concentrations [11]. Les résultats ont montré que la perméation cumulative et le taux d’absorption transdermique pouvaient être augmentés de 3 à 12 fois après l’ajout d’un amplificateur de perméation, et l’effet était meilleur lorsque 1% de laurazone était utilisé seul. Wang Shuping et al. ont également employé le borneol, le menthol, etc. comme améliorateurs de perméation pour améliorer l’absorption transdermique de asiaticoside [12].
Les tensioactifs peuvent non seulement être utilisés pour augmenter la solubilité des substances peu solubles, mais également favoriser l’absorption transdermique des substances peu solubles. Soon-Sun et al. ont étudié l’effet solubilisant d’une série d’agents tensioactifs non ioniques et anioniques sur TECA, et ont choisi l’ester caprylique de polyglycérol caprique et le désoxycholate de sodium comme solubilisants pour préparer les gels TECA [13]. Une grande quantité de cristaux est apparue dans le gel préparé avec du caprylate et du caprate de polyoxyéthylène de PEG après 24 heures, alors qu’aucun cristaux évident n’est apparu dans le gel préparé avec du désoxycholate de sodium après un mois, ce qui indique que l’ajout de désoxycholate de sodium A un effet plus stable sur l’amélioration de la solubilité de l’asiaticoside. Des expériences sur des animaux ont montré que par rapport à l’agent gel blanc, le taux de guérison des plaies de souris est significativement plus rapide et l’efficacité est remarquable après l’utilisation de l’agent gel désoxycholate TECA.
3.2 Emulsions
Laugel et al. ont préparé une émulsion composite de type eau-dans-huile avec du asiaticoside, du madecassoside et de l’acide asiatique (dans un rapport massique de 4:3:3) comme médicament principal [14]. Des essais sur traceurs et rhéologiques ont montré que l’émulsion composite préparée était stable et que la présence du médicament n’avait presque aucun effet sur la stabilité de l’émulsion par rapport à l’émulsion à blanc. Des expériences transdermiques In vitro ont montré que par rapport aux émulsions huiles dans l’eau ordinaires, les émulsions complexes avaient un taux de rétention dans l’épiderme et le derme qui était respectivement trois fois et deux fois plus élevé. Lorsque le diméthicone est ajouté à la phase huileuse externe, il peut également améliorer le taux d’absorption du médicament et produire un certain effet de libération soutenue [15]. Dans le même temps, diméthicone avec un poids moléculaire inférieur peut améliorer la solubilité du médicament dans le stratum corneum, rendant les médicaments triterpénoïdes plus susceptibles de pénétrer le stratum corneum et d’atteindre l’épiderme, et augmentant la quantité de médicament retenue dans le stratum corneum. La diméthicone avec un poids moléculaire plus élevé, cependant, aura l’effet inverse.

3.3 agent de revêtement
Les préparations topiques existantes d’asiaticoside sont principalement des préparations crème, qui ont une faible stabilité, une sensation grasse et sont sujettes à la coloration des vêtements. Afin de surmonter ces problèmes, Jiang Ping et al. ont utilisé une solution aqueuse de chitosan comme base, enfournée de camphre, de bornéol et de menthol, pour préparer un agent de revêtement asiaticoside facile à utiliser [16]. La teneur en asiaticoside et en madecassoside dans l’agent de pellicule était de 95% à 105% de la quantité marquée, ce qui indique que l’agent de pellicule préparé avait une teneur stable en médicament.
3.4 agent de Membrane
Xin Tian et al. ont utilisé du chitosan désacétylé comme matériau de formation de pellicule pour préparer un agent de pellicule à 6% d’asiaticoside. Le médicament était distribué uniformément dans l’agent filmé, et la performance de libération du médicament in vitro était bonne, avec 90% du médicament libéré après 14 h [17]. Le film préparé a été utilisé pour traiter les traumatismes utérins chez les lapins. Par rapport au groupe témoin, le traumatisme utérin a guéri de manière significative après le traitement avec le film de Centella asiatica, et il n’y a pas eu d’adhésion à la paroi intestinale.
Panprung et al. used sodium alginate, a natural polysaccharide, as a raw material and prepared the centella asiatica film-forming agent by forming calcium alginate salt through complexation with Ca2+ as the matrix of the film-forming agent based on the traditional preparation method [18]. In this study, a high concentration of CaCl2 solution was used to carry out a secondary cross-linking reaction on the initially prepared film-forming agent to improve the stability of the film-forming agent. Mechanical property studies showed that the addition of asiaticoside could make the membrane withstand greater tensile stress, but it would make the membrane less flexible. In PBS containing 10% methanol, the membrane could effectively release the drug for up to 24 hours, and the cumulative release rate of asiaticoside could reach 92%. At the same time, toxicological studies showed that the membrane had no significant toxicity to fibroblasts in human dermis.
Contrairement au procédé de préparation ci-dessus, le procédé de préparation directe d’un agent de pellicule à partir de l’alginate de sodium, de séchage, puis d’immersion dans une solution CaCl2 contenant de l’éthanol de différentes concentrations pour la réticulation pour obtenir un agent de pellicule asiaticoside est plus simple. Par rapport à une solution pure de CaCl2, l’addition de l’éthanol solvant latent peut ralentir la vitesse de réticulation, ce qui donne un film d’aspect plus transparent et d’épaisseur réduite. Observée au microscope électronique à balayage, la surface du film contenant de l’éthanol est plus uniforme, plus lisse et présente moins de plis. Des études ont également révélé que lorsque la concentration d’éthanol est supérieure à 30%, elle inhiber la réticulation et n’est pas propice à la formation d’un agent pelliculaire structurellement stable [19].
3.5 Babu agent
Afin d’augmenter la charge de médicament des préparations topique et d’améliorer le taux de libération de médicament, Hu Xiao a préparé un composé Centella asiatica saponin hydrogel crème (balme) avec Centella asiatica saponine totale et acétonide de triamcinolone comme médicaments principaux. Une expérience à facteur unique A été utilisée pour optimiser la prescription, et l’adhérence initiale, le pouvoir de rétention et le suivi cutané du gel crème ont été contrôlés au niveau optimal [20]. Afin de favoriser l’absorption de l’asiaticoside, un amplificateur de perméation a été ajouté pour les expériences In vitro, et il a finalement été déterminé que 1% de nitrocellulose et 1% de propylène glycol ont été utilisés comme amplificateurs de perméation pour le composé crème gel asiaticoside. Le gel crème préparé libère les médicaments rapidement et de façon stable, et la quantité de libération cumulative est plus élevée que celle du médicament témoin commercialisé.
4 nouvelles technologies de préparation et nouvelles formes posologiques
The poor solubility and low bioavailability of the main active ingredient of Centella asiatica [21, 22] are not conducive to clinical application. To solve these problems, a series of new preparations and technologies have been widely used in the formulation research of Centella asiatica and its active ingredients.
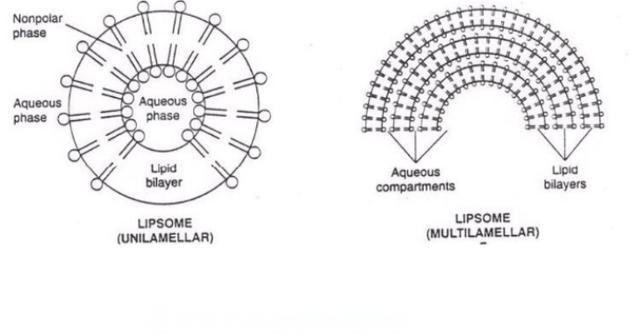
4.1 Liposomes
Les Liposomes sont des porteurs en forme de supermicrosphères composés de phospholipides et de cholestérol avec une structure de bilayer semblable à celle des membranes biologiques. Ils peuvent améliorer l’efficacité, réduire les effets secondaires toxiques et prolonger la durée d’action du médicament [23]. Liu Minmin et al. ont utilisé l’homogénéisation à haute pression par injection d’éthanol pour préparer des liposomes flexibles encapsulés au glycoside de Centella asiatica avec un taux d’encapsulation pouvant atteindre 91% [24]. Les nanoliposomes obtenus ont été utilisés comme agent gélifiant à base de méthylcellulose, ce qui a considérablement augmenté la perméabilité et la rétention intradermique de l’asiaticoside dans une expérience transdermique in vitro. Wang Huijuan et al. ont modifié le liposome d’hydroxyle asiaticoside avec le polyéthylène glycol pour obtenir un liposome d’asiaticoside à longue circulation, et ont optimisé la prescription par l’analyse de surface de réponse. Cependant, le taux d’encapsulation des liposomes finaux était faible, seulement 46% [25].
Donatella Paolino et al. ont utilisé la méthode de dispersion-extrusion de film pour préparer les liposomes asiaticoside [26]. Lorsque la lécithine et la dipalmitoylphosphatidylcholine étaient utilisées comme matrice, il n’y avait aucun effet significatif sur le taux d’encapsulation des liposomes asiaticoside. Des études In vitro ont montré que la teneur en cholestérol de la matrice a un effet positif significatif sur la pénétration de l’asiaticoside dans les fibroblastes épidermiques humains, et que lorsque la teneur est supérieure à 20%, elle produit un certain degré de cytotoxicité. Des études In vivo ont montré que par rapport à la solution aqueuse asiaticoside, l’utilisation de liposomes asiaticoside peut effectivement favoriser l’absorption transdermique de asiaticoside et augmenter significativement la synthèse de collagène.
L’auteur a utilisé la méthode de dispersion du film pour préparerCentella asiatica glycoside liposomes and studied their modification (to be published). By modifying the liposomes with D-mannose and stearylamine, Centella asiatica glycoside cationic liposomes were prepared, with an encapsulation rate of up to 72.98%. The liposomes obtained showed a significant sustained-release effect in both in vitro and in vivo experiments; in particular, in vivo, the elimination half-life increased from 14.52 min to 159.58 min, and sustained drug release was achieved for more than 10 h. In a study of cholesterol levels, it was found that appropriately increasing the cholesterol content can significantly increase the encapsulation rate. It is speculated that cholesterol binds to asiaticoside [27], which improves the stability of asiaticoside in the phospholipid membrane. However, too high a cholesterol content can destroy the microscopic structure of the liposome [28], resulting in lumps in the final liposome and a decrease in the encapsulation rate.
4.2 vésicules
La saponine de Centella asiatica est une saponine triterpène avec un poids moléculaire élevé, un point de fusion élevé et une mauvaise solubilité dans l’eau et la solubilité dans les graisses. Il n’est pas facile de traverser la barrière cutanée pour un usage externe et a une faible absorption [29]. Zhang Yangyang et al. ont utilisé un tensioactif non ionique et du cholestérol comme matériau encapsulant pour préparer des vésicules en encapsulant la saponine de centella asiatica, et le taux de piégeage des vésicules obtenues était de 89,56% [30]. Les résultats d’ une étude transdermique in vitro ont montré qu’ après 24 heures, la pénétration transdermique cumulative de la solution de Centella asiatica n’ était que de 3,73 μg/ml, tandis que la pénétration transdermique cumulative des vésicules de Centella asiatica était de 25,15 μg/ml, avec un pourcentage de pénétration transdermique cumulative de 88,95 %.

4.3 nanoémulsions
Il a été rapporté que l’asiaticoside lui-même a un certain degré de ciblage, et peut être utilisé pour modifier les vecteurs d’administration de médicaments particulaires. Sanghoon et al. ont utilisé la palmitoyl-lysine-threonine-serine-threonine-lysine (palmitoyl-KTTKS) comme médicament principal, l’asiaticoside comme molécule de ciblage et le rouge du nil comme marqueeur pour préparer les nanolaits de palmitoyl-KTKS [31]. Les nanolaits de Palmitoyl-KTTKS ont été enrobés sur de la peau de porc isolée pour des expériences transdermiques in vitro. Après avoir été laissée dans l’obscurité pendant 30 h, la peau a été découpée et la distribution des nanolaits dans la peau a été observée à l’aide d’un microscope à deux photons et d’un microscope confocal à balayage laser. Les résultats ont montré que la profondeur transdermique des nanolaits modifiés asiaticoside était significativement plus élevée que celle des nanolaits non modifiés. Cette étude a confirmé que les nanolaits modifiés à l’asiaticoside peuvent améliorer leur affinité avec les cellules du stratum corneum et sont plus facilement absorbés par voie transdermique.
4.4 Encapsulation
Les cyclodextrines et leurs dérivés ont une structure de cavité, et peuvent encapsuler des molécules médicamenuses par les forces de van der Waals, améliorant ainsi les propriétés physico-chimiques du médicament. Zhang Bo et al. ont utilisé l’hydroxypropyl-β-cyclodextrine (HP-β-CD) pour préparer un complexe d’inclusion avec de l’acide asiatique, augmentant sa solubilité à 2,1 mg/ml [32]. La formation du complexe d’inclusion a été confirmée par la spectroscopie infrarouge, la diffraction des rayons x et la calorimétrie à balayage différentiel. La microscopie électronique à balayage a montré que la forme des cristaux obtenus a changé après la réaction.
Jate et al. ont constaté que lorsque du 2-hydroxypropyl-bêta-cyclodextrine (2-HP-β-CD) a été utilisé pour préparer un complexe asiaticoside, la solubilité de l’asiaticoside dans l’eau distillée augmentait de 0,7 mmol/L à 15,3 mmol/L à une concentration de 2-HP-β-CD de 30 mmol/L, et la solubilité dans le solvant mélangé (solution d’acide acétique à 80% : n-n-diméthylacétamide = 90:10) augmentait de 48,7 mmol/L à 60 mmol/L. L’effet de solubilisation était linéairement et positivement corrélé avec la concentration de 2-HP-β-CD, et on a supposé que le rapport moléculaire hôte-hôte dans le complexe d’inclusion était de 1:1 [33]. La libération d’asiaticoside a été améliorée en préparant le complexe d’inclusion sous forme de film avec de l’acétate de cellulose comme matériau de membrane. Trempage dans une solution de PBS contenant 10% de méthanol pendant 24 heures, la libération cumulative des complexes avec un rapport moléculaire hôte/hôte de 2:1, 1:1 et 1:2 a atteint respectivement 98%, 70% et 38%, tandis que la libération cumulative du film asiaticoside était presque 0.
4.5 pansements au Le Chitosan
Chitosan is a polymer material with good biocompatibility and the effect of promoting wound healing, and is often used as an excipient for traumatic drugs. Kotchamon et al. improved the preparation method of chitosan dressings by dissolving chitosan in a lactic acid solution of aluminum stearate and supplementing with dehydrothymine treatment to improve the stability and microstructure of the dressing [34, 35]. The in vitro release of Centella asiatica extract made into a chitosan dressing formulation showed that the release of the Centella asiatica dressing conformed to a first-order kinetic equation, with a significant sustained-release effect and an effective drug release of up to 7 days. Cytotoxicity experiments showed that the prepared dressing was safe and non-toxic to human cells in vitro, and that the dressing could promote the division and reproduction of human fibroblasts and glial cells.

In summary, Centella asiatica has a wide range of pharmacological activities, and pharmaceutical research is of great significance for prolonging the duration of action of drugs, improving their efficacy, studying their mechanism of action, and improving their targeted distribution. Improving the absorption of the active ingredients in Centella asiatica through pharmaceutical means can enhance the therapeutic effect and make full use of Centella asiatica and its active ingredients.
Références:
[1] Liu Yu, Zhao Yuqing. Recherche sur la composition chimique de Centella asiatica [J]. Chinese Modern Traditional Chinese Medicine, 2008, 10(3):7-9.
[2] Liu Zhifeng, Zhao Huinan, Nie Shaoliang et al. Progrès de la recherche sur les effets pharmacologiques et les mécanismes de l’asiaticoside [J]. Guangdong Medicine, 2009, 30(4):649-651.
[3] Liu Huaqing, Xu Qingyun, Wang Tianlin. Progrès de la recherche sur l’acide asiatique [J]. Chinese Wild Plant Resources, 2014, 33(4):30-33.
[4] Kim CK, Hwang YY, Chang JY, et al. Développement d’une nouvelle forme posologique pour l’injection intramusculaire d’extrait titré de Centella asiatica dans un système miscellaire mixte [J]. Int J Pharm, 2001, 220(1):141-147.
[5] Gan Kelin, He Wen. Caractéristiques de préparation et de libération in vitro des comprimés de glycoside total à libération soutenue de Centella asiatica [J]. Chinese Pharmacist, 2009, 12(6):714-716.
[6] Zheng Xiaochun, Wang Shenghao. Recherche sur la conception de la prescription de comprimés à libération prolongée de glycoside total de Centella asiatica [J]. Chinese Journal of New Drugs, 2008, 17(11):958-961.
[7] Song Xuyang, Lu Jihong, Li Yingguang, et al. Développement et contrôle de qualité de comprimés de désinfection orale d’asiaticoside [J]. Chinese Herbal Medicine, 2011, 34(10):903-905.
[8] Shi Zhiqi, Du Jianping, Du Tieliang, et al. Etude de l’effet anti-ulcère gastrique des saponines totales de Centella asiatica chez les rats induites par l’acide acétique [J]. Chinese Journal of Experimental Traditional Medicine, 2010, 16(12):122- 124.
[9] Shi Zhiqi, Wang Luolin, Du Jianping, et al. Optimisation du processus de prescription des comprimés d’estomac flottants de glycoside total de Centella asiatica [J]. Chinese Journal of Experimental formules, 2013, 19(12):15-16.
[10] Wanasuntronwong A, Tantisira MH, Tantisira B, et al. Effets Anx- iolytiques de l’extrait normalisé de Centella asiatica (ECa 233) après un stress chronique d’immobilisation chez la souris [J]. J Ethnopharmacol, 2012, 143(143):579-585.
[11] Xia Linhong, Qiu Qida. Effets de la lauricine et du menthol sur l’absorption transdermique in vitro d’un gel composé asiaticoside [J]. Chinese Journal of Hospital Pharmacy, 2010, 30(18):1538-1541.
[12] Wang Shuping, Zhang Li, Zhang Li, et al. Effets des activateurs de perméation sur la pénétration transdermique in vitro de l’asiaticoside [J]. Chinese Journal of Emergency Resuscitation and Disaster Medicine, 2014, 9(9): 816-819.
[13] Hong SS, Kim JH, Li H et al. Formulation avancée et activité pharmacologique de l’hydrogel de l’extrait titré de C. Asiatica[J]. Arch Pharm Res, 2005, 28(4):502-508.
[14] Laugel C, Baillet A, Ferrier D, et al. Incorporation de dérivés triter- péniques dans une émulsion multiple O/W/O: études André - lease [J]. IntJ Cosmetic Sci, 1998, 20(3):183-191.
[15] Laugel C, Rafidison P, Potard G et al. Libération modulée de composés triterpéniques à partir d’une émulsion multiple a /W/O formulée avec des diméthicones: approches spectrophotométriques infrarouges et calorimétriques différentielles [J]. J Control Release, 2000, 63(1):7-17.
[16] Jiang Ping, Gao Hui, Wang Xiaomei, et al. Détermination de l’asiaticoside et du madecassoside dans un film de revêtement asiaticoside par HPLC [J]. Pharmaceutical Service and Research, 2013, 13(4):282-284.
[17] Xin Tian, Zhang Jiali, Xia Wenshui. Etude de préparation et d’efficacité de l’agent filmique asiaticoside-chitosan [J]. Shaanxi Traditional Chinese Medicine, 2013, 34(7):901-902.
[18] Sikareepaisan P, Rulctanonchai U, Supaphol P. préparation et caractérisation de films alginate chargés en asiaticoside-et leur potentiel d’utilisation en tant que pansements efficaces pour les plaies [J]. Carbohyd Polym, 2011, 83(4):1457-1469.
[19] Li J, He J, Huang Y et al. Améliorer les propriétés superficielles et mécaniques des films d’alginate en utilisant l’éthanol comme co-solvant pendant la gélation externe [J]. Carbohyd Polym, 2015, 123: 208-216.
[20] Hu X. recherche sur la pommade de gel composé asiaticoside [D]. Université de médecine traditionnelle chinoise du Hubei, 2013.
[21] Zhang Y, Chen L, Zhang L, et al. Détermination de la solubilité à l’équilibre et du coefficient de partage huile-eau de l’asiaticoside [J]. Journal of PLA Pharmacy, 2013, 29(3):189-191.
[22] Liu Shuyun, Fan Mingsong, Li Zhixiong, et al. Métabolisme du madecassoside chez le rat [J]. Chinese Journal of Modern Traditional Chinese Medicine, 2012, 14(6): 9-15.
[23] Dua JS, Rana AC, Bhandari AK. Liposome: méthodes de préparation et applications [J]. Int J Pharm Stud Res, 2012, 3(2): 14-20.
[24] Liu Minmin, Li Li, Ma Xiaolai. Développement et évaluation in vitro du gel nanoliposomique flexible au glycoside de Centella asiatica [J]. Chinese Journal of Pharmaceutical Industry, 2013, 44(11): 1120-1122.
[25] Wang HJ, Liu M, Du S. optimisation des lipo- somes madecassoside à l’aide de la méthodologie de surface de réponse et évaluation de sa stabilité [J]. IntJ Pharm, 2014, 473(1):280-285.
[26] Paolino D, Cosco D, Cilurzo F, et al. Amélioration de la biosynthèse du collagène in vitro et in vivo par des vésicules ultradeformables chargées en asiaticoside [J]. J Control Release, 2012, 162(1):143-151.
[27] Wu Lijun. Chimie médicinale naturelle [M]. Pékin: People' S Medical Publishing House, 2012. N ° 302-303.
[28] Wang Zhenzhi. L’effet du cholestérol sur la structure, les propriétés et la fonction de la membrane bilayer des liposomes [D]. Shanghai: East China University of Science and Technology, 2011, 48-52.
[29] Zhang Yangyang, Li Jian, Zhang Li. Évaluation de l’effet des activateurs de perméation sur les caractéristiques de libération transdermique in vitro du médicament asiaticoside à l’aide de la méthode du temps de séjour [J]. Chinese Journal of Emergency Care and Disaster Medicine, 2013, 8(7):623-625.
[30] Zhang Yangyang, Zhao Shangqing, Chen Li, et al. Détermination du taux d’encapsulation des vésicules centella asiatica par dialyse d’équilibre [J]. Journal du collège de logistique de la Police armée (édition médicale), 2015, 24(12): 951-954.
[31] Choi S, Kim J, Lee YJ et coll. Évaluation de la livrée transdermique de nanoémulsions dans la peau de porc ex vivo à l’aide de la microscopie à deux photons et de la microscopie confocale à balayage laser [J]. J Biomed Opt, 2014, 19(10):106006-106006.
[32] Zhang B, Zhao YL. Étude sur la solubilisation de l’asiaticoside par l’hydroxypropyl-β-cyclodextrine [J]. Journal de l’université médicale de Tianjin, 2014, 20(6):486-489.
[33] Panichpakdee J, Supaphol P. utilisation de 2-hydroxypropyl-β-cyclodextrine comme adjuvant pour améliorer les caractéristiques d’encapsulation et de libération de l’asiaticoside à l’intérieur et à partir de films d’acétate de cellulose [J]. Carbohyd Polym, 2011, 85(1):251-260.
[34] Yodlchum K, Phaechamud T. éponges de chitosan hydrophobe modifiées par le monostéarate d’aluminium et le traitement déshydrotherme comme système d’administration prolongée de médicaments [J]. Mater Sci Eng C, 2014, 42:715-725.
[35] Phaechamud T, Yodkhum K, Charoenteeraboon J, et al. Pansement éponge composite de monostéarate d’aluminium de Chitosan contenant de l’asiaticoside pour la cicatrisation des plaies et la promotion de l’angiogenèse dans les plaies chroniques [J]. Mater Sci Eng C, 2015, 50: 210-255.
-
Précédent précédent
Etude sur l’extrait de Centella Asiatica en cosmétique
-
Suivant:
Étude sur les bienfaits pour la peau de l’extrait de feuille de Centella Asiatica


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



