Étude sur les bienfaits de l’extrait de Centella Asiatica pour la peau
Centella asiatique (L 1) U rb1 is a plant in the family Apiaceae, and the whole herb is used in medicine. It is cold in nature, bitter and pungent in taste, and has the effects of clearing away heat and dampness, detoxifying and reducing swelling. It is clinically used for heatstroke in summer, bruises and contusions, infectious hepatitis, epidemic cerebrospinal meningitis, etc.[1]. It was first recorded in Shennong' S classique de Materia Medica, et l’herbe entière est utilisée en médecine et est classé comme grade moyen. Il est largement répandu dans toutes les parties au sud du bassin du fleuve Yangtze.
L’herbe entière de Centella asiatica a été soumise à des recherches chimiques, et cinq composés ont été isolés et identifiés. Après analyse chimique et spectrale, il a été identifié comme p-sitosterol (β-sitosterol), caroténoïde (dauco-stérol), acide asiatique (acide asiatique), acide vanillique (acide vanillique) et asiaticoside (asiaticoside). Asiaticoside est un ingrédient actif extrait de Centella asiatica. En tant que médecine traditionnelle chinoise, il est également connu sous les alias de Luode Da, Beng Da Wan et Ma Ti. C’est une plante de la famille des lamiacées aux propriétés douces, piquantes et rafraîchissantes, qui a pour effet de dissiper la chaleur et de détoxifier [2]. Il a été démontré que l’asiaticoside peut inhiber la prolifération des fibroblastes, réduire l’activité des transaminases, réduire la quantité de mucopolysaccharides acides et de collagène, et inhiber la prolifération excessive de la matrice et des composants fibreux du tissu conjonctif. Des expériences ont montré qu’il peut favoriser la croissance de la peau, la prolifération cellulaire locale, la prolifération du tissu conjonctif et des réseaux vasculaires, et augmenter la sécrétion de mucus.

1 recherche sur la promotion de la guérison des plaies par asiaticoside
L’application topique de 0,2% asiaticoside aux plaies de ponction de cochon d’Inde peut augmenter la teneur en hydroxyproline, augmenter la résistance à la traction, augmenter la teneur en collagène et améliorer la formation épithéliale. Chez les souris diabétiques streptozotocinées, la cicatrisation dela plaie 12 a été retardée. L’application topique d’une solution de 0,4% d’asiaticoside peut augmenter la teneur en hydroxyproline, la résistance à la traction, la teneur en collagène et la formation épithéliale, favorisant ainsi la cicatrisation des plaies. Pour le modèle de ponction du cochon d’Inde, l’administration orale de 1 ms/kg d’asiaticoside a également une activité cicatrisante. Une concentration de 40 ms/ disque d’asiaticoside peut favoriser l’angiogenèse dans le modèle chorioallantoïque de la membrane du poulet. Ces résultats montrent que l’asiaticoside a une activité importante de cicatrisation, tant dans les plaies normales que retardées, et est le principal ingrédient actif de Centella asiatica [3].
En conséquence, leAsiaticoside dans Centella asiatica extraitPeut favoriser la prolifération des fibroblastes et la synthèse de la matrice extracellulaire pendant la cicatrisation des plaies. Cependant, le mécanisme exact au niveau de l’expression moléculaire et génétique est encore mal compris. Lu et al. [4-5] ont utilisé la technologie de micropuces adnc pour détecter le profil d’expression génétique des fibroblastes de la peau humaine in vitro après application d’asiaticoside (30 ms/mL). Les résultats ont montré que 54 gènes fonctionnels connus liés à la prolifération cellulaire, à la promotion du cycle cellulaire et à la synthèse de la matrice extracellulaire étaient significativement augmentés à différents moments. En outre, les niveaux d’arn et de protéines de gènes spécifiques responsables de la synthèse de la matrice extracellulaire (tels que ceux codant le collagène de type I et de type III) ont également été significativement modifiés, et ces réponses ont été significativement corrélées avec la stimulation des cellules par asiaticoside. Cette information peut être utilisée pour étudier plus en détails les gènes cibles qui médient les effets de l’asiaticoside dans les fibroblastes.
On a rapporté que les antioxydants jouent un rôle important dans la cicatrisation des plaies. L’application topique d’asiaticoside (0,2%) deux fois par jour pendant 7 jours sur des blessures cutanées chez le rat peut entraîner une augmentation des niveaux d’antioxydants enzymatiques ou non enzymatiques dans le nouveau tissu, principalement la superoxyde dismutase, la catalase, la glutathion peroxydase, la vitamine E et l’acide ascorbique. Il peut également entraîner une diminution plusieurs fois du taux de lipides peroxydase. Cependant, après 14 jours d’administration continue, il n’y a pas eu de différence significative dans les niveaux d’antioxydants par rapport à ceux des blessures traitées avec le véhicule. Par conséquent, l’étude a conclu que l’asiaticoside peut induire une augmentation des niveaux d’antioxydants au stade initial de la cicatrisation des plaies, ce qui peut être un facteur clé dans les propriétés thérapeutiques de l’asiaticoside [6].
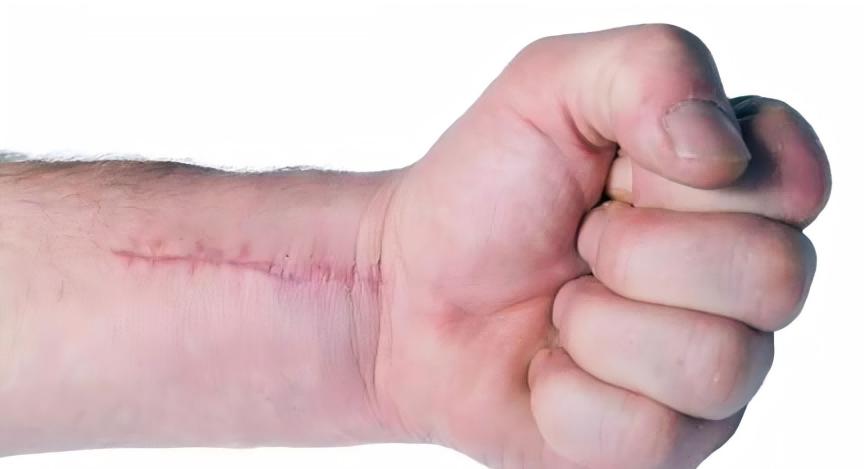
En outre,collagen types I and III are the main components of the dermis. Skin aging is mainly related to a decrease in type I collagen levels, and type I collagen also plays an important role in wound healing. The results of a study by Bonte et al. found that asiaticoside and madecassoside can stimulate collagen secretion, which can increase type I collagen secretion by 2% to 30%, but it was found that only madecassoside can increase type III collagen secretion [7-8].
2 recherche sur le mécanisme d’action de asiaticoside dans le traitement des cicatrices
En étudiant l’effet de l’asiaticoside sur la synthèse du collagène dans les fibroblastes cultivés in vitro, ainsi que son effet sur le modèle animal de la cicatrice proliférative chez les souris nues, il a été constaté que l’asiaticoside peut agir sur le noyau des fibroblastes, entraînant une diminution de la phase de division nucléaire et une diminution ou une perte du nucléole. Avec l’augmentation de la concentration du médicament, la synthèse intracellulaire de l’adn diminue, et la croissance cellulaire est inhibée, avec un taux d’inhibition allant jusqu’à 73%. Cela suggère que le mécanisme d’action de l’asiaticoside est de bloquer la prolifération des fibroblastes, réduisant ainsi la synthèse du collagène et empêchant l’hyperplasie des cicatrices [9].
D’autre part, il y a eu des changements significatifs dans l’ultrastructure des cellules dans le groupe de médicaments, qui se sont manifestés comme un réticulum endoplasmique rugueux et libre, contenu réduit, et le phénomène d’exocytose du corps nucléoprotéique. De plus, la synthèse totale de collagène dans le groupe de médicaments était significativement plus faible que celle dans le groupe témoin, montrant un effet dose-dépendant. Cela indique que l’asiaticoside peut avoir un effet direct sur le réticulum endoplasmique rugueux, un système de synthèse des protéines. Par conséquent, l’asiaticoside empêche l’apparition et le développement de cicatrices en bloquant la croissance et la prolifération des fibroblastes et en inhibant leur capacité à synthétiser et à sécréter du collagène [10]. Outre les modifications morphologiques du modèle animal de la cicatrice proliférative chez la souris nue, l’effet de l’asiaticoside est similaire à celui des fibroblastes cultivés In vitro. Asiaticoside peut favoriser l’apoptose des fibroblastes de cicatrice, réduire le nombre de cellules immunitaires, bloquer les vaisseaux sanguins, réduire le nombre de vaisseaux sanguins, et desserrer les fibres de collagène, causant le tissu cicatriciel entier pour devenir plus doux, plus petit dans la taille, et dégénérative [11].
Le facteur de croissance de transformation p (facteur de croissance de transformation -β, TGF-p) peut être divisé en trois sous-types chez les mammifères: TGF-p, TGF -β2 et TGF -β. Il fonctionne en se liant aux récepteurs [12]. TGF-β a pour effet de favoriser la prolifération des cicatrices, tandis que TGF-β2 a pour effet d’inhiber la prolifération des cicatrices. Parmi eux, le TGF-β joue un rôle important dans la formation de cicatrices kélioïdes [13]. Les résultats expérimentaux ont montré que l’expression de l’arnm TGF-β dans les cicatrices kélioïdes traitées avec asiaticoside était significativement réduite. Ceci est conforme à leurs expériences précédentes, qui ont montré que l’asiaticoside peut réduire l’expression de TGF-β dans les fibroblastes de cicatrices prolifératives cultivées in vitro [l4]. Par conséquent, il a été confirmé in vivo et in vitro que l’asiaticoside peut réduire l’expression tgf-arn dans les cicatrices prolifératives pour réduire l’hyperplasie des cicatrices. Ils ont également observé que l’expression de l’arnm TGF-1β dans les cicatrices prolifératives traitées avec asiaticoside était augmentée, ce qui était significativement plus élevé que dans le groupe témoin. Par conséquent, ils estiment que l’expression de l’arnm TGF-1 dans les cicatrices prolifératives est également l’un des mécanismes par lesquels l’asiaticoside réduit l’hyperplasie cicatricielle.
Actuellement, le TGF-β est considéré comme l’un des facteurs de croissance importants qui causent l’accumulation de la matrice extracellulaire. Il régule la synthèse du collagène de type I et III par la voie de signalisation Smad3, 7/AP-l et la voie MMPS/TIMPs, et TGF-p. Il augmente principalement l’expression des gènes promoteurs du collagène de type I, stimule les fibroblasts pour produire du collagène de type I, et provoque l’hyperplasie des cicatrices [15]. Zhang Tao et al. [16] ont confirmé par des expériences que l’expression positive du collagène de type I dans les cicatrices prolifératives traitées avec l’asiaticoside était réduite, ce qui était conforme aux résultats de l’expression réduite de l’arn TGF-β dans les cicatrices prolifératives traitées avec l’asiaticoside. Dans le même temps, l’expression de l’inhibiteur tissulaire de la métalloprotéine-1 (TIMP1) a été réduite dans les cicatrices proliferatives traitées par l’asiaticoside, ce qui a confirmé en outre que l’asiaticoside réduisait l’expression de TGF-β, entraînant une réduction significative de l’expression de TIMP1, et donc des métalloprotéinases de matrice 1 (MMP1). L’expression TIMP1) a été réduite, ce qui a confirmé en outre que l’asiaticoside a réduit l’expression TGF-β, et en raison de sa réduction significative de l’expression TIMP1, le rapport relatif des métalloprotéinases de la matrice 1 (MMP1)/TIMP1 a augmenté, atteignant le mécanisme d’action de promouvoir la dégradation du collagène de type I et de réduire l’hyperplasie des cicatrices.
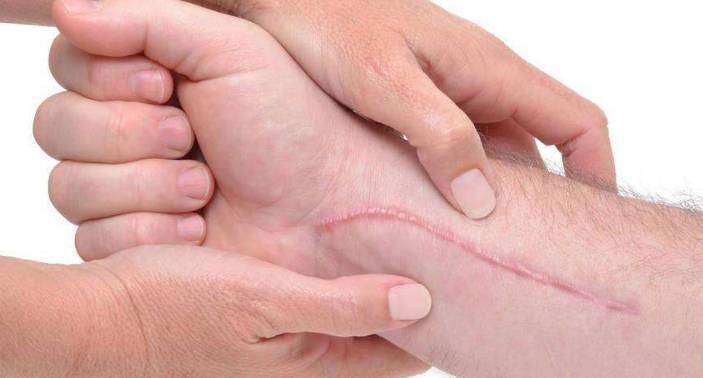
En outre, Pan Mei et al. [17] ont découvert par des expériences que l’asiaticoside inhibe l’hyperplasie des cicatrices principalement en augmentant l’expression du signal de transduction I-Smad Smad 7, en inhibant les effets pathologiques du TGF-16, et en bloquant la prolifération des fibroblastes. LEE et al. [18] ont découvert par d’autres recherches qu’il pouvait induire la phosphorylation de la sm2 et de la sm3. En outre, ils ont constaté que l’asiaticoside peut induire la liaison de Smad3 et Smad4. En accord avec ce résultat, le traitement asiaticoside peut induire la translocation nucléaire des complexes Smad3 et Staad4, indiquant que l’asiaticoside est lié à la voie de signalisation Smad. En outre, SB431542, un inhibiteur de la kinase I du récepteur TGF-p, un activateur de la voie Smad, a été trouvé pour inhibe la phosphorylation de Smad2 induite par l’asiaticoside et la synthèse de collagénase de type I. Par conséquent, ils croient que l’asiaticoside induit la synthèse de la collagénase de type I par la voie Smad indépendante de la kinase TGF-1.
3 études préliminaires sur l’effet anti-tumoral de l’asiaticoside
En termes d’effets anti-tumoraux, il a été constaté queExtrait d’asiaticosidePeut inhiber la prolifération des cellules tumorales in vitro, tout en n’ayant aucun effet sur les lymphocytes normaux. In vivo, il peut inhiber la croissance des tumeurs greffées de souris et prolonger la survie des souris porteuses de tumeurs. L’extrait d’asiaticoside peut également inhiber directement la synthèse de l’adn [19]. Un autre rapport de la littérature montre que l’asiaticoside a un effet inhibiteur sur la prolifération des cellules L929 et CNE cultivées in vitro, et inhibe également la croissance des tumeurs de greffe S180, tout en augmentant le temps de survie des souris portant S180 [20]. Huang Yunhong et al. [21] ont constaté que l’asiaticoside peut inhiber la prolifération des cellules tumorales et que les cellules tumorales multirésistantes montrent également une sensibilité similaire aux cellules non résistantes correspondantes. Aucune résistance croisée significative n’a été observée, et asiaticoside peut également induire l’apoptose des cellules tumorales.
En outre, ils ont constaté que l’asiaticoside et la vincristine avaient un effet synergique, et que l’asiaticoside pouvait augmenter le bloc de phase G/M causé par la vincristine. Ils ont confirmé que l’association de l’asiaticoside et de la vincristine augmentait significativement l’apoptose par cytométrie de flux, électrophorèse sur gel d’agarose et tests morphologiques. Les résultats ci-dessus ont également été confirmés par l’analyse de l’expression de la régulation du cycle et des protéines liées à l’apoptose Bcl-2, caspase-3, cytochrome B1 et cdc2. Le mécanisme spécifique de cet effet synergique n’est pas encore entièrement compris, mais ils croient initialement qu’il se pourrait que l’asiaticoside augmente significativement la concentration intracellulaire de calcium et réduit le potentiel de la membrane mitochondriale au début de l’induction de l’apoptose, affectant ainsi la fonction mitochondriale. Ceci peut être une étape clé dans l’action de l’asiaticoside sur la voie de l’apoptose, augmentant ainsi la sensibilité des cellules à l’apoptose induite par les médicaments antitumoraux, et produisant ainsi un effet synergique avec la vincristine. Ils croient que l’asiaticoside a le potentiel d’être utilisé comme régulateur biochimique dans la chimiothérapie tumorale.

4. Effets préventifs et thérapeutiques sur l’hyperplasie mammaire
Li Ping et al. [22] [en]successfully prepared a rat model of breast hyperplasia by simulating the pathogenesis of human breast hyperplasia. The study found that whether Centella asiatica was administered preventively or therapeutically, it showed an effect on the symptoms of breast hyperplasia in rats caused by an imbalance in the E2, P, and E2/P ratios, such as nipple diameter, breast diameter, and breast height. High doses significantly inhibited estrogen levels, and all dose groups increased progesterone levels (up to 160%), resulting in a significant improvement in the estrogen/progesterone ratio (up to 54% reduction), which significantly reduced the rate of mammary hyperplasia and the degree of hyperplasia of the mammary gland tissue compared to the model control group, and showed a clear dose-effect relationship. Therefore, the researchers believe that the mechanism of Extrait de Centella asiaticain preventing and treating mammary hyperplasia in experimental rats lies in reducing serum E levels, increasing P levels, and regulating and improving the E2/P ratio.
5 effet protecteur sur la muqueuse gastrique
Hong Kong CHENG et al. [23] ont trouvé que l’extrait de Centella asiatica peut résister aux lésions des muqueuses gastriques induites par l’éthanol-chez les souris en renforçant la barrière muqueuse et en réduisant les lésions des radicaux libres, ce qui suggère que l’extrait de Centella asiatica a une certaine activité d’ulcère anti-gastrique. Le Jinmao et al. [24] ont constaté qu’après 2 semaines de traitement avec l’extrait composé de Centella asiatica, Le flux sanguin des rats a accéléré, Le flux sanguin était linéaire ou mitochondrial, l’agrégation des cellules sanguines a diminué, et la zone de guérison des ulcères gastriques a atteint 99,5%. Il a été constaté que l’extrait de Centella asiatica a un certain effet inhibiteur sur la sécrétion gastrique de suc induite par l’histamine, l’acide libre de suc gastrique et l’acide total, et la pepsine.
Guo et al. [25] ont administré par voie orale différentes concentrations deCentella asiatica extrait d’eauEt asiaticoside de rats avec des ulcères gastriques induits par l’acide acétique. Il a été constaté que les deux pouvaient réduire la superficie des ulcères d’une manière dose-dépendante 1, 3, et 7 jours après l’induction de l’ulcère. Il a également été constaté qu’au cours de ce processus, l’activité et le niveau d’expression protéique de l’oxyde nitrique synthase inducible (iNOS) dans les tissus d’ulcère étaient réduits, et le nitrate, le nitrite et le produit final stable d’oxyde nitrique (NO) dans les tissus d’ulcère étaient également réduits. Ils ont conclu que l’extrait d’eau de Centella asiatica peut réduire la zone d’ulcère gastrique et inhiber la production d’oxyde nitrique dans l’ulcère gastrique. Les niveaux d’activité et d’expression protéique ont été réduits, et les nitrates, les nitrites et le produit final stable d’oxyde nitrique (NO) ont également été réduits dans les tissus d’ulcère.
Ils ont conclu que l’extrait d’eau de Centella asiatica et l’asiaticoside ont des propriétés anti-inflammatoires et favorisent la guérison des ulcères en inhibant la synthèse de NO. Ils ont également constaté que la guérison des ulcères s’accompagnait d’une diminution de l’activité de la myélooperoxydase dans le tissu ulcère, ainsi que d’une augmentation de la prolifération des cellules épithéliales et de l’angiogenèse. Un facteur angiogénique clé, le facteur de croissance basique des fibroblastes, A été régulé dans le tissu ulcère de rats traités avec de l’extrait d’eau de Centella asiatica et de l’asiaticoside. Ces résultats indiquent en outre que Centella asiatica et ses ingrédients actifs ont une grande valeur d’application en tant que médicament anti-ulcère gastrique.
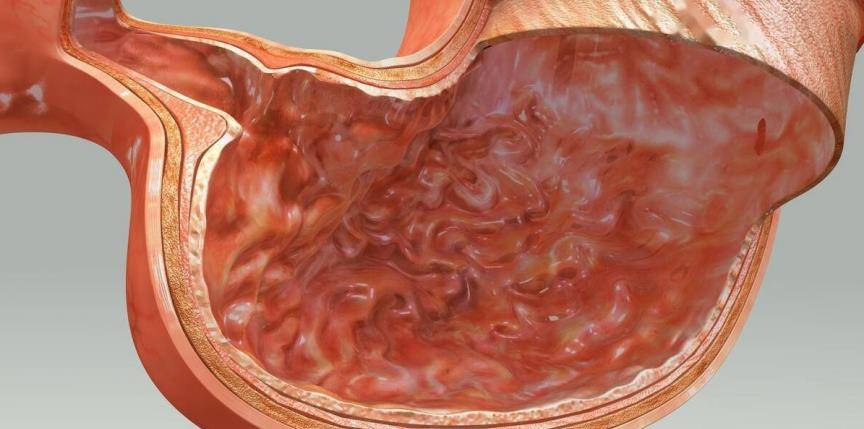
6 effets anti-anxieux et antidépresseurs et autres effets pharmacologiques
Chen Yao et al. [26] ont constaté que le total asiaticoside exerce un effet antidépresseur en améliorant le corps et#39; S résistance à divers stimuli non spécifiques et éviter le désordre des fonctions régulateurs de l’axe cortex hypothalame-hypophyse-surrénale et de l’axe hypothalame-hypophyse-thyroïde provoqué par des stimuli de stress excessifs. WIJEWEERA et al. [27] ont également trouvé à travers un modèle comportemental de rat que Centella asiatica, ses extraits liposolubles de méthanol et d’acétate, et asiaticoside pur ont montré la même activité anxiolytique. Il a également été constaté que l’asiaticoside n’influait pas sur l’activité spontanée, ce qui indique que ces composants n’ont pas d’activité sédative chez les rongeurs. GUSEVA et al. [28] ont également constaté que l’asiaticoside total est efficace et bien toléré dans le traitement de la sclérodermie systémique et locale, et est donc recommandé pour l’administration orale ou topique. Les indications pour l’administration orale sont la sclérodermie systémique chronique ou subaiguë avec des dommages limités de la peau, tandis que la combinaison de comprimés et pommades est recommandée pour la sclérodermie progressive ou focale. En outre, Centella asiatica a des effets anti-cytotoxiques, anti-stress, anti-lèpre, anti-fongique, anti-filariose, anti-tuberculose, analgésique, anti-inflammatoire et autres. Il est également utilisé dans les préparations de beauté et les insectifuges.
7. Résumé résumé
Le moderneapplication of Centella asiatica is already very extensive, and as one of its main ingredients, asiaticoside, is based on the above-mentioned various special effects, it will definitely play its unique advantages in more and more fields. Although most of the current research on its mechanism is still in its infancy, with the wide application of various cell and molecular biology techniques in the field of drug mechanism research, it is believed that our understanding of asiaticoside will become clearer and clearer, which will provide a basis for the clinical development of new dosage forms and new treatment areas.
Références:
[1] He Mingfang, Meng Zhengmu, Wo Lianqun. Recherche sur la composition chimique de Centella asiatica [J]. Journal of China Pharmaceutical University, 2000, 31(2): 91-93.
[2] Zhao Yuxin, Li Manling, Feng Weihong et al. Progrès de la recherche de Centella asiatica. Chinese Journal of Traditional Chinese Medicine Information, 2002, 9(8): 81-84.
[3] SI-IUKLA A, RASIK A M, JAIN G K, et al. Activité curative In vitro et In vivo de l’asiaticoside isolé de centella asiatica [J]. J Ethnopharmacol, 1999, 65(1): 1-11.
[4] LU L, YING K, WEI S, et al. L’induction Asiaticoside pour la progression du cycle cellulaire, la prolifération et la synthèse du collagène dans les fibroblastes cutanés humains [J]. Int J Dermatol, 2004, (11): 801-807.
[5] Lu L, YINGK, WEI S, et al. L’induction de gènes associés au fibroblaste cutané par asiaticoside montrée in vitro par analyse de micropuces d’adn [J]. Br J Dermatol, 2004, 151(3): 571-578.
[6] SHUKLA A, RASIK A M, DHAWAN B N. élévation induite par l’asiaticoside des niveaux d’antioxydants dans la cicatrisation des plaies [J]. Phytother Res, 1999, 13(1): 50-54.
[7] l
[8] bonté F, DUMAS M, CHAUDAGNE C, et al. Activité Comparative de l’asiaticoside et du madecassoside sur la synthèse du coHagen de type I et 111 par des fibroblastes humains cultivés [J]. Ann Pharm Fr, 1995, 53(1): 38-42.
[9] Wang Ruiguo, Wang Jinju, Yu Xiangbin, et al. Effets de l’asiaticoside sur la synthèse de l’adn et la synthèse du collagène dans les fibroblastes [J]. Journal of Fujian College of Traditional Chinese Medicine, 2001, 11(2): 41-42.
[10] Xie Julin, Li Tianzeng, Qi Shaohai, et al. Effet de l’asiaticoside sur les fibroblastes cultivés in vitro [J]. Journal of Zhongshan University of Medical Sciences, 2001, 22(1): 4l-43, 47.
[11] QI S H, XIE J L, LI T Z, et al. Étude expérimentale sur l’effet de l’asiaticoside sur les cicatrices hypertrophiques après brûlures [J]. Chinese Journal of Burns, 2000, 16(1): 53-56.
[12] CHIN D, BOYLE G M, PARSONS P G, et al. Qu’est-ce que le transforming growth factor-beta (TGF-B)? [J] J Plast Surg, 2004, 57(3): 215-221.
[13] SOC, BEANES S R, HU F Y, et al. La transition ontogénétique dans la régulation du facteur de croissance de transformation de la plaie fœtale est corrélée à l’organisation du collagène [J]. Am J Pathol, 2003, 163(6): 2459-2476.
[14] SUNIYOSHI K, NAKAO A, SETOGUCHI Y, et al. Les Smads régulent la contraction du gel de collagène par les fibroblastes cutanés humains. Br JDermatol, 2003, 149(3): 464-470.
[15] YAMANE K, SUZUKI H, IHN H et al. Régulation spécifique au type cellulaire du gène de collagène alpha2(I) sensible au tgf-bêta par méthylation CpG [J]. J Cell Physiol, 2005, 202(3): 822-830.
[16] Zhang Tao, Rong Xinzhou, Yang Ronghua, et al. Effets de l’asiaticoside sur l’expression de l’arnm du facteur de croissance bêta 1 et de la métalloprotéinase de la matrice dans les cicatrices prolifératives [J]. Journal of Southern Medical University, 2006, 26(1): 67-70.
[17] Pan Shu, Li Tianzeng, Li Yeyang, et autres. Effets de l’asiaticoside sur la prolifération des fibroblastes et la voie de signalisation Smad dans les cicatrices prolifératives [J]. Chinese Journal of Plastic and Reconstructive Surgery, 2004, 18(4): 291-294.
[18] LEE J, JUNG E, KIM Y, et al. L’asiaticoside induit la synthèse col·lagen I humaine par la signalisation Smad indépendante du récepteur TGF-beta Ikinase (TbetaRIkinase) [J]. Planta Med, 2006, 72(4): 324-328.
[19] SAMPSON J H, RAMAN A, KARLSEN G, et al. In vitro kératinocyte effet antiproliférant de l’extrait de Centella asiatica et des saponines. Phytomedicine, 2001, 8(3): 230-235.
[2O] Wang Ruiguo, Wang Jinju, Wang Baokui, et al. Étude expérimentale préliminaire sur l’effet anti-tumoral de l’asiaticoside [J]. Fujian Traditional Chinese Medicine, 2001, 32(4): 39-40.
[21] Huang Yunhong, Zhang Shenghua, Zhen Ruixian et al. L’asiaticoside induit l’apoptose dans les cellules tumorales et renforce l’effet anti-tumoral de la vincristine [J]. Cancer, 2004, 23(12): l 599-1604.
[22] Li Ping, Ding Jianhua, Gu Bing et al. Prévention et traitement de Centella asiatica contre l’hyperplasie mammaire chez des rats expérimentaux [J]. Journal of Nanjing Medical University, 2002, 22(6): 470-473.
[23] CHENG C L, GUO J S, LUK J et al. Les effets curatifs de l’extrait de Centella et de l’asiaticoside sur les ulcères gastriques induits par l’acide acétique chez les rats [J]. Life Sci, 2004, 74(18): 2237-2249.
[24] Le Jinmao, Pu Peiying, Lei Ying. Effets de l’extrait composé de Centella asiatica sur les ulcères expérimentaux chroniques et la microcirculation chez les rats [J]. Jiangsu Traditional Chinese Medicine, 1992, 13(3): 42-44.
[25] GUO J S, CHENG C L, KOO M W. effets inhibiteurs de l’extrait d’eau de Centella asiatica et de l’asiaticoside sur l’oxyde nitrique synthase inducible pendant la guérison de l’ulcère gastrique chez le rat [J]. Planta Med, 2004, (12): 1150-1154.
[26] Chen Yao, Qin Luping, Zheng Hancheng et al. Effets de l’asiaticoside sur la fonction neuroendocrinienne chez les rats souffrant de dépression [J]. Journal de la deuxième université de médecine militaire, 2002, 23(11): 1224-1226.
[27] WIJEWEERA P, ARNASON J T, KOSZYCKI D. et al. Evaluation des propriétés anxiolytiques des extraits de Gotukola- (Centella asiatica) et asiaticoside dans des modèles comportementaux de rat [J]. Phytomedi ciné, 26, l3(9-10): 668-676.
[28] GUSEVAN G, STAROVOITOVA M N, MACH E S. madeeassoltraitement de la sclérodermie systémique et localisée [J]. Ter Arkh, 1998, 70(5): 58-61.
-
Précédent précédent
Quel est l’ingrédient actif dans l’extrait de Centella Asiatica?
-
Suivant:
Quel est l’avantage de l’extrait d’herbe Gotu Kola?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




