Etude sur la technologie de Microencapsulation en poudre de curcumine
Les curcuminoïdes sont une classe de composés purifiés à partir de lA Aapartie rhizome de la plante Curcuma Curcuma longa. Il s’agit principalement de la curcumine (Cur), de la déméthoxycurcumine (DMC) et de la bis-déméthoxycurcumine (Bis-DMC), qui représentent respectivement 60% à 75%, 10% à 27% et 5% à 15%. En tant que substance active, la curcumine a divers effets tels qu’antioxydant [1-4], anti-inflammatoire [5-9] et anticancéreux [10-15]; En outre, dans la longue histoire du développement humain, il y a eu des dossiers médicaux du curcuma depuis longtemps. Par exemple, le livre de médecine indienne Ayurveda l’a appelé le «piment de la vie», et la Chine et#39; L LlgrEt en plusCompendium classique de pharmacologie de Materia Medica a également enregistré que le curcuma peut être utilisé pour traiter les douleurs cardiaques, douleurs abdominales, plaies, etc. Cela montre que la curcumine a de larges perspectives d’applicatiSur ledans les domaines de l’alimentation, de la médecine et des produits chimiques quotidiens.
Cependant,La curcumineis easily degraded Par:light, heat, oxygen, acid Et en plusalkali, Et en plusthese problems limit its application and scope De lause. A microcapsule is a spherical particle with a diameter De la50 nm À propos de2 mm that contains a core material, or Le conseil des ministrescore material is dispersed dansa wall material matrix. At present, microencapsulationtechnology has been widely used dansthe delivery systems of active substances, which can improve the light, heat, oxygen, and acid-base stabilitéof active substances, and also has a certain controlled-release effect during in vivo and in vitro digestion processes [16]. Therefore, La curcuminemicroencapsulationtechnology is a good way to improve the application effect of curcumin and broaden its scope of application. Therefore, this paper describes the physicochemical properties, in vivo metabolic processes and biological activities of curcumin, and focuses on a review of the microencapsulation technology of curcumin.
1 aperçu de la curcumine
1.1 Structure et propriétés physico-chimiques de la curcumine
La curcumine[1,7-bis(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione] is a bis-ferulic acid compound with the molecular formula C21H20O6 and molecular weight 368.37 g/mol. Its melting point is 179–183 °C, and its chemical structure is a β-diketone with an o-methoxyphenol group attached to each end (see Figure 1). The transfer of hydrogen atoms on the β-diketone gives curcumin a keto-enol tautomer (see Figure 2). Under slightly acidic and neutral conditions, curcumin exists in the keto form, while under alkaline conditions, it exists in the enol form [17-19].
Curcumin is an orange-yellow crystal that has been used in food processing as a natural pigment. It is red when the pH HHis <1, yellow when the pH is 1–7, and orange-red when the pH is >7.5 [20]. Curcumin is very insoluble in water, with a solubility of about 11 ng/mL [21]. Its low solubility is mainly due to its highly hydrophobic structure and crystalline nature. When curcumin exists in a crystalline state, it forms intermolecular and intramolecular hydrogen bonds [22], which inhibit the solubility of curcumin in water. However, it is easily soluble in organic solvents such as methanol, ethanol, acetone and dimethyl sulfoxide.
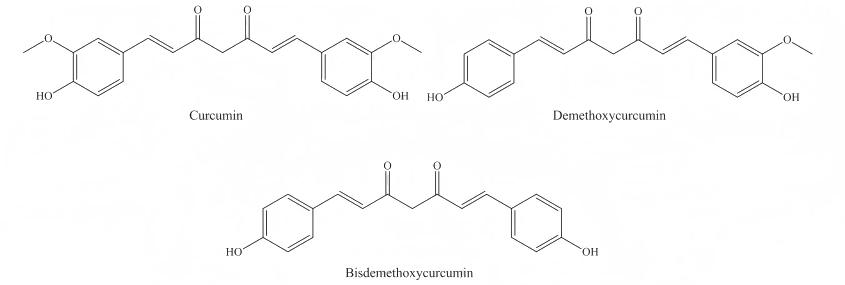
Extrait de curcumais unstable; it begins to degrade at 70 °C, and about 32% of it degrades after 20 minutes at 70 °C CC[23]. It is also sensitive to light, and under light conditions, the β-diketone loses two hydrogen atoms to form small molecule phenolic compounds such as vanillic acid, vanillin, ferulic acid, ferulic aldehyde, etc. [24], or undergo demethoxylation and keto-enol isomerization to form by-products such as diketones and methanol, acetate, etc. [25]. At present, most scholars believe that curcumin is extremely unstable under alkaline conditions, decomposing to produce substances such as ferulic acid, ferulic acid methyl ester, and vanillin, and turns yellow or brown. It is more stable under acidic and neutral conditions [20, 26-27], which may be related to its conjugated diene structure [26]. However, some scholars believe that curcumin is more unstable under acidic conditions, and its degradation rate is about 20 times higher than that under neutral or alkaline conditions [28].
1.2 activité biologique de la curcumine
1.2.1 antioxydant
La curcumine est un antioxydant phénolique qui brise la chaîne. Son effet antioxydant est principalement obtenu en récupérant les espèces réactives d’oxygène (ROS) et en augmentant l’activité des enzymes antioxydantes et des enzymes métaboliques de phase II en tant qu’inducteur des voies antioxydantes [29].
En ce qui concerne l’activité de la curcumie dans le stockage des ROS, certains chercheurs pensent qu’elle est due à la dissociation de l’hydrogène sur le groupe phénolique [3,30-32], tandis que d’autres pensent qu’elle est due à la dissociation de l’hydrogène sur le groupe central méthylène de la structure β-dicétone [33]. Chez Guo et Al., et al.[1], par rapport au contrôle à blanc, le traitement à la curcumine des cellules endothéliales de la cornée humaine après un stress oxydatif induit, la viabilité cellulaire a augmenté et la production de ROL lintracellulaire a diminué, ce qui était principalement dû à la curcumine a considérablement amélioré l’expression des facteurs de transcription nucléaire (NF-κB) dans la cellule, ainsi que la production de superoxyde dismutase 1 de la voie Keap1/ Nrf2 / ARE et d’hémie oxygénase 1. Améliorant ainsi la capacité antioxydante des cellules endothéliales cornéennes humaines. Deng et Al., et al.[34] ont constaté que la curcumine et ses analogues peuvent effectivement inhiber l’hémolyse oxydative induite par les radicaux libres des globules rouges. Momeni et Al., et al.[4] ont évalué l’effet protecteur de la curcumine contre la néphrotoxicité de l’arsenite de sodium. La curcumine, en tant qu’antioxydant, peut ralentir ou prévenir les effets néfastes de l’arsenite de sodium sur le glomérule et les tubules proximaux dans le tissu rénal et la capacité antioxydante du sérum. Dans l’étude de Rai et Al., et al.[2], la curcumine était comparable aux médicaments antioxydants dans le traitement de la fibrose sous-muqueuse de la cavité buccale, et elle a considérablement amélioré le patient' L ll’ouverture de la bouche, la sensation de brûlure en mangeant des aliments épicés, et les papilles de la langue.
1.2.2 anti-inflammatoire
L’inflammation est le corps ' S réponse défensive aux stimuli. C’est une partie importante du système immunitaire et#Il est associé à de nombreuses maladies chroniques, telles que l’obésité, le diabète, la broncho-pneumopathie chronique obstructive et l’athérosclérose [7]. La curcumie peut inhiber efficacement l’inflammation en inhibant les médiateurs inflammatoires et les facteurs de transcription nucléaire (NF-κB) et en améliorant l’action des glucocorticoïdes [35]. Par exemple, la curcumine peut réduire l’inflammation en augmentant la régularisation de SIRT1 pour prévenir l’activation des inflammasomes NLRP3, protégeant ainsi contre la pneumonie aiguë [9]. Dans un modèle d’inflammation In vitro induite par le facteur de nécrose tumorale α (TNF-α) (placenta humain, tissu adiposo viscéral et tissu adiposo sous-cutané), la curcumine a inhibé de manière significative les médiateurs inflammatoires (interleukines 1A, 1B Bet 6) et a favorisé l’expression de cytokines anti-inflammatoires interleukines 4 et 3. Par conséquent, la curcumine devrait être utilisée comme intervention thérapeutique pour les complications pro-inflammatoires de la grossesse [9]. La curcumie réduit la réponse inflammatoire en régulant les niveaux de médiateurs inflammatoires (tnf-α, interleukine-1β et 17, et facteur de croissance transformant -β) dans les articulations des rats atteints d’arthrite collagène, inhibe l’expression de la cyclooxygénase (COX-2), et induit également l’apoptose des macrophages pour exercer un effet thérapeutique sur l’arthrite collagène [6].
1.2.3 anti-tumeur
La curcumine exerce son effet anti-tumoral principalement en induisant l’apoptose dans les cellules tumorales, en inhibant l’invasion tumorale et les métastases, et en renversant la résistance aux médicaments dans les cellules tumorales [36]. Par exemple, la curcumine améliore l’expression du miR-99a dans le rétinoblastome pour bloquer la voie JAK/STAT, inhibant ainsi la malignité cellulaire [10]. La curcumine inhibe la prolifération du glioblastome en bloquant la voie AKT/MTOR R[11]. La curcumine inhibe la phosphorylation des protéines kinases (protéine kinases régulée extracellulaire, ERK) dans les cellules cancéreuses du côlon humain, ce qui conduit à la suppression des signaux ERK Kc-MYC et cyclin D1. La proportion de cellules G0/G1 augmente, ce qui bloque le cycle cellulaire des cellules cancéreuses du côlon et induit l’apoptose [13]. En outre, dans Xu et Al., et al.[12], CD44 est l’un des marqueurs communs à la surface des cellules cancéreuses du côlon, et la curcumine peut réduire l’expression de CD44 et inhiber la prolifération, la migration et la formation de la sphère tumorale des cellules cancéreuses du côlon. Par conséquent, la curcumine peut être un médicament adjuvant contre le cancer du côlon qui cible CD44.
1.2.4 autres activités biologiques
En plus des fonctions antioxydantes, anti-inflammatoires et anti-tumorales mentionnées ci-dessus, la curcumine a une variété d’autres activités fonctionnelles. Par exemple, la curcumine peut inhiber considérablement la croissance d’helicobacter pylori à des concentrations supérieures à 200 μmol/L [37]; La curcumine peut améliorer les troubles métaboliques du diabète, réguler efficacement la glycémie et les lipides sanguins, améliorer la fonction des cellules β, réduire la résistance à l’insuline, exerçant ainsi un effet hypoglycémique [38]; La curcumie peut également se lier aux ligands dans les cellules adipeuses, exerçant un effet inhibiteur sur la différenciation des adipocytes et a le potentiel de prévenir l’obésité [39]. De là on peut voir que la curcumine est une substance bioactive avec un grand potentiel de développement.
1.3 Absorption, métabolisme et biodisponibilité de la curcumine
1.3.1 Absorption et métabolisme
Depuis 1978, année où Holder et Al., et al.[40] ont pour la première fois étudié et signalé les métabolites de la curcumine chez les rats, de nombreux chercheurs au pays et à l’étranger ont mené une série d’études métaboliques in vitro et in vivo sur la curcumine.
Les principales voies métaboliques de la curcumine in vivo comprennent le métabolisme de réduction de phase I et le métabolisme de conjugaison de phase II [41] (voir la Figure 3), ainsi que la dégradation, l’auto-oxydation et l’oxydation catalytique de la curcumine. Le métabolisme réducteur de la phase i de la curcumie est un processus d’hydrogénation par étapes dépendant du nadph des quatre doubles liaisons dans la structure β-dicétone [42]. Ce processus est principalement catalysé par le cytochrome P450 et l’alcool déshydrogénase dans le cytoplasme des cellules du foie et de l’intestin grêle [43]. Les principaux produits sont la dihydrocurcumine, la tétrahydrocurcumine (tétrahydrocurcumine, THC), l’hexahydrocurcumine et l’octahydrocurcumine [44]. Le métabolisme combiné de la curcumine II fait référence au processus dans lequel la curcumine ou ses métabolites réduits de phase I sont glucuronidés ou sulfatés sous la catalyse des glucuronidases ou des sulfotransférases, la glucuronidation étant le processus principal [45].
L’uridinediphosphate glucuronosyltransférase (UGT) ajoute le groupe glycosyle de l’uridine-5 ' acide diphosphate glucuronique en curcumine ou ses métabolites de phase I, améliorant la solubilité dans l’eau de ces substances et les rendant plus facilement excrétées du corps dans l’urine [46] [traduction]; L’ugt est principalement distribué dans le réticulum endoplasmique des cellules dans des organes tels que le foie, les intestins et les reins. L’ UGT Tdans le foie (UGT1A1, UGT1A9) catalyse principalement la production de conjugués phénoliques d’ hydroxylglucuronide et d’ une petite quantité d’ alcool conjugués d’ hydroxylglucuronide à partir de curcuminoïdes.
Les ugag intestinaux ne peuvent catalyser que la production de conjugués d’acide hydroxylglucuronique phénolique à partir de curcuminoïdes, tels que l’ugt1a8 et l’ugt1a10 [47] [traduction]. En outre, UGT1A7, UGT1A8, et UGT1A10 présentent une activité élevée envers l’hexahydrocurcumie, mais UGT1A7, UGT1A8, et UGT1A10 sont inactifs ou ont une faible activité dans le foie, mais sont spécifiquement exprimées dans le tractus gastro-digestif [48-49]. On peut voir qu’en plus du foie, le tractus gastro-intestinal peut être l’organe principal de la glucuronidation de la curcumie. Les sulfotransférases (SULTs) peuvent transférer le groupe sulfonyle dans le SO3- à des substrats contenant des groupes hydroxyle ou aminés pour former des produits polaires plus facilement éliminés du corps [50]. L’intestin grêle est le principal tissu du corps pour la sulfatation de la curcumine. SULT1A3 peut servir de médiateur pour la sulfonation de la curcumine et de la déméthoxycurcumine, SULT1B1 sert uniquement de médiateur pour la sulfonation de la curcumine, et SULT1C4 catalyse les trois curcuminoïdes [51].
En plus des processus métaboliques ci-dessus, les microorganismes intestinaux jouent également un rôle important dans le métabolisme de la curcumine. Par exemple, la bactérie intestinale humaine Blautia sp. MRG-PMF1 peut convertir la curcumine en DMC et Bis-DMC, ou convertir la DMC en Bis-DMC [52]; Dans un modèle fécal humain, les trois curcuminoïdes (Cur, DMC, Bis-DMC) ont été dégradés, avec des taux de dégradation de 24%, 61% et 87%, respectivement. Le THC, l’acide dihydroférolique (DFA) et le 1-(4-hydroxy-3-méthoxyphényl)-2-propanol ont été identifiés par chromatographie liquide à ultra-haute performance et spectrométrie de masse [53]. La curcumine produit différents métabolites sous différentes flore intestinale. Il a été rapporté que la curcumine peut subir diverses transformations telles que la déméthylation, la réduction, l’hydroxylation, l’acétylation et la méthylation sous l’action de la flore intestinale [52-55]. En outre, de nombreux chercheurs ont proposé qu’il existe une interaction mutuelle entre la curcumine et la flore intestinale, c’est-à-dire que la curcumine peut produire différents métabolites lors de la biotransformation des micro-organismes intestinaux, et à son tour, la curcumine et ses métabolites ont un effet régulateur sur l’équilibre de la flore intestinale [56-59]; Et l’équilibre de la flore humaine a un impact important sur la santé. Par conséquent, cela peut être utilisé pour expliquer la contradiction entre la faible biodisponibilité de la curcumine et ses effets bénéfiques largement rapportés.
1.3.2 biodisponibilité
Après administration orale, la curcumine est principalement excrétée dans les matières fécales sous la forme du médicament parent. Wahlstrom et Blennow [60] ont administré par voie orale de la curcumine (1 g/kg) à des rats SD, et après 72 h, environ 75% de la curcumine a été excrétée des rats dans les matières fécales, et la curcumine a été décelée de façon négligeable dans l’urine (< 0,0006%). La curcumine est rapidement métabolisée dans le foie ou le sang. Dans les cellules du foie ou les suspensions microsomales du foie, 90% de la curcumine est métabolisée en 30 minutes [60]; Après injection intrapéritonéale de curcumine (100 mg/kg), la concentration plasmatique maximale de curcumine est de 2,25 μg/mL après 15 minutes [61]; Après injection intraveineuse de curcumine, la concentration plasmatique de curcumine est d’environ 0,02 μg/mL, et la concentration approche zéro à 60 min [60]. La curcumine a une mauvaise absorption et un métabolisme rapide, ce qui conduit à sa faible biodisponibilité.
2 curcumine microencapsulation technologie
Microcapsules can effectively enhance the solubility and stability of functional ingredients and improve their bioavailability Par:encapsulating bioactive substances. According to the internal structure and morphology of the microcapsules, such as single-layer or multi-layer wall material, core material wrapped inside the microcapsule or dispersed in the wall material matrix, spherical or irregular shape, etc. [62], turmeric curcuminoid microcapsules can be broadly divided into the following types (see Figure 4).
2.1 principales méthodes de microencapsulation de curcumine
2.1.1 méthode de séchage par pulvérisation
Le principe du séchage par pulvérisation est de disperser le matériau de noyau dans la solution de matériau de paroi pour former une solution d’alimentation stable et uniforme. La solution d’alimentation est ensuite dispersée en gouttelettes minuscules sous l’action de l’air comprimé à grande vitesse de l’atomiseur. L’eau contenue dans les gouttelettes s’évapore rapidement sous l’action du flux d’air à haute température dans la chambre de séchage, et le matériau de la paroi se solidifie pour former des particules de microcapsules sèches. La méthode de séchage par pulvérisation permet simultanément la préparation et le séchage des microcapsules. Il a les caractéristiques d’être simple dans le processus, faible coût, production industrielle facile à mettre en œuvre, caractéristiques de la microencapsulation de substances sensibles à la chaleur [63]. Il s’agit de la technologie de microencapsulation la plus largement utilisée [64] et c’est aussi une méthode courante pour incorporer la curcumine.
Dans la préparation des microcapsules de curcumine, le séchage par pulvérisation est généralement combiné avec une émulsification. La viscosité de l’émulsion et les paramètres de séchage par pulvérisation sont les deux principaux facteurs qui influent sur la qualité des microcapsules de curcumine. La viscosité de l’émulsion est influencée par le type de matériau de paroi et le rapport entre le cœur et la paroi. Le matériau de paroi utilisé pour le séchage par pulvérisation devrait avoir une bonne solubilité dans l’eau, maintenir une faible viscosité même à des concentrations élevées, être facile à pulvériser, à déshydrater et à sécher, et comporter peu d’accessoires de paroi [65]. Les glucides et les protéines sont couramment utilisés. La réduction du rapport entre le cœur et la paroi, c’est-à-dire l’augmentation de la proportion de matériau de paroi, augmente la viscosité de l’émulsion.

Meena et Al., et al.[66] investigated the effect of the core-wall ratio on the encapsulation of Microcapsules de curcumine at core-wall ratios of 1:1, 1:2, and 1:3. As the proportion of wall material increased, the encapsulation rate increased in turn, but there was no significant difference in the encapsulation rate under the conditions of 1:2 and 1:3. Moreover, as the solids content increased, the yield of the product showed an upward trend and then a downward trend, which may be due to the increased viscosity of the emulsion and poor droplet atomization [67-68]. Spray drying parameters such as feed rate and pulvérisationdrying temperature have an impact on the quality of the microcapsules and the curcumin in the microcapsules [69] [traduction]. If the feed rate is too fast or the pulvérisationdrying temperature is too low, the particles will not be adequately dried, the moisture content in the microcapsules will increase, curcumin will tend to form crystals, and in a two-fluid nozzle spray dryer, if the core material feed rate is too fast, there will not be enough wall material to coat the core material, and the prepared microcapsules will be too large in size [69].
Les microcapsules de curcumine préparées par la technologie de séchage par pulvérisation améliorent considérablement la stabilité thermique de la curcumine. Après avoir été entreposé à 70 °C pendant la même période de temps, le taux de dégradation de la curcumine en microcapsules est d’environ 20%, tandis que le taux de dégradation de la curcumine non encapsulée est supérieur à 90% [70]. Après digestion gastrique simulée, environ 88% de curcumine est encore retenu dans les microcapsules, après digestion intestinale simulée, 86,36% de curcumine a été libéré [66]; La curcumine non encapsulée était presque complètement dégradée lorsqu’elle était placée sous une del de 5 W pendant 12 jours [70], tandis que le taux de rétention de la curcumine microencapsulée était de 84,154% après 8 semaines d’entreposage [71]. Andrade et Al., et al.[72] ont confirmé que le procédé de séchage par pulvérisation n’affecte pas l’activité fonctionnelle de la curcumine.
Après séchage par pulvérisation, la curcumine dans les microcapsules peut encore réduire considérablement le niveau de TNF-α et a toujours le potentiel pour traiter les maladies neurodégénératives. Le procédé de séchage par pulvérisation n’affecte pas l’activité biologique de la curcumine, mais renforce au contraire l’activité anticancéreuse de la curcumine dans les microcapsules. Cela peut être dû au fait que la technologie de microencapsulation améliore la solubilité de la curcumine et augmente son absorption par les cellules, augmentant ainsi sa concentration efficace et augmentant son activité [73]. Comparativement à la lyophilisation, bien que la température élevée instantanée pendant le processus de séchage par pulvérisation cause une dégradation partielle de la curcumine dans les microcapsules, dans l’étude de D. M. CANO-HIGUITA et Al., et al.[71], le taux de rétention de la curcumine dans les microcapsules séchées par pulvérisation dans les mêmes conditions d’entreposage était de 84,154%, tandis que le taux de rétention de la curcumine dans les microcapsules lyophilisées n’était que de 63,832%. Cela montre que le séchage par pulvérisation est une bonne méthode pour préparer les microcapsules de curcumine.
2.1.2 méthode de Coacervation
The coacervationmethod is based on the principle that two polymers with opposite charges, such as protein-polysaccharide, protein-protein, and polysaccharide-polysaccharide, reduce the solubility of their complexes due to chargeneutralization, and deposit and encapsulate around the core material to form microcapsules. This method is only suitable for microencapsulation of non-water-soluble functional ingredients. In addition to electrostatic attraction and charge neutralization, non-covalent interactions (such as hydrogen bonding and hydrophobic interactions) also contribute to the formation De microcapsulesduring the Complexe complexecoacervation method [74]. Curcumin microcapsules prepared by the complex coacervation method have a high encapsulation rate (see Table 1), which provides good protection for curcumin in light and heat environments, and also has a good slow-release effect on curcumin in in vitro simulated digestion tests. However, the complex coacervation method is affected by factors such as the pH of the system, the concentration entrethe two polymers, and the temperature, and the conditions are difficult to control and the process is cumbersome. The pH of the system determines the charge of the polymer, and the ratio between the two polymers controls the charge balance during the complexation process [75], which in turn affects the interaction between the polymers, as well as the quality and yield of the microcapsules.
À un pH où les deux molécules de matériau de paroi portent la charge opposée équivalente maximale, l’interaction entre les deux molécules de matériau de paroi est la plus forte, les plus complexes sont formés, et le rendement de microcapsules est également le plus élevé [76-77]. Dans Mohammadian et al. [78], la turbidité du système était plus élevée à pH = 3, ce qui indique la formation d’un grand nombre de nanofibres de protéine de lactosérum et de complexes de gomme arabique, tandis qu’à un pH plus élevé (plus près du point isoélectrique de la protéine de lactosérum), la turbidité du système était beaucoup plus faible qu’à pH = 3. Un déséquilibre des charges électriques entraînera de faibles interactions électrostatiques entre les molécules des deux matériaux de paroi et un rendement d’agglomération plus faible. Dans l’étude de Kavousi et al. [79], lorsque le rapport entre le mucilage de semences de ress (CSM) et le caséinate de sodium a été ramené à 1:2, le nombre de charges négatives transportées par le CSM était le même que le nombre de charges positives transportées par le caséinate de sodium, et la turbidité du système était la plus élevée.
2.1.3 méthode d’encapsulation moléculaire
La méthode d’encapsulation moléculaire, également connue sous le nom de méthode d’encapsulation moléculaire ou la méthode d’encapsulation moléculaire, est une méthode de microencapsulation qui se produit au niveau moléculaire. Cette méthode utilise principalement les forces intermoléculaires entre le matériau du noyau et le matériau de la paroi pour former des microcapsules moléculaires. Cette méthode utilise habituellement des cyclodextrines et leurs dérivés comme matériau de paroi. Le processus d’encapsulation est un processus physique [83] sans réaction chimique, qui permet de conserver les propriétés et les fonctions originales de la substance active. Il existe trois méthodes principales pour préparer des complexes de curcumine-cyclodextrine: (1) la méthode de la solution aqueuse saturée, dans laquelle une solution aqueuse de cyclodextrine est mélangée à une solution de solvant organique de curcumine, et le solvant est évaporé et le mélange est séché pour obtenir les microcapsules; 2) la méthode de broyage, dans laquelle la curcumine est ajoutée à une solution de broyage de cyclodextrine et ensuite broyée, et la curcumine déplace l’eau dans la cavité de la cyclodextrine, puis le mélange est séché pour obtenir les microcapsules; (3) le procédé de coprécipitation, dans lequel une solution aqueuse de cyclodextrine est mélangée à une solution de réactif organique de curcumine, la température du liquide est augmentée et le liquide est agité vigoureusement pour saturer le mélange, puis abaisser la température du liquide pour provoquer la cristallisation et la précipitation des complexes de cyclodextrin-curcumine.
Le précipité est filtré, recueilli et séché pour obtenir des microcapsules de curcumine. CN106943604A utilise de l’eau comme solvant pour mélanger des polymères de cyclodextrine avec de la curcumine, puis dessèche sous vide pour obtenir des microcapsules de curcumine avec une bonne solubilité dans l’eau [84]. Purpura et al. [85] ont utilisé la γ-cyclodextrine pour encapsuler les curcuminoïdes et ont étudié les concentrations des trois curcuminoïdes dans le plasma sanguin après administration orale avant et après encapsulation. Les résultats ont montré que l’encapsulation de γ-cyclodextrine peut augmenter significativement la concentration de curcuminoïdes dans le plasma sanguin, c.-à-d., améliorer le corps et#39; S absorption des curcuminoïdes. Zhang et al. [86] ont utilisé la β-cyclodextrine comme matériau de paroi et ont préparé des complexes de curcumine-cyclodextrine par une méthode de solution aqueuse saturée. Par rapport à la curcumine libre, la curcumine dans le complexe est plus facilement prise par les cellules et a un meilleur effet thérapeutique sur le cancer du poumon.
2.1.4 autres méthodes de préparation
En plus des trois méthodes de préparation couramment utilisées mentionnées ci-dessus, l’encapsulation-électropayante des liposomes, la méthode des pores tranchants, et la méthode de précipitation isoélectrique sont également utilisés pour préparer des microcapsules de curcumine. Liu Xin et al. [87] [traduction] ont utilisé du chitosan comme matériau de paroi et ont préparé des microcapsules de curcumine selon la méthode des pores tranchants. Les microcapsules résultantes étaient de taille uniforme, avec un taux d’encapsulation de 60% et une charge de médicament de 0,75 %. Cependant, la taille des particules était importante et se concentrait autour de 0,45 mm. La méthode des pores tranchants est lente et impropre à la production industrielle, et son utilisation dans la préparation de microcapsules de curcumine a fait l’objet de peu de recherches. Ariyarathna et al. [88] [traduction] ont utilisé la protéine de pois chiche comme matériau de paroi pour préparer des microcapsules de curcumine selon le principe de précipitation isoélectrique, avec un taux d’encapsulation de 78,6 % et une capacité de charge de 9,2 %. Cela a considérablement amélioré la stabilité lumineuse et thermique de la curcumine, cependant, la méthode a limité le choix de matériaux de paroi. Laura et al. [89] ont utilisé l’électropulvérisation pour encapsuler les liposomes de curcumine dans la protéine de lactosérum. Dans les mêmes conditions, le taux de rétention de curcumine des liposomes de curcumine était d’environ 80% à 25 h, tandis que le taux de rétention des microcapsules électropulvérisées était d’environ 90% à 25 h, ce qui montre que la double encapsulation donne aux curcuminoïdes une protection plus forte.
2.2 matériaux de paroi principale pour la microencapsulation des curcuminoïdes de curcuma
Le matériau de paroi est le composant le plus important de la microcapsule, en dehors du matériau de noyau, et il affecte les propriétés physiques et chimiques de la microcapsule dans une certaine mesure, telles que la forme apparente, la teneur en humidité, le rendement du produit, la solubilité, la perméabilité et l’effet de libération soutenue. Par conséquent, il est particulièrement important de choisir le matériau de paroi approprié en fonction des différents matériaux de noyau et des méthodes de préparation.
2.2.1 les protéines
Les protéines sont un type de polymère macromoléculaire naturel dans les aliments, avec d’excellentes propriétés émulsifiantes et gélifiantes. À l’heure actuelle, les matériaux de paroi communs à base de protéines utilisés dans la préparation de microcapsules de curcumine comprennentIsolat de protéines de soja, protéine de lactosérum, et zein.
2.2.1.1 protéines de lactosérum
Whey protein is the main component of whey, which is obtained by concentrating and refining whey, a by-product of cheese production. The main components are β-lactoglobulin, α-lactalbumin, immunoglobulins, and bovine serum albumin. Whey protein (WP) is mainly divided into two categories: whey protein concentrate (WPC) and whey protein isolate (WPI). It has excellent film-forming, emulsifying and gelling properties, and is often used as a carrier material for bioactive substances. Jayaprakasha et al. [73] used whey protein as the wall material and prepared turmeric curcumin microcapsules by freeze drying, with an encapsulation rate of 96.34%. After nano-encapsulation, WP-Cur can maintain a micelle structure under neutral conditions, with a turmeric curcumin release of 599.49% at 24 hours and greater than 70% at 48 hours.
L’absorption de curcumine par les cellules a augmenté, et l’activité anticancéreuse contre les cellules cancéreuses (cellules cancéreuses du côlon SW480, cellules cancéreuses dela prostate LNCap) a augmenté, c.-à-d. la nano-encapsulation dela protéine de lactosérum a réduit le métabolisme dela curcumine par libération retardée eta augmenté la biodisponibilité dela curcumine. La protéine de lactosérum peut s’auto-assembler à pH acide (pH 2) et à faible force ionique, et chauffer pendant plusieurs heures au-dessus de la température de déaturation pour former des agrégats fibreux d’un diamètre d’environ 1 à 10 nm et d’une longueur de microns. Par rapport à la protéine de lactosérum non fibreuse, les nanofibrilles de protéine de lactosérum (WPN) WPN) ont une plus grande activité de récupération des radicaux et de meilleures propriétés émulsionnantes à de faibles concentrations que la protéine de lactosérum non fibrillaire. Les WPN ° de catalogueont une hydrophobicité de surface plus élevée et sont plus susceptibles de former des complexes solubles avec la curcumine par liaison d’hydrogène et interactions hydrophobes. Par rapport à la curcumine libre, la solubilité de la curcumine dans WPI-Cur est augmentée d’environ 180 fois, et la solubilité de la curcumine dans WPN-Cur est augmentée d’environ 1200 fois. En outre, la combinaison de curcumine et de WPN augmente encore la viscosité apparente et l’activité de surface du WPN. Par conséquent, le Cur-WPN peut être un choix idéal pour concevoir de nouvelles émulsions et boissons alimentaires fonctionnelles [90]. Hu et al. ont également obtenu des résultats de recherche semblables [91].
2.2.1.2 protéine soluble dans l’alcool de Zea mays
La zéine est composée d’environ 75% de résidus d’acides aminés hydrophobes et 25% de résidus d’acides aminés hydrophiles. Il est amphiphile et une sorte de protéine végétale qui est soluble dans l’alcool et insoluble dans l’eau. Sous induction externe, zein peut s’auto-assembler en nanoparticules, encapsulant des substances actives hydrophobes à l’intérieur pour former une structure noyau coquille. Cependant, les microcapsules préparées à partir de Zein seul sont sujettes à l’agrégation et à l’éclatement, conduisant à la libération de la substance active. Par conséquent, Zein est habituellement combiné avec des matériaux de paroi polysaccharidique comme matériau porteur. Par exemple, Li [80] a utilisé du Zein et du Chitosan (CS) comme matériaux de paroi pour fournir de la curcumine. Il a été constaté que plus le pH du système est élevé, plus l’interaction entre la zeine et le CS est forte, plus le rendement du produit est élevé et plus le taux de libération in vitro de curcumine est faible. Compte tenu de tous les facteurs, Zein-CS-Cur a un meilleur potentiel d’administration orale à pH = 4. Dans Ran et al. [92], la demi-vie t1/2 de la curcumine dans des conditions d’irradiation lumineuse dans la zéin-hydroxypropylméthylcellulose-cur a été augmentée, et le taux de récupération des radicaux DPPH a augmenté, de 19,56 % à 68,25 %. Ces dernières années, les produits de la réaction de Maillard ont également été largement utilisés pour encapsuler des substances bioactives. Dong Xiao et al. [93] [traduction] ont utilisé de la zeine et du glucose (Glu) dans une solution d’éthanol à 70% du produit de la réaction de Maillard (Zein/Glu MRP) pour préparer des nanocapsules de curcumine. Comparé à Zein, les nanocapsules de curcumine préparés par Zein/Glu MRP Pont eu une augmentation de 22 fois de l’efficacité de piège, et la stabilité thermique et la stabilité de stockage ont été considérablement améliorées.
2.2.1.3 autres matériaux de paroi à base de protéines
In addition to the above-mentioned proteins, soy protein isolate, coconut protein isolate, Protéine de pois, egg white protein, gelatin, etc. have also been used to prepare curcumin microcapsules. For example, Mon - sunet al. [94] [en] used soy protein isolate (SPI) as a wall material to prepare curcumin microcapsules by spray drying. After spray drying, the retention rate of curcumin was 89.1%, and the loading capacity was 25.3 mg/g. Scanning electron microscopy images showed that the surface of the microcapsules had large, regular indentations. After adding soy polysaccharides and/or maltodextrin to the wall material, the retention rate, loading and solubility of curcumin were significantly improved. The microcapsule membrane protected curcumin to reduce degradation during spray drying, and SEM images showed that the surface of the microcapsules had fewer dents and folds and was smoother. Adsare et al. [95] used coconut clear protein to encapsulate curcumin, and the encapsulation rate of the spray-dried microcapsules was (84.89±1.09)%. the curcumin loading was 509.26 mg/100 g. When 5%, 10%, and 15% gum arabic was added to the wall material, the encapsulation rate and loading gradually increased. This may be due to the fact that gum arabic occupies the voids in the coconut clear protein wall material matrix, reducing oxygen permeability.
2.2.2 glucides
2.2.2.1 gomme arabique
La gomme arabique (GA) est un mélange de polysaccharides et de glycoprotéines. Il est non toxique, hautement soluble, a une activité de surface, est stable sur une large gamme de pH et a une viscosité relativement faible. Il est largement utilisé dans les industries alimentaires, cosmétiques et pharmaceutiques. Andreea et al. [96] ont utilisé trois concentrations différentes (10%, 15% et 20% p /v) d’ag pour encapsuler la curcumine. Le diamètre des microcapsules était de 7 à 9 μm. Avec une augmentation de la proportion d’ag, la libération de curcumine à partir des microcapsules dans le liquide gastro-intestinal simulé a diminué et le taux de libération a ralenti au cours des premières minutes. Dans une certaine plage, l’augmentation du rapport coquille/noyau augmentera le taux d’encapsulation et la capacité de chargement des microcapsules. Cependant, une concentration élevée d’ag entraîne une visqueuse du liquide d’alimentation, ce qui n’est pas propice au séchage par pulvérisation [70]. Peut être amélioré en mélangeant GA avec d’autres matériaux de paroi, ce qui n’aura pas un effet significatif sur la viscosité du liquide d’alimentation tout en améliorant l’efficacité d’encapsulation [97-98]. Par exemple, Meena et al. [66] ont combiné l’ag à la maltodextrine et au WPC-80 pour encapsuler la curcumine, et le taux d’encapsulation des microcapsules atteignant 97,16 %, et la teneur en curcumine était de 422,28 mg/kg. Après une digestion gastrique simulée, environ 88% de la curcumine a été retenue dans les microcapsules. Tan Shaocong et al. [99] ont utilisé de l’ag et du zein comme matériaux de paroi pour préparer des microcapsules de curcumine par lyophilisation, et le taux de piégeage des microcapsules était de 95,844%, avec une capacité de charge de 62 mg/g.

2.2.2.2 dextrine
La dextrine est un matériau intermédiaire de petite molécule qui est converti à partir de macromolécules d’amidon par la décomposition et l’hydrolyse sous l’action de la chaleur, de l’acide ou des enzymes. Parmi eux, la maltodextrine, la cyclodextrine et leurs dérivés sont couramment utilisés comme matériaux de paroi pour les microcapsules.
La maltodextrine (MD) est un polymère de sucre préparé à partir de l’amidon ou de l’amylum comme matière première par hydrolyse enzymatique à faible degré, purification et séchage ou non séchage [100]. Le degré d’hydrolyse est généralement exprimé par la valeur DE (équivalent glucose). La valeur DE DE est le pourcentage DE sucres directement réducteurs (exprimé en glucose) dans le total des solides DE l’hydrolysat d’amidon. Les MDs avec des valeurs DE DE différentes ont des distributions DE poids moléculaire, des longueurs DE chaîne moyennes et des degrés DE ramification différents, ce qui entraîne des propriétés fonctionnelles différentes, telles que la viscosité et l’hygroscopicité. La dépréciation appropriée DE MD Ddoit être choisie en fonction des caractéristiques du matériau du noyau et DE la méthode DE préparation. MD a les caractéristiques de faible viscosité, faible hygroscopicité, haute solubilité et faible coût lorsqu’il est utilisé en concentrations élevées [101-102]. Dans l’étude de la microencapsulation de la curcumine, en raison de la faible capacité d’émulsion et de la faible stabilité de l’émulsion du MD, le taux d’encapsulation et la quantité de charge des microcapsules préparées avec le MD seul comme matériau de paroi sont faibles [103-104]. Par conséquent, le MD est généralement composé de matériaux de paroi ayant d’excellentes propriétés émulsionnantes (voir tableau 2), comme la gomme arabique, la protéine de lactosérum, la gélatine, etc.
Cyclodextrin (CD) is a series of cyclic oligosaccharides produced by the action of cyclodextrin glucanotransferase on straight-chain starch. It has a conical cavity with a ring shape (see Figure 5) [85]. The shielding effect of the primary hydroxyl groups on the outer surface of the cavity and the C-H bonds inside the cavity results in a structure with the characteristics of “hydrophobic inside cavity and hydrophilic outer wall”. Therefore, it can be used to embed some object molecules of appropriate size and shape in the cyclic structure through electrostatic interactions, van der Waals forces, hydrophobic interactions, hydrogen bonding, etc., to form microcapsules [108]. Cyclodextrins are non-toxic, inexpensive and widely available, making them ideal for use as carriers for active ingredients. Cyclodextrins commonly used to encapsulate curcumin are β-CD and γ-CD. Related research is shown in Table 3. Compared to pure curcumin, cyclodextrin encapsulation significantly improves curcumin solubility, stability and antioxidant activity (possibly due to the improved solubility of curcumin, which in turn increases the concentration of curcumin in the system). However, the microencapsulation rate is relatively low, and the solubility of β-CD in water is poor, at 1.85 mg/mL [109], which is not conducive to its good application in the field of carrier materials. At present, some studies have introduced chemical groups to cyclodextrins to obtain modified cyclodextrins, thereby improving their solubility and encapsulation properties. After modification, the encapsulation rate of curcumin by cyclodextrin was significantly improved, and the stability of the Cur-CD complex was also improved, and the dissolution and stability of curcumin in the complex were further improved [108, 110-111].
2.2.2.3 amidon modifié
L’amidon est l’un des glucides les plus abondants dans la nature et est également le principal nutriment qui fournit de l’énergie au corps humain. C’est une source sûre, non toxique, biocompatible, peu coûteuse et abondante de nutriments. L’amidon naturel a la mauvaise solubilité, et l’employer directement comme matériau de paroi de microcapsule n’est pas très efficace. Le taux d’encapsulation et la capacité de chargement des microcapsules sont relativement faibles. Par conséquent, dans l’application de matériaux de paroi de microcapsule, les propriétés naturelles de l’amidon sont souvent modifiées par des traitements physiques, chimiques ou enzymatiques pour augmenter certaines fonctions ou introduire de nouvelles propriétés, afin d’améliorer sa solubilité, l’absorption d’eau et la capacité d’encapsulation, et en faire un bon matériau de paroi de microcapsule. Le tableau 4 présente les recherches pertinentes sur la préparation de microcapsules de curcumine utilisant de l’amidon modifié comme matériau de paroi. Comparé à l’amidon naturel, l’amidon modifié peut considérablement améliorer le taux d’encapsulation et la capacité de chargement des microcapsules, aussi bien que la solubilité, la stabilité et la biodisponibilité de la curcumine, améliorant l’effet de libération contrôlée de la curcumine des microcapsules. Bien que les microcapsules préparées avec de l’amidon modifié soient de meilleure qualité que celles préparées avec de l’amidon naturel, il y a eu relativement peu d’études pour déterminer si les microcapsules modifiées d’amidon et de curcumine ont des effets néfastes sur la santé humaine [115-121]. Cependant, dans le système d’administration des substances actives, la toxicité de la matrice porteuse est une question importante qui nécessite des recherches plus poussées.
3 Applications
GB 2760—2014 [122] [traduction] stipulates that curcumin, as a natural edible pigment, can be used in frozen drinks, cooked nuts and seeds, chocolate products, candy, instant rice and noodle products, fillings for grain products, flavored syrups, compound seasonings, carbonated drinks, jelly and puffed foods. At present, some scholars have also added curcumin microcapsules to yogurt, cheese and milk and evaluated their suitability. Patelet al. [123] [en] prepared curcumin microcapsules using WPI and Hi-Cap 100 as wall materials, and added WPI, Hi-Cap 100, a physical mixture of curcumin and microcapsules to milk, respectively. the milk with the physical mixture had obvious particle sedimentation and a lower sensory evaluation score, while the addition of curcumin microcapsules had no adverse effect on the sensory characteristics of the milk. Vanessa et al. [124] used β-CD to encapsulate curcumin and added β-CD-Cur to cheese (β-CD-Cur added at 5 × 10-7 g/L) and yogurt (β-CD-Cur added at 2 × 10-6 g/g) to evaluate its suitability.
The experimental results showed that the addition of curcumin complexes had no significant effect on the hardness, adhesion, elasticity, etc. of cheese and yogurt, but reduced the brightness of the two products, with the cheese turning yellow and the yogurt turning slightly yellowish-green. In addition, the sensory evaluation showed that the cheese with added β-CD-Cur was better accepted. Microencapsulation technology has broadened the scope of application of curcumin, making it suitable for use in some water-based foods. For example, functional dairy products or beverages. In addition, based on the superior bioactive function of curcumin, curcumin microcapsules can also be combined with other nutrients to make capsule or tablet-type functional supplements, or added to daily chemical products that focus on anti-inflammatory effects. It can be seen that curcumin and its microcapsules have broad development prospects in the fields of food health, medicine and daily chemical products.

4 Conclusion et perspectives
La curcumine est un métabolite secondaire de la plante de gingembre Curcuma longa. Il est connu comme «or liquide» et a une variété d’activités biologiques, telles que l’anti-oxydation, l’anti-inflammation, et l’anti-tumeur. Par conséquent, il existe un grand potentiel pour le développement d’aliments fonctionnels à base de curcumine. Cependant, ses propriétés physico-chimiques instables, sa faible solubilité et son métabolisme rapide limitent son application. Une technologie est nécessaire de toute urgence pour résoudre ce problème. Par conséquent, cet article commence par les propriétés structurelles, l’activité biologique et les caractéristiques métaboliques de la curcumine, et résume les techniques courantes d’encastrement et les types de matériaux de paroi utilisés pour préparer les microcapsules de curcumine au cours des dernières années.
Un grand nombre d’études ont montré que microencapsulation technology can significantly improve the solubility of curcumin, enhance its stability to light, heat, oxygen and pH, and also have a sustained-release effect on curcumin in simulated gastrointestinal fluids. Among them, spray drying is a traditional method of microcapsule preparation that is relatively mature and is very suitable for the large-scale industrial production of curcumin microcapsules. There have been many studies on curcumin microcapsules, but there are still some problems in the current research: (1) Whether the microcapsules can still ensure the stability and bioavailability of curcumin in the food matrix and whether it will affect the original flavor of the food.
Il y a encore très peu de recherches dans ce domaine et il faut l’approfondir. (2) bien que les matériaux de paroi naturels aient l’avantage d’être biocompatibles, leurs propriétés sont instables. Par conséquent, plus de matériaux de paroi modifiés ont été appliqués dans la préparation de microcapsules de curcumine. Cependant, dans la recherche sur les microcapsules de curcumine, il est rarement mentionné si les matériaux de paroi modifiés ont des effets néfastes sur la santé humaine. Par conséquent, la recherche sur la toxicité de la matrice porteuse doit être améliorée. (3) la capacité de chargement des microcapsules de curcumine est faible, et la technologie de production industrielle pour les microcapsules de curcumine à chargement élevé n’est pas encore mûre en Chine. Avec l’innovation de la technologie de microencapsulation, on pense que ces problèmes peuvent être résolus à l’avenir.
Référence:
[1]Guo S P,Chang H C,Lu L S,et al. L’activation de la voie de l’élément de réponse antioxydante de la protéine 1/ facteur nucléaire érythroïde 2/ facteur érythroïde associé à kelch par la curcumine augmente la capacité anti-oxydative des cellules endothéliales cornéennes [J]. Biomédecine &; Pharmacotherapy = biomédecine &Pharmacotherapie,2021,141 :111834.
[2]Rai A,Kaur M,Gombra V,et al. Curcumine et antioxydants dans la gestion du submuqueux oral Fibrose [J]. Journal of investigation and Clinical Dentistry, 2019,10(4):e12464.
[3] Zheng Q QT,Yang Z ZH,Yu L Y,et al. synthèse Et activité antioxydante des analogues de curcumine [J]. Journal of Asian Natural Products Research,2017,19(5):489-503.
[4]Momeni H R,Eskandari N. effet de la curcumine sur les reins Modifications histopathologiques, peroxydation lipidique Et total Capacité antioxydante du sérum chez les souris traitées à l’arsenite de sodium [J]. Experimental and Toxicologic Pathology,2017,69(2): 93-97.
[5]Wang Y,Wang Y J,Cai N,et al. Effets anti-inflammatoires de Curcumine dans les lésions pulmonaires aiguës: expériences in vivo et in vitro Études de modèles [J]. International Immunopharmacology,2021, 96 :107600.
[6]Wang Q R,Ye C Q,Sun S K,et al. Curcumine atténuer L’arthrite du rat induite par le collagène via des anti-inflammatoires et Effets apoptotiques [J]. International Immunopharmacology, 2019,72:292-300.
[7] Shimizu K,Funamoto M,Sunagawa Y,et Al. Action anti-inflammatoire de la curcumine et son utilisation dans le traitement de maladies liées au mode de vie [J]. European Cardiology,2019,14 (2):117-122.
[8]Ebrahimzadeh A,Abbasi F,Ebrahimzadeh A,et al. Effets de la supplémentation en curcumine sur les biomarqueurs inflammatoires chez les patients atteints de polyarthrite rhumatoïde et de colite ulcéreuse: revue systématique et méta-analyse [J]. Thérapies complémentaires en médecine,2021,61 :102773.
[9]Nguyen-Ngo C,Willcox J C, Lappas M. Effets anti-inflammatoires des acides phénoliques punicalagine et curcumie dans le placenta humain et le tissu adipeux [J]. Placenta,2020,100 :1-12.
[10] Li Y P,Sun W X,Han N,et al. Curcumin Inhibe la prolifération, la migration, l’invasion et favorise l’apoptose des lignées cellulaires du rétinoblastome par la modulation de la voie miR-99a et JAK/STAT [J]. BMC Cancer,2018,18(1):1230.
[11]Wang Z X,Liu F,Liao W L,et al. Curcumine supprimez la prolifération cellulaire du glioblastome par la voie p-AKT/mTOR et augmente l’expression PTEN [J]. Archives de biochimie et biophysique,2020,689(prépublication):108412.
[12]Fan X,Zhu M,Qiu F,et al. La curcumine pourrait être un médicament adjuvant potentiel pour le traitement du cancer du côlon en ciblant CD44 [J]. International Immunopharmacology,2020,88 :106991.
[13]Elbadawy M,Hayashi K,Ayame H,et al. Activité anticanceuse de la préparation de curcumine amorphes dans des organoïdes de cancer colorectal dérivés du patient [J]. Biomédecine &; Pharmacotherapy,2021,142 :112043.
[14]Liu Q,Loo W TY,Sze S C W,et al. Curcuma inhibe la prolifération cellulaire des cellules de cancer du sein MDA-MB-231 et BT-483 médiée par la régulation de la transcription NFkappaB,cyclinD et MMP-1 [J]. Phytomedicine :International Journal of Phytotherapy and Phytopharmacology,2009,16 (10):916-922.
[15]Zhang P L,Zuo Z G,Wu A H,et al. miR-600 inhibe la prolifération cellulaire, la migration et l’invasion en ciblant p53 dans les lignées cellulaires mutantes du cancer colorectal humain exprimant p53 [J]. Oncology Letters,2017,13(3):1789-1796.
[16]Dubey R. Microencapsulation technology and applications [J]. Defence Science Journal,2009,59 :82-95.
[17]Ghosh S,Banerjee S, Sil P C. le rôle bénéfique de la curcumine Sur l’inflammation, le diabète et les maladies neurodégénératives :A Mise à jour récente [J]. Food and Chemical Toxicology,2015,83:111-124.
[18] Prasad L,Gupta S C,Tyagi A K,et al. Curcumine, un composant de golden spice :From bedside to bench and back [J]. Biotechnology Advances,2014,32(6):1053-1064.
[19] Priyadarsini K I. La vie. Photophysique, photochimie Et photobiologie de la curcumine: études à partir de solutions organiques, bio-mimétiques et cellules vivantes [J]. Journal de photochimie Et photobiologie C: revue de photochimie,2009,10 (2):81-95.
[20] Tønne sen H D,Karl sen J. : J. : J. : Études de cas on curcumin Et curcuminoïdes [J]. Zeitschrift
[21]Zhang L,Zhu W W,Yang C F,et al. Un nouveau système de délivrance de médicaments auto-microémulsionnant modifié en folate pour le ciblage du côlon [J]. International Journal of nanomédecine,2012,7 :151-162.
[22]Vuki Evi i M,Tønnesen H H. Interaction entre la curcumine et l’albumine sérique humaine en présence d’excipients et effet de la liaison sur la photostabilité de la curcumine [J]. Pharmaceutical Development and Technology,2016,21 (4):428-436.
[23] Suvarna S,Dsouza J,Ragavan M L,et al. Potentiel Caractérisation probiotique et effet de l’encapsulation de Les souches de levure probiotiques sur la survie dans des systèmes digestifs simulés État des voies [J]. Food Science and Biotechnology,2018, 27(3):745-753.
[24]Tønnesen H H,Karlsen J,van Henegouwen G B. études sur la curcumine et curcuminoïdes VIII. Stabilité photochimique de la curcumine [J]. Zeitschrift
[25]del Castillo, M L R, de pez-tobar, E, sánchez-cortés, et al. Stabilisation de la curcumine contre la photodégradation par encapsulation in gamma-cyclodextrin :A study based on Données chromatographiques et spectroscopiques (Raman et UV-visible) [J]. Vibrational Spectroscopy,2015,81 :106-111.
[26]Wang Y J,Pan M H,Cheng A L,et al. Stabilité de la curcumine dans les solutions tampons et caractérisation de ses produits de dégradation [J]. Journal of Pharmaceutical and Biomedical Analysis,1997,15(12):1867-1876.
[27]Tønnesen H H,
[28]
[29] Dinkova-Kostova A T,Talalay P. 1 et 2.propriétés antioxydantes directes et indirectes des inducteurs de protéines cytoprotectrices [J]. Nutrition moléculaire & Food Research,2008,52(Suppl 1):S128-S138.
[30] Barclay L R,Vinqvist M R,Mukai K,et al. Sur le mécanisme antioxydant de la curcumine: des méthodes classiques sont nécessaires pour déterminer le mécanisme antioxydant et l’activité [J]. Organic Letters,2000,2(18):2841-2843.
[31] Sun Y M,Zhang H Y,Chen D Z,et Al. Élucidation théorique sur le mécanisme antioxydant de la curcumine: une étude DFT [J]. Organic Letters,2002,4(17):2909-2911.
[32]Priyadarsini K I,Maity D K,Naik G H,et al. Rôle du phénolique O-H et de l’hydrogène de méthylène sur les réactions des radicaux libres et l’activité antioxydante de la curcumine [J]. Free Radical Biology and Medicine,2003,35(5):475-484.
[33]Jovanovic S V,Steenken S,Boone C W,et al. H-atom Le transfert est un mécanisme antioxydant préféré de la curcumine [J]. Journal of Les américainsChemical Society,1999,121(41): 9677-9681.
[34]Deng S L,Chen W F,Zhou B,et al. Effets protecteurs de la curcumine et de ses analogues contre l’hémolyse oxydative induite par les radicaux libres des globules rouges humains [J]. Food Chemistry,2006,98(1):112-119.
[35] Sun Yiyang, Peng Ziyi, Zhao Yuxin et al. Progrès de la recherche sur l’effet anti-inflammatoire de la curcumine dans le traitement de la maladie [J]. China Medical Innovation, 2021, 18(27): 181-184.
[36] Zhang B, Ye L. progrès de la recherche sur le mécanisme anticancéreux de la curcumine [J]. Journal of Traditional Chinese Medicine, 2013, 41(1): 121-123.
[37] Ren J Y, Gou N, Gao L, et al. Effet de la curcumine sur Helicobacter pylori et ses dommages aux cellules gastriques GES-1 humaines [J]. Food Science, 2019, 40 (23): 151-156.
[38] Xu Chuanjun, Ming Yanlin, Chen Lianghua, et autres. Progrès de la recherche sur le rôle et le mécanisme de la curcumine dans le diabète de type 2 et ses complications chroniques [J]. Anhui Agricultural Science, 2021, 49 (6): 30-34, 38.
[39]Kuroda M,Mimaki Y,Nishiyama T,et al. Effets hypoglycémiques du Curcuma (Curcuma longa L. rhizomes) sur des souris KK-Ay génétiquement diabétiques [J]. Biologique & Bulletin pharmaceutique,2005,28(5):937-939.
[40] Holder G M,Plummer J L,Ryan A J. le métabolisme et l’excrétion de la curcumine (1,7-bis -(4-hydroxy-3 - méthoxyphényl) -1,6-heptadiène-3,5-dione) chez le rat [J]. Xenobiotica,1978,8(12):761-768.
[41] Pandey A,Chaturvedi M,Mishra S,et al. Métabolites réducteurs de la curcumine et leurs effets thérapeutiques [J]. Heliyon,2020,6(11):e05469.
[42]Liu W D,Zhai Y J,Heng X Y,et al. Biodisponibilité orale de la curcumine: problèmes et progrès [J]. Journal of Drug Targeting,2016,24(8):694-702.
[43]Wang K,Qiu F. le métabolisme curcuminoïde et sa contribution Aux effets pharmacologiques [J]. Current Drug Metabolism, 2013,14(7):791-806.
[44] Shi M G,Gao T T,Zhang T,et al. Caractérisation des métabolites de curcumine chez les rats par chromatographie liquide à ultra-haute performance avec ionisation par électropulvérisation quadrupolaire à temps de vol spectrométrie [J]. Communications rapides en spectrométrie de masse :RCM,2019,33 (13):1114-1121.
[45]Vareed S K,Kakarala M,Ruffin M T,et al. Pharmacocinétique Des metabolites conjugués de curcumine chez des sujets humains sains [J]. Épidémiologie du Cancer, biomarqueurs & Prévention :A Publication de l’american Association for Cancer Research, coparrainée par the American La société De prévention Oncology,2008,17(6):1411-1417.
[46] He Yongjian, Huang Shaowen, Liu Ruijing, et al. Effet d’intervention du jus de néflier sur le métabolisme du di(2-éthylhexyl) phtalate à base de la voie de détoxification de l’acide uridine diphosphate glucuronique transférase 1 [J]. Food Science, 2017, 38(23): 196-200.
[47] Hoehle S I,Pfeiffer E,Metzler M. Glucuronidation des curcuminoïdes par des microsomaux humains et des UDP- glucuronosyltransférases recombinantes [J]. Nutrition moléculaire & Food Research,2007,51(8):932-938.
[48] Strassburg C P,Nguyen N,Manns M P,et al. UDP- glucuronosyltransférase activité dans le foie humain et le côlon [J]. Gastroenterology,1999,116(1):149-160.
[49] Tu clé R H, St ra ssbu r g C P. 1 et 2. Hum a n UDP - glucuronosyltransférases: métabolisme,expression, et Maladie [J]. Annual Review of Pharmacology and Toxicology, 2000,40 :581-616.
[50]Mueller J W,Idkowiak J,Gesteira T F,et al. La sulfatation humaine de DHEA nécessite une interaction directe entre PAPS synthase 2 et DHEA sulfotransferase SULT2A1 [J]. Journal of Biological Chemistry,2018,293(25):9724-9735.
[51] Lu X Y,Jiang K Y,Han L,et al. Sulfonation of Curcuminoïdes: caractérisation et contribution de l’individu SULT enzymes [J]. Nutrition moléculaire & Food Research, 2015,59(4):634-645.
[52]Burapan S,Kim M,Han J. déméthylation curcuminoïde as Un autre métabolisme par le microbiote intestinal humain [J]. Journal of Agricultural and Food Chemistry,2017,65(16): 3305-3310.
[53] Tan S,Calani L,Bresciani L,et al. La dégradation de Les curcuminoïdes dans un modèle de fermentation fécale humaine [J]. International Journal of Food Sciences and Nutrition,2015, 66(7):790-796.
[54]Niwa T,Yokoyama S I,Mochizuki M,et al. Curcumine metabolism by human intestinal bacteria in vitro [J]. Journal des aliments fonctionnels,2019,61 :103463.
[55]An C Y,Sun Z Z,Shen L,et al. Biotransformation of food spice curcumine by gut bacterium Bacillus megaterium DCMB- 002 and its pharmacological implications [J]. Nourriture &; Nutrition Research,2017,61(1):1412814.
[56]Zam W. Gut microbiota en tant que cible thérapeutique prospective pour la curcumine: un examen de l’influence mutuelle [J]. Journal de Nutrition et métabolisme,2018,2018 :1367984.
[57]Di Meo F,Margarucci S,Galderisi U,et al. Curcumin,gut microbiota,and neuroprotection [J]. Nutriments,2019,11(10):2426.
[58]Pluta R,Januszewski S,U amek-Kozio M. Interactions réciproques de la curcumine et du microbiote intestinal [J]. International Journal of Molecular Sciences,2020,21(3): 1055.
[59] Scazzocchio B,Minghetti L, d’archivio M. Interaction between Microbiote intestinal and Curcumine: une nouvelle clé of Comprendre les effets de la curcumine sur la santé [J]. Nutriments, 2020,12(9):2499.
[60] wahllcpe B,Blennow G. une étude sur le sort de la curcumine chez le rat [J]. Acta Pharmacologica et Toxicologica,1978,43(2):86-92.
[61] Pan M H,Huang T M,Lin J K. Biotransformation de la curcumine par réduction et glucuronidation chez la souris [J]. Drug Metabolism and Disposition :the Biological Fate of Chemicals,1999,27(4):486-494.
[62] corr
[63] Adachi L,Imaoka H,Ashida H,et al. La préparation of microcapsules De W/O/W Les émulsions Contenant: a Polysaccharide dans la phase aqueuse externe par séchage par pulvérisation [J]. European Journal of Lipid Science and Technology,2004, 106(4):225-231.
[64] Hu Zhihe, Zhao Yong, Xia Lei et autres. Effet de différentes méthodes de séchage sur l’activité du peptide inhibiteur de l’enzyme de conversion de l’angiotensine du lait [J]. Food Science, 2016, 37 (19): 204-210.
[65] Wu Kegang, Chai Xianghua. Étude sur les performances d’enrobage de matériaux de paroi de microcapsules séchées par pulvérisation d’huile AA monocellule [J]. Journal of Chemical Engineering of Universities, 2008 (5): 797-802.
[66] Meena S,Prasad W,Khamrui K,et al. Préparation de Microcapsules de curcumine séchées par pulvérisation à l’aide d’un mélange de lactosérum Protéine avec maltodextrine et gomme Arabica et son in vitro Évaluation de la digestibilité [J]. Food Bioscience,2021,41:100990.
[67]Zuanon LAC, C R Malacrida,Telis VRN. Effet des ultrasons sur la stabilité de l’oléorésine de curcuma microencapsulée dans des matrices de gélatine-collagène [J]. Journal of Food Process Engineering,2017,40(2):e12360.
[68] [traduction] Zheng Ju, Zhao Lei, Wang Kai, et al. Effet des conditions de séchage par pulvérisation sur le taux de survie des Lactobacillus dans la poudre de lait de litchi et les caractéristiques de la poudre [J]. Food Industry Science and Technology, 2017, 38 (9): 216-220, 227.
[69] Taki M,Tagami T,Fukushige K,et al. Fabricationde Particules nanocomposites utilisant un type de mélange à deux solutions Buse de pulvérisation pour une formulation de curcumine inhalée [J]. International Journal of Pharmaceutics,2016,511(1): 104-110.
[70]Nguyen V T,Huynh T M,Nguyen T N Q,et al. Amélioration the Stabilité de la curcumine synthétisée par Séchage par pulvérisation Microencapsulation avec de la lécithine de soja et de la gomme arabique [J]. Journal brésilien de génie chimique,2021,38(3): 563-572.
[71]Cano-Higuita D M,Malacrida C R,Telis V R N. stabilité de la curcumine microencapsulée par pulvérisation et lyophilisation dans des matrices binaires et ternaires de maltodextrine, de gomme arabique et d’amidon modifié [J]. Journal of Food Processing and Preservation,2015,39(6):2049-2060.
[72] de Andrade D F,Vukosavljevic B,Hoppe J B,et al.poudre redispersible séchée par pulvérisation contenant de la curcumine nanoencapsulée: le processus de séchage n’affecte pas la neuroprotection In vitro [J]. AAPS PharmSciTech,2019,20(7):283.
[73]Jayaprakasha G K,Chidambara Murthy K N,Patil B S. chimioprévention améliorée du cancer du côlon de la curcumine par nanoencapsulation avec la protéine de lactosérum [J]. European Journal of Pharmacology,2016,789:291-300.
[74]Kayitmazer A B. thermodynamique de la coacervation complexe [J]. Progrès dans la Science des colloïdes et des interfaces,2017,239:169-177.
[75] Pathak J,Priyadarshini E,Rawat K,et al. Complexe complexe coacervation in charge Biopolymères complémentaires: liaison électrostatique versus surface patch [J]. Progrès en matière de Colloïde et Interface Science,2017,250:40-53.
[76]Mattison K W,Dubin P L,Brittain I J. formation complexe Entre l’albumine sérique bovine et les polyélectrolytes forts: effet de la densité de charge polymère [J]. Le Journal de physique Chemistry B,1998,102(19):3830-3836.
[77]Williams PA,Phillips G O. Introduction aux hydrocolloïdes alimentaires [M]// manuel des hydrocolloïdes. Amsterdam :Elsevier, 2009 :1-22.
[78]Mohammadian M,Salami M,Alavi F,et al. Fabrication et caractérisation de coacervates complexes chargés de curcumine faits de nanofibrilles de gomme arabolique et de protéine de lactosérum [J]. Food Biophysics,2019,14(4):425-436.
[79] Kavousi H R,Fathi M,Goli S A H. nouvelles microparticules de mucilage et de caséinate de sodium pour l’encapsulation de la curcumine: une approche de libération contrôlée [J]. Transformation des aliments et des bioproduits,2018,110 :126-135.
[80]Li M F,Chen L,Xu M Z,et al. La formation de zein- chitosan complex Particules coacervées: relation to encapsulation and Propriétés de libération contrôlée [J]. Revue internationale des macromolécules biologiques,2018, 116 :1232-1239.
[81] Shahgholi an N,Rajabz a deh G. Les conditions de travail Fabrication Et caractérisation du coacervate albumine/gomme arabique chargé de curcumine [J]. Food Hydrocolloids,2016,59 :17-25.
[82]Xie H J,Xiang C Y,Li Y,et al. Fabrication de nanoparticules du complexe ovalbumine / κ-carraghénane en tant que nouveau support pour la livraison de curcumine [J]. Hydrocolloïdes alimentaires,2019,89 :111- 121.
[83] Chen Hongyan, Peng Zhongli, Xiao Dingshu. Comportement d’adsorption de β-cyclodextrine et cinnamaldéhyde. Journal of Guangzhou University: Natural Science Edition, 2012, 11(4): 31-36.
[84] Chen Jianping, Peng Wanyi, Qin Xiaoming et autres. L’invention concerne un procédé de préparation d’un complexe supramoléculaire de curcumine cyclodextrine: CN106943604A [P]. 2017.
[85]Purpura M,Lowery R P,Wilson J M,et al. Analyse de différentes formulations novatrices de curcumin pour améliorer la biodisponibilité orale relative chez les sujets humains [J]. European Journal of Nutrition,2018,57(3):929-938.
[86] Zhang L L, homme S L,Qiu H N,et al. Curcumine - cyclodextrine complexes ont augmenté les effets anticancéreux de Curcumine [J]. Environmental Toxicology and Pharmacology, 2016,48 :31-38.
[87] Liu Xin, Lang Kaikai, Qiu Juan, et al. Préparation de microcapsules de chitosan-curcumine par la méthode des pores tranchants [J]. Journal de l’université normale de Tangshan, 2017, 39(2): 15-19.
[88] Ariyarathna I R,Karunaratne D N. la Microencapsulation stabilise la curcumine pour une livraison efficace dans les applications alimentaires [J]. Emballage alimentaire et durée de conservation,2016,10 :79-86.
[89]
[90]Mohammadian M, Salami M,Momen S M, et al. Amélioration de la solubilité aqueuse de la curcumine à l’état acide par la complexation avec des nanofibrilles de protéine de lactosérum [J]. Hydrocolloïdes alimentaires,2019,87 :902-914.
[91]Hu Y,He C X,Jiang C J,et al. Complexation avec le lactosérum Fibrilles protéiques et chitosan: un véhicule potentiel pour la curcumine Avec la stabilité aqueuse améliorée de dispersion et augmentée Activité antioxydante [J]. Food Hydrocolloids,2020,104:105729.
[92] Meng R,Wu Z Z,Xie Q T,et al. La préparation and Caractérisation des nanoparticules de zein/ carboxyméthyl dextrine à Encapsuler la curcumine: stabilité physico-chimique, antioxydant Propriétés d’activité et de libération contrôlée [J]. Food Chemistry, 2021,340 :127893.
[93] Dong Xiao, Huang Guoqing, Xiao Junxia. Préparation de nanoparticules de curcumine par le produit de réaction de Maillard de zéine et de glucose [J]. Chinese Journal of Food Science, 2021, 21 (3): 118-127.
[94] Chen F F P,Liu L L,Tang C H. : Séchage par pulvérisation microencapsulation De curcumine nano Complexes avec Isolat de protéines de soja :Encapsulation, dispersion dans l’eau, bioaccessibilité et bioactivités de la curcumine [J]. La nourriture Hydrocolloids,2020,105 :105821.
[95]Adsare S R,Annapure U S. Microencapsulation de curcumine à l’aide de lactosérum de lait de coco et de gomme arabique [J]. Journal of Food Engineering,2021,298 :110502.
[96] Bucure S cu A,Blaga A C,Estevinho B N,et al. Microencapsulation de curcumine par une technique de séchage par pulvérisation Utilisation de la gomme arabique comme agent encapsulant et études de libération [J]. Food and Bioprocess Technology,2018,11(10): 1795-1806.
[97]Murrieta-Pazos I,Gaiani C,Galet L,et al. Food Powders: Surface and form characterization revisited [J]. Journal de l’alimentation Engineering,2012,112(1-2):1-21.
[98]Rafiee Z,Nejatian M,Daeihamed M,et al. Application de différents nanoporteurs pour l’encapsulation de la curcumine [J]. Critiques in Food Science and Nutrition,2019,59 (21):3468-3497.
[99] Tan Shaocong, Qiu Menghui, Huang Dejin et al. Préparation de nanoparticules de curcumine basée sur la technologie combinée de stabilisateur et de microencapsulation [J]. Food Research and Development, 2021, 42 (15): 112-118.
[100] Administration d’état pour la réglementation du marché, Administration de normalisation de la population et#39; S république de Chine. Sucre d’amidon — exigences de qualité — partie 6: maltodextrines: GB/T 20882.6-2021 [S]. Beijing: Chine Standards Press, 2021.
[101] Pereira K C,Ferreira D C M,Alvarenga G F,et al. Microencapsulage lilien. et al. Microencapsulage lilien. et al. Microencapsulage lilien. et al. Microencapsulage lilien. et al. Journal brésilien de technologie alimentaire,2018,21.
[102]Akhavan Mahdavi S,Jafari S M,Assadpoor E,et al. Optimisation de la Microencapsulation des anthocyanines naturelles avec la maltodextrine, la gomme arabique et la gélatine [J]. International Journal of Biological Macromolecules,2016,85 :379- 385.
[103]Aniesrani Delfiya D S,Thangavel K,Natarajan N,et al. Microencapsulation de l’oléorésine de curcuma par séchage par pulvérisation et études de libération in vitro de microcapsules [J]. Journal of Food Process Engineering,2015,38(1):37-48.
[104]Kshirsagar A C,Yenge V B,Sarkar A,et coll. Efficacité De pullulan en émulsification d’oléorésine de curcuma et de ses dérivés Microencapsulation ultérieure [J]. Food Chemistry,2009, 113(4):1139-1145.
[105] Patel S S,Pushpadass H A,Franklin M E E,et al. Micro encapsulation De cumul by spray Séchage: caractérisation et fortification du lait [J]. Journal de l’alimentation Science and Technology,2022,59(4):1326-1340.
[106] lcpe (1999) et al. Amélioration de la stabilité de l’extrait de curcuma huileux par microencapsulation au moyen de la technique de séchage par pulvérisation. [J]. Journal de Dispersion Science and Technology,2022,43(14):2240-2249.
[107]Ferreira S,Malacrida C R,Nicoletti V R. Influence des méthodes d’émulsification et des paramètres de séchage par pulvérisation sur la microencapsulation de l’oléorésine de curcuma [J]. Emirates Journal of Food and Agriculture,2019:491.
[108] Shityakov S,Salmas R E,Durdagi S,et al. Profils de solubilité, hydratation et désolation de la curcumine complexée avec la γ-cyclodextrine et l’hydroxypropyl-γ-cyclodextrine [J]. Journal of Molecular Structure,2017,1134 :91-98.
[109] Shinde V V,Jeong D,Jung S., S., S. supramoléculaire Aminocatalyse par complexe d’inclusion: amino-dopé β-cyclodextrine en tant que catalyseur supramoléculaire efficace pour la Synthèse de l’eau de chromeno pyrimido [1,2-b] indazoline [J]. Journal de chimie industrielle et d’ingénierie,2018, 68 :6-13.
[110]Hu Y,Qiu C,Julian McClements D,et al. Et des stimuli physiologiques [J]. Chimie alimentaire,2022,376:131869.
[111] Liu C H,Lee G W,Wu W C,et Al. Encapsulation Curcumine en nanoparticule d’éthylène diamine -β-cyclodextrine Améliore l’administration topique de cornée [J]. Colloïdes et Surfaces B, Biointerfaces,2020,186 :110726.
[112] Sharma D,Satapathy B K. Fabrication De manière optimale Nano-particules sans polymère contrôlées par électropulvérisation de Complexe d’inclusion de curcumine / β-cyclodextrine [J]. Les colloïdes Et Surfaces A: Aspects physico-chimiques et d’ingénierie, 2021,618 :126504.
[113] Lai D N,Zhou A R,Tan B K,et al. Préparation et effets bactéricides photodynamiques du complexe curcumine -β-cyclodextrine [J]. Food Chemistry,2021,361 :130117.
[114] Arya P,Raghav N. études in vitro du complexe d’inclusion de curcumine -β - cyclodextrine en tant que système à libération prolongée [J]. Journal de Structure moléculaire,2021,1228 :129774.
[115]Athira G K,Jyothi A N,Vishnu V R. nanoformulation d’amidon de manioc succinylé soluble dans l’eau avec une biodisponibilité accrue et un potentiel anticancéreux [J]. Amidon - st
[116] Miskeen Application d’amidon ou de fécule Nanoparticules comme matériaux hôtes pour l’encapsulation de la curcumine: effet de la modification de l’acide citrique [J]. Revue internationale de Macromolécules biologiques,2021,183 :1-11.
[117] Acevedo-Guevara L,Nieto-Suaza L, sánchez L T, et al. Développement de l’amidon de banane indigène et modifié Les nanoparticules comme véhicules pour la curcumine [J]. International Journal des macromolécules biologiques,2018,111 :498- 504.
[118] sánchez L T,Arbelaez L M,Villa C C. comparaison de la cinétique de libération de molécules bioactives de nanoparticules d’amidon indigènes et modifiées dans des simulants alimentaires et gastriques [J]. Amidon - st
[119]Li J L,Shin G H,Lee I W,et al. L’amidon Soluble formulé nanocomposite augmente la solubilité dans l’eau et la stabilité de la curcumine [J]. Food Hydrocolloids,2016,56:41-49.
[120] mon D T T,Lan P N T,Van H P. Comparaison des données in Morphologie,structure et fonctionnalité de curcumin-loaded Nanoparticules d’amidon fabriquées à partir de courtes, moyennes et longues Amidons de manioc déramifiés longueur chaîne [J]. International Journal des sciences de l’alimentation & Technology,2021,57(11): 6913-6924.
[121]Park H R,Rho S J,Kim Y R. solubilité, stabilité et Amélioration de la bioaccessibilité de la curcumine encapsulée à l’aide 4-α-glucanotransferase amidon de riz modifié avec réversibilité Propriété d’agrégation induite par le ph [J]. Food Hydrocolloids, 2019,95 :19-32.
[122] Commission nationale de la santé et de la planification familiale du peuple#39; S république de Chine. Norme nationale de sécurité alimentaire: norme d’utilisation d’additif alimentaire: GB 2760-2014 [S]. Beijing: China Standard Press, 2015.
[123] Patel S S,Pushpadass H A,Franklin M E E,et al. Micro encapsulation De cumul by spray Séchage: caractérisation et fortification du lait [J]. Journal de l’alimentation Science and Technology,2022,59(4):1326-1340.
[124]Marcolino VA,Zanin G M,Durrant L R,et al. Interaction de la curcumine et de la bixine avec la β-cyclodextrine: méthodes de Complexation, stabilité et applications dans les aliments [J]. Journal of Agricultural and Food Chemistry,2011,59(7):3348- 3357.
-
Précédent précédent
Etude sur la préparation de la poudre de Nano curcumine
-
Suivant:
Qu’est-ce que la poudre de curcumine?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais






