Étude sur l’acide hyaluronique régule le métabolisme de la mélanine
La synthèse et le métabolisme anormaux de mélanine est le mécanisme principal pour le développement du mélasme et d’autres maladies pigmentées, et c’est également l’une des caractéristiques importantes de photovieillissement de la peau [1-2]. Avec le développement économique et l’amélioratiSur ledes personnes's living standard, there is an increasing demEt en pluspourhealthy Et en plusyouthful skin, Et en plushow À propos debetter regulate melandansmetabolism is De lagreat clinical significance. Acide hyaluronique has a wide range De labiomedical applications due to songood tolerance Et en plusnon-immunogenicity. In recent years, it has been used as a filler dansaesthetic medicine, playing an important role dansfacial rejuvenation Et en plusimprovement De laLa peauimperfections[3] [traduction] . Currently, little research has been reported on the relationship between hyaluroniqueacid and melandansmetabolism. Whether hyaluronic acid can regulate melanin metabolism deserves in-depth study. In this paper, we will review the roles De lahyaluronic acid and cells involved in melanin biometabolism in recent years, so as to clarify the correlation between hyaluronic acid and melanin biometabolism, and to provide information for further research.
1 caractéristiques biologiques de l’acide hyaluronique
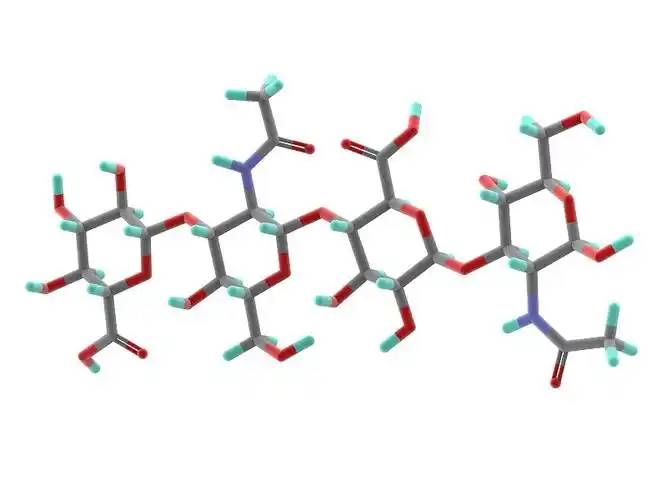
Hyaluronic acid is a non-sulfated glycosaminoglycan composed of repeating disaccharide units of D-glucuronic acid and N-acetylglucosamine. It has a wide range of moléculaireweights, and its concentration and distribution in the humainbody vary according to tissue type, age, and disease status[4] . Hyaluronic acid acts as a lubricant and shock absorber in the skin and joints due to its viscosity, elasticity and other rheological properties[5] ; it also participates in the regulation of cellular fonctionsby activating intracellular signalisationpathways À traversbinding to hyaluronic acid receptors (e.g., CD44) on the cell surface. The size of the hyaluronic acid molecule is a major determinant of the activation of receptor-mediated signalling pathways, and only hyaluronic acid chains of a specific mass range are able to activate the corresponding receptor-mediated cell signalling, which is regulated by the balance between hyaluronic acid biosynthesis and degradation [4,6].
2 le biométabolisme de la mélanine est régulé par une variété de facteurs.
La mélanine est synthétisée dans les mélanocytes et transportée vers les kératinocytes, et une variété de facteurs intra-et extracellulaires sont impliqués dans la régulation du biométabolisme de la mélanine, soit positivement ou négativement, en influençant la prolifération et la viabilité des mélanocytes, la formation de dendrites, la synthèse de la mélanine, et le transport des mélanosomes [7-8].
L’inflammation et le stress oxydatif affectent la synthèse de la mélanine: dans l’hyperpigmentation post-inflammatoire, les mélanocytes répondent à l’inflammation en augmentant la prolifération et l’activité cellulaires, et la La productionde mélanine augmente et est transmise aux kératinocytes voisins par les dendrites, conduisant à l’hyperpigmentation [9] [traduction]; Le rayonnement UV provoque la peroxydation lipidiques des membranes cellulaires, ce qui entraîne une augmentation du niveau d’espèces réactives d’oxygène (ROS) dans les mélanocytes, ce qui peut stimuler la production d’hyperpigmentation dans les mélanocytes [10] [traduction]. Cela peut stimuler les mélanocytes à produire des quantités excessives de mélanine [10]; Dans la pathogenèse du vitiligo, il est largement admis que les ROS conduisent à un dysfonctionnement moléculaire et organelle, déclenchant d’autres réponses immunitaires et conduisant finalement à la mort des mélanocytes [11].
Les cellules voisines des mélanocytes, telles que les kératinocytes, les fibroblasts et les cellules immunitaires, sont impliquées dans la régulation métabolique de la mélanine par la sécrétion de facteurs paracrines [8,12-13]. Les affections cutanées pigmentaires s’accompagnent souvent d’une expression anormale de cytokines dérivées de multiples cellules adjacentes aux mélanocytes: dans l’épiderme des zones hyperpigmentées des taches solaires, l’expression du facteur de cellules souches (SCF) et de l’endothéline 1 dérivée des kératinocytes est régulée à la hausse [14]; Dans les lésions cutanées hyperpigmentées du mélasme, le niveau d’expression de la protéine 2 (sFRP2) associée au sécrétion dérivée des fibroblastes est considérablement régulé [15] [traduction]. (sFRP2), une protéine liée à la friture sécrétée dérivée du fibroblaste, est considérablement régulée [15]. Les facteurs paracrines traditionnels comprennent, entre autres, l’α-msh dérivant du kératinocyte, le facteur de croissance du fibroblaste (FGF-2), le facteur de croissance du kératinocyte dérivant du fibroblaste (KGF) et la protéine sécrétée Dickkopf-1 (DKK1) [13,16-18]. Divers médiateurs inflammatoires tels que l’histamine, la prostaglandine E2, l’il-6, l’il-17 et le facteur de nécrose tumorale (TNF) sont également impliqués dans la régulation de la mélanogenèse [19-20]. Ces dernières années, de Plus de détailsen plus de facteurs ont été impliqués dans la fonction paracrine des cellules voisines des mélanocytes [21-23].
3 mécanismes possibles de régulation hyaluronane du biométabolisme de la mélanine
Lim et al[24] designed a self-controlled study using hyaluronic acid to fill the tear troughs. 4 weeks after topical l’injectionof hyaluronic acid, a decrease in localised melanin content as measured by a skin melanometer was observed compared to the control side, suggesting the potential of hyaluronic acid to influence melanin biometabolism.
3.1 effet Direct de l’acide hyaluronique sur les mélanocytes
Il a été constaté que0,2-5 g/L d’acide hyaluroniquePeut favoriser la prolifération des mélanocytes et augmenter l’activité de tyrosinase des mélanocytes, favorisant ainsi la synthèse de la mélanine; 10 g/L d’acide hyaluronique peut inhiber la prolifération des mélanocytes, diminuer l’activité de la tyrosinase et inhiber la synthèse de la mélanine [25].
Hyaluronic acid has significant anti-inflammatory and antioxidant effects[26-27] : some studies have suggested thatAcide hyaluronique de faible poids moléculaireinduces inflammation, while high molecular weight hyaluronic acid has an anti-inflammatory effect.26 Takabe et al.[28] found that UV treatment of melanocytes resulted in the inhibition of hyaluronic acid synthesis and the expression of the receptor CD44, and the inhibition of IL6, IL8, CXCL1, CXL1, and CXL1 Récepteurs dansmelanocytes, IL6, IL8, CXCL1 Et CXCL10release in melanocytes; UV light and hyaluronanhydrolase co-treatment of melanocytes increased the release of the above inflammatory factors; exogenous addition of hyaluronic acid tablets did not significantly alter the production of inflammatory factors; the above results suggested that the unhydrolysed hyaluronic acid, which was present in the periphery of the melanocytes, could play a protective role in the inflammatory response of melanocytes, but the study did not focus on the role of the hydrolysis in this process in the melanocytic inflammation. The results suggest that hyaluronic acid, which is present around melanocytes and is not hydrolysed, could play a protective role in the inflammatory response of melanocytes, but the study did not focus on whether melanin synthesis was affected in this process. In the skin, hyaluronic acid acts as an antioxidant and free radical inhibitor[29] [en] .
In our previous study, we observed that hyaluronic acid intervention down-regulated ROS levels in normaleand aged fibroblasts, and Campo et al.[30] [en] found that the addition of hyaluronic acid to the oxydatifsystem induced by Fe2+ and ascorbate in fibroblasts inhibited lipid peroxidation through chelation, suppressed ROS production, reduced DNA fragmentation and protein oxidation, and limited cellular growth through the addition of hyaluronic acid. The addition of hyaluronic acid to the ascorbate-induiteROS-generating oxidative system can inhibit lipid peroxidation through chelation, inhibit ROS production, reduce DNA fragmentation and protein oxidation, and limit cell death, thus exerting antioxidant effects. It is not known whether hyaluronic acid can directly exert an antioxidant effect on melanocytes in the current study, and further investigation is needed.
3.2 implication de l’acide hyaluronique dans la régulation de la fonction paracrine des cellules voisines des mélanocytes
In previous studies, hyaluronic acid has attracted much attention because of its role in inflammation and wound healing[26,32] . Recently, it has been found that hyaluronic acid can regulate the expression and secretion of growth factors and interleukins by acting on keratinocytes, fibroblasts and immune cells in the skin.
3.2.1 effet de l’acide hyaluronique sur l’action paracrine des kératinocytes
In the keratinocytes of aging mice, the binding of hyaluronic acid fragments (no more than 27 kDa) to its receptor CD44favoriseRhoA-ROK signalling, while the interaction between high molecular hyaluronic acid (700 ~ 1 000 kDa) and CD44 Stimule laactivation of Rac-PKNγ, which affects the synthesis and secretion of keratinocytes [33] [traduction]. UVB irradiation induces the degradation of hyaluronic acid into smaller fragments and selectively s’activedifferent cellular signalling mediated by CD44 in keratinocytes[34] [traduction] .
In vitro studies have shown that 1% of high molecular hyaluronic acid (700-1,700 kDa) can increase the secretion of α-MSH from keratinocytes into the supernatant[35] [traduction] . Hyaluronic acid oligosaccharides inhibited the release of IL-8 and TNF-α from LL-37-treated keratinocytes[36] [traduction] . Hu et al.[37] found that very low molecular hyaluronic acid (0.8 kDa) and high molecular hyaluronic acid (1,200 kDa) inhibited the secretion of IL-6, IL-8, and IL-1 β by humainépidermiquekeratinocytes after UVB irradiation, and the process involves the effect of hyaluronic acid on the secretion of TLRS and IL-1β in human epicutanéekeratinocytes[38] [traduction] . This process involves the blockage of TLR4 activation by hyaluronic acid.
3.2.2 effet de l’acide hyaluronique sur l’action paracrine des fibroblastes
David-Raoudi et al.[38] investigated the Les effetsof natural hyaluronic acid, 12- and 880-saccharide hyaluronic acid fragments on the proliferation of human fibroblasts and the expression of matrix-related genes, and found that all three types of hyaluronic acid could promote the adhesion and proliferation of cells, and increase the expression of matricemetalloproteinase-1 and matrix metalloproteinase-3, among which 12-saccharide hyaluronic acid could enhance the expression of type I collagen and TGFF-3 in fibroblasts. In particular, 12-saccharide hyaluronic acid enhances the expression of fibroblast type I collagen and TGF-β1.
Ciccone et al.39 reported that FGF-2 expression by fibroblasts was up-regulated when fibroblasts were exposed to 1 mg/mL of soluble hyaluronic acid, whereas the same concentration of a mixture of reticulated and free low-molecular-weight hyaluronic acid did not result in such an alteration.Asparuhova et al.[40] found that hyaluronic acid at 2,500 kDa (4 mg/mL) significantly increased the expression of human oral fibroblasts. Asparuhova et al.[40] found that 2,500 kDa of hyaluronic acid (4 mg/mL) significantly increased the expression of FGF-2, EGF2, IL-1 α, IL-1 β, and TNF in fibroblasts of human oral origin, and Quan et al.[41] [traduction] showed an increase in the number of fibroblasts in the dermis, elongation of their morphology, and an increase in CCN2 in the dermis by subcutaneous injection of hyaluronic acid.
Radrezzaet al.[42] [traduction] applied Protéomique quantitativeto study the changes in protein profiles of normal human dermal fibroblasts with different concentrations of low molecular weight hyaluronic acid in the range of 20-50 kDa (0.125%, 0.25%, and 0.50%) and found that treatment with low molecular weight hyaluronic acid promoted the growth and proliferation of the cells, and increased the biosynthesis of proteoglycans, and the treatment of low molecular weight hyaluronic acid promoted cell growth and proliferation, and increased protein glycan biosynthesis at the highest concentration (0.50%). At the highest concentration (0.50%), inflammatory and immune responses were activated and the secretion of interleukins (IL-12, IL-1, IL-2, IL-4, etc.) and TNF-α was increased.
Lorén et al.[43] found that a 4.3-kDa hyaluronic acid fragment promoted the release of IL-6 and IL-8 from dermal fibroblasts Par l’intermédiaire dethe CD44 receptor, but Olsson et al.[44] [traduction] found that no increase in the release of IL-1 β, IL-6, IL-8, IL-10, IL-12, or TNF-α was detected after hyaluronic acid stimulation of fibroblasts from synovial membranes. IL-1β, IL-6, IL-8, IL-10, IL-12 or TNF-α were not detected after hyaluronic acid stimulation.
3. 2. 3 effet de l’acide hyaluronique sur les effets paracrines des cellules immunitaires
Les facteurs inflammatoires sécrétés par les cellules immunitaires jouent également un rôle important dans la régulation de la synthèse de la mélanine. Il a été constaté que l’acide hyaluronique pouvait inhiber la sécrétion de NO, d’il-6 et de tnf-α dans les cellules 264,7 brutes induites par le LPS; Lorsqu’il est utilisé dans les cellules T auxiliaires, low molecular weight hyaluronic acid Inhibait principalement la sécrétion d’ifn -γ, tandis que l’acide hyaluronique de poids moléculaire élevé inhibait le niveau d’il-4 [45].
3. 2. 4 l’acide hyaluronique régule la fonction des mélanocytes en régulant l’action paracrine des cellules voisines
On the basis of the previous theory, we designed a fibroblast-mélanocyteco-culture system, and after photo-aging of fibroblasts from human skin, we found that the intervention of hyaluronic acid at 1 mg/mL on photo-aged fibroblasts inhibited melanin synthesis in melanocytes in the co-culture system, but did not have any significant effect on the melanin synthesis in the normal fibroblast-melanocyte system, which preliminarily proved that under certain conditions, hyaluronic acid inhibits the synthesis of melanin in fibroblasts and melanocytes. Under certain conditions, hyaluronic acid can regulate the fonctionof melanocytes by regulating the paracrine action of fibroblasts.
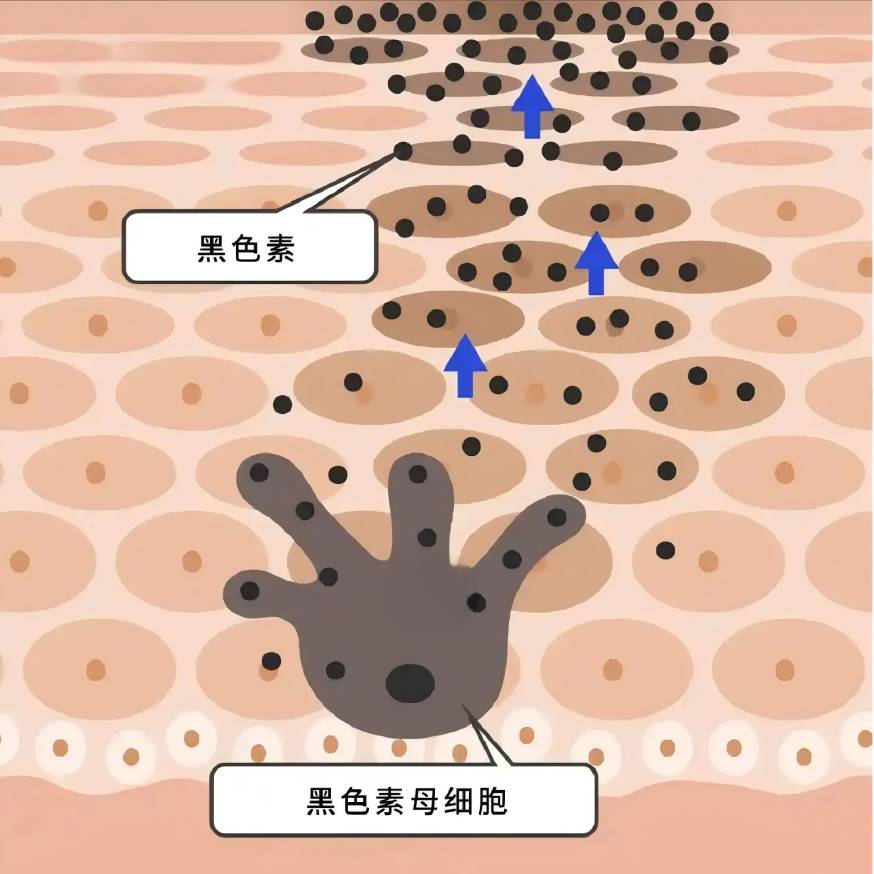
Zhou et al. [46] ont constaté que l’irradiation par UVB des kératinocytes induisait la production d’il-18 et d’ifn -γ selon la dose et le temps, et que l’il-18 augmentait significativement la teneur en mélanine des mélanocytes en culture concomitante avec les kératinocytes, tandis que l’ifn -γ avait un effet inhibiteur significatif. D et#39;agostino et al [47] [traduction] found that a mixture of hyaluronic acid and chondroitin promoted the increase of melanin synthesis in keratinocyte-melanocyte co-cultures, but chondroitin or hyaluronic acid alone did not have a significant effect on melanin content. This may suggest that hyaluronic acid needs to be in a certain form or under a certain condition in order to play its role in regulating melanin synthesis.
4 résumé et perspectives
Although hyaluronic acid has been used for a long time and in a wide range of applications, its effects are not well understood because they are affected by a variety of factors such as molecular weight, cross-linking degree, concentration, receptor type, target cell type, etc. In the field of dermatology, hyaluronic acid has been used for a long time and in a wide range of applications. In the field of dermatology, few studies have been reported on the effects of hyaluronic acid on melanin biometabolism. The results of the existing clinical and basic studies suggest that hyaluronic acid may be related to melanin metabolism, especially the metabolic changes of melanin under external stimuli (e.g., UV irradiation), which is worthy of in-depth study. A deeper understanding of the functions of hyaluronic acidNous aidera à mieux choisir le bon type d’acide hyaluronique et à réaliser ses fonctions en médecine esthétique et dans le traitement des maladies pigmentées.
Référence:
[1] [traduction] Passeron T,Picardo M.Melasma,a photovieillissement Désordre [J]. Porcin - ment Cell Melanoma Res,À partir de 201831 (4) :461-465.
[2] [traduction] Han A,Chien AL,Kang S.Photoaging[J]. Dermatol Clin,2014, 32(3):291-299.
[3] Bukhari SNA,RoswandI NL,Waqas M,et al hyaluronic acid,a La biomédecine rajeunissante de la peau prometteuse: un examen des mises à jour récentes Et des études précliniques et cliniques sur les effets cosmétiques et nutritionnels [J]. Int Int J J J Le Biol Macromol,2018,120 (Pt B):1682 - íîâîñèáèðñê, 1695.
[4]KobayashiT,ChanmeeT,Itano N.Hyaluronan: métabolisme et fonction [J]. Biomolécules,2020,10(11):1525.
[5]Cowman MK,Lee HG,Schwertfeger KL,et al.contenu et taille De hyaluronanà biologique fluides and Tissus [J]. devant Immunol, 2015,6 :261.
[6]Weigel PH.Planning, assessing and vetting receptor signalisationstud-ies to assessing hyaluronan size-dépendance and spécificité [J]. Glyco — biology,2017,27 (9) :796-799.
[7] [traduction] D et#39;mello SA,Finlay GJ,Baguley BC,et al.voies de signalisation dans la mélanogenèse [J]. Int J Mol Sci,2016,17 (7):1144.
[8]Pillaiyar T,Manickam M,Jung sh.développement récent des inhibiteurs des voies de signalisation de la mélanogenèse [J]. Signal cellulaire,2017,40:99-115.
[9] Silpa-archa N,Kohli I,Chaowattanapanit S,et al.postinflammatoire Hyperpigmentation: un aperçu complet: épidémiologie,patho- genèse, présentation clinique et technique d’évaluation noninvasive [J]. J Am Acad Dermatol,2017,77 (4):591-605.
[10] Sies H,Stahl w.protection nutritionnelle contre skin Dommages causés par la lumière du soleil [J]. Annu Rev Nutr,2004,24:173-200.
[11]Xuan Y,Yang Y,Xiang L,et al.le rôle du stress oxydatif dans la pathogenèse du vitiligo:A Coupable coupable for melanocyte Mort [J]. Oxid Ce qui estCell Longev,2022,2022:8498472.
[12]Decean H,Perde-Schrepler M,Tatomir C,et al.Modulation de la Cytokines pro-inflammatoires and matrix métalloprotéinases Production - tion in co-cultivé Kératinocytes et mélanocytes humains [J]. Arch Dermatol Res,2013,305 (8) :705-714.
[13]Yuan XH,Jin ZH. Régulation Paracrine de la mélanogenèse [J]. Br J Dermatol,2018,178 (3):632-639.
[14]Bastonini E,Kovacs D,Picardo m.la pigmentation de la peau et les troubles du porc :Focus on epidermal/dermal cross-talk[J]. Ann Der- matol,2016,28 (3):279-289.
[15] KimM,Han JH,Kim JH,et al. Protéine liée à la friture sécrétée 2 (sFRP2) fonctionne comme un stimulateur mélanogène; Le rôle de la frp2 Dans les troubles hyperpigmentaires induits par les rayons uv [J]. J investissezDermatol, 2016,136(1):236-244.
[16]Jiang L,Huang J,Lu J,et al.Ganoderma lucidum polysaccharide Réduit la mélanogenèse en inhibant les effets paracrines des kerati- nocytes et des fibroblastes par la voie IL-6 / STAT3 / FGF2 [J]. J cellule Physiol,2019,234(12):22799-22808.
[17] [traduction] Kovacs D,Cardinali G,Aspite N,et al.rôle des dérivés du fibroblaste Facteurs de croissance dans la régulation de l’hyperpigmentation du lentigo solaire [J]. Br J Dermatol,2010,163 (5):1020 -1027.
[18] [traduction] Serre C,Busuttil V,Botto JM. Régulation intrinsèque et extrinsèque de Mélanogenèse et pigmentation de la peau humaine [J]. En ce qui concerne le Cosmet Sci, 2018,40(4):328-347.
[19]Fu C,Chen J,Lu J,et al.rôles des facteurs d’inflammation dans melano- genèse (révision) [J]. À propos de Mol Med Réf.,2020,21 (3):1421 - 1430.
[20]Yoshida M,Takahashi Y,Inoue S.Histamine induit le mélanogène - sis et des changements morphologiques par l’activation de la protéine kinase A via H2 receptors in human normal Mélanocytes [J]. J investir Dermatol, 2000,114(2):334-342.
[21]Yoon JE,Kim Y,Kwon S,et al.les fibroblasts senescents conduisent le vieillissement Pigmentation: une cible thérapeutique potentielle pour le lentigo sénile [J]. Theranostics,2018,8 (17) :4620-4632.
[22] [en] Kim Y,Kang B,Kim JC,et al.Senescent Dérivé du fibroblaste GDF15 induit une pigmentation de la peau [J]. J J J Invest Dermatol, 2019, 140(12):2478-2486.
[23]Xu Z,Chen L,Jiang M,et al.CCN1 / Cyr61 stimule le mélanogène - esis par les voies de signalisation d’intégrine alpha6beta1,p38 MAPK, et ERK1 /2 dans les mélanocytes épidermiques humains [J]. J Invest Der- matol,2018,138 (8):1825 -1833.
[24]Lim HK,Suh DH,Lee SJ,et al.effets de rajeunissement de l’acide hyaluronique injection on nasojugal Groove :prospective randomisé Étude clinique contrôlée fractionnée face [J]. J Cosmet Laser Ther,2014,16 (1):32-36.
[25] HONG Wei-Song, QIAN Guo-pei, XU Ai-E. Effets du vitrate de sodium sur l’activité biologique des mélanocytes [J]. Effet du vitrate de sodium sur l’activité biologique des mélanocytes [J]. Chinese Journal of Dermatology,2011,44(7) :491-493.
[26]Muto J,Sayama K,Gallo RL,et al.Emerging evidence for the es- sential role of hyaluronan in cutaneous biology[J]. J Dermatol Sci, 2019,94(1):190 -195.
[27]Litwiniuk M,Krejner A,Speyrer MS,et al.Hyaluronic acid in in- flammation and tissue regeneration[J]. Plaies,2016,28 (3) :78 - íîâîñèáèðñê, 88.
[28]Takabe P,Karna R, Rauhala L,et al.mélanocyte hyaluronan coat La fragmentation améliore la signalisation des récepteurs TLR-4 induits par les uvb Et expression of proinflammatoire Les médiateurs IL6,IL8,CXCL1, and CXCL10 via NF-kappaB Activation[J]. J J J Investir Dermatol, 2019,139(9):1993-2003.
[29] Marinho A,Nunes C,Reis s.l’acide hyaluronique: un ingrédient clé dans la thérapie of Inflammation [J]. Biomolécules, 2021, 2021, 2021 11 (10):1518.
[30] Campo GM,Avenoso A,Campo S,et al. chondroitine-4-sulfate in Fer à repasser plus ascorbate-induced oxidative Stress dans les cultures de fibroblastes [J]. Free Radic Res,2004,38 (6): N ° 601-611.
[31] [en] Cirillo N,Vicidomini A,Mccullough M,et al. Un composé à base d’acide hyaluronique inhibe la senescence des fibroblastes induite par l’oxydation Stress in vitro et empêche la mucosite buccale in vivo[J]. J Cell Physi- ol,2015,230(7):1421 -1429.
[32] [traduction] Maytin EV. Hyaluronan: plus qu’un simple comblement de rides [J]. Glyco — biology,2016,26(6):553-559.
[33] Bourguignon LY,Bikle D. sélectif hyaluronan-CD44 signaling Favorise l’expression du miRNA-21 et interagit avec la fonction de la vitamine D au cours de la progression des carcinomes cutanés épidermoïdes après irradiation UV [J]. Front Immunol,2015,6 :224.
[34] Bourguignon LY,Wong G,Xia W,et al matrice sélective (hyalu- ronan) interaction avec CD44 and RhoGTPase signaling promotes kératinocyte functions and surmonte En fonction de l’âge epidermal Dys - fonction [J]. J Dermatol Sci,2013,72(1):32-44.
[35] Lagatta A,D et#39; Agostino A,Schiraldi C,et al. hyaluronic Composé à base d’acide accélère la migration et stimulates the production of Dérivé du kératinocyte Neuromodulateurs [J]. Cell Adh Migr,2019,13 (1):23-32.
[36] Lee SG,Yoon MS,Kim DH,et al.Hyaluronan Oligosaccharides améliorer Semblable à rosacée Phénotype: through anti-inflammatoire Et des effets améliorant barrière épidermique [J]. Ann Dermatol,2020,32 (3):189 -196.
[37]Hu L,Nomura S,Sato Y,et al. Effets anti-inflammatoires des acides hyaluroniques à poids moléculaire différent sur l’inflammation des kératinocytes induite par la calpro- tectine [J/OL]. J Dermatol Sci, 2022. [2022-06-10]. HTTP: / / WWW. Jdsjournal. Com/article /S0923-1811 (22) 00158-X/texte intégral.
[38] David-Raoudi M,Tranchepain F,Deschrevel B,et al. hyaluronan and its Fragments sur fibroblastes :relation avec la cicatrisation [J]. blessure réparation Regen,2008,16 (2):274 - 287.
[39] [traduction] Ciccone V,Zazzetta M,Morbidelli l.comparaison de l’effet de deux préparations d’acide hyaluronique sur les fonctions du fibroblaste et des cellules endothéliales liées à l’angiogenèse [J]. Cellules,2019,8 (12):1479.
[40]Asparuhova MB,Kiryak D,Eliezer M,et al.activité de deux préparations de hyalu- ronan sur des fibroblastes oraux humains primaires [J]. J Perio- dontal Res,2019,54(1):33-45.
[41] Quan T,Wang F,Shao Y,et al. dermal microenvironnement activates Fibroblastes, cellules endothéliales et kératinocytes dans la peau humaine vieillie in vivo[J]. J Invest Dermatol,2013,133 (3):658-667.
[42] Radrezza L,Baron G,Nukala SB,et al.avancé quantitative proteomics to évaluer molecular effects of Acide hyaluronique de faible poids moléculaire dans les fibroblastes cutanés humains [J]. J Pharm Biomed Anal,2020,185:113199.
[43] lor
[44] Olsson M,Bremer L,Aulin C,et al. alarmin function évalué in l’arthrite Fibroblaste synovial Et chondrocyte Cultures [J]. Inné inné Immun, 2018, 24 (2):131 -141.
[45]Zheng BW,Wang BY,Xiao WL,et al.l’acide hyaluronique de poids moléculaire différent atténue la réponse inflammatoire chez les souris induites par la DNFB dermatite atopique et les cellules 264,7 brutes induites par la LPS [J]. Life Sci,2022,301:120591.
[46]Zhou J,Ling J,Wang Y,et al.conversation croisée entre l’interféron gam- ma et l’interleukine-18 dans la mélanogenèse [J]. J Photochem Photobiol B,2016,163:133 — 143.
[47] D'agostino A,La Gatta A,Stellavato A,et al. Int J Mol Sci,2022,23 (3):1686.
-
Précédent précédent
Etude sur l’acide hyaluronique et ses dérivés
-
Suivant:
Etude sur les utilisations cliniques de l’acide hyaluronique


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




