Etude sur la preparation des nanoginsénosides
Le Ginseng has an important place danstraditional Chinese medicine, Et en plusits medicinal value was recorded as early as dansShennong' L lclassique de Materia Medica[1] [traduction]. Les ginsénosides sont l’un des ingrédients pharmacologiquement actifs les plus importants du ginseng. Ils ont divers effets pharmacologiques, tels que régulateur de la glycémie [2], anti-tumeur [3], anti-inflammatoire [4], neuroprotection [5], anti-fatigue [6], etc., mais en raison de leur faible solubilité dans l’eau, leur faible biodisponibilité Et etleur faible absorption, ils présentent certaines lacunes en application clinique [7]. Ces dernières années, avec le développement de la technologie de la nanomédecine, les ginsénosides, en tant que l’un des représentants des médecines naturelles au 21e siècle, ont attiré l’attention des chercheurs dans le développement de systèmes de délivrance de la nanomédecine liés aux ginsénosides. Par conséquent, l’auteur passe en revue la recherche actuelle sur les nanomédicaments de ginsénoside, dans l’espoir de fournir une référence pour le développement de préparations connexes à l’avenir.
1 Introduction
1.1 Ginseng saponines
Depuis les années 1960, les chercheurs ont isolé plus de 100 types de saponines à base de ginseng. Leurs structures chimiques sont principalement composées d’aglycones Et etde substituants du sucre [8]. Les saponines de Ginseng peuvent être divisées en type dammarane Et ettype oleanane selon les différences dans les aglycones Et etles sucres. Selon la position du groupe de sucre, les ginsénosides de type dammarane peuvent être divisés en deux types: ceux avec le groupe de sucre attaché aux positions C-3 Et etC-20 de l’anneau de dammarane sont désignés comme type de protopanaxadiol, Et etle type de protopanaxatriol, dans lequel les groupes de sucre sont attachés aux positions C-6 et C-20 de l’anneau de damarane. Les structures chimiques des différents types de ginsénosides sont montrées à la Figure 1 [9-11].
The ginsenosides that have been widely studied are mainly of the damarane type, such as ginsenosides CK,Rb1, Rg3, Rh2, Re, Rh1 Et en plusRg1, etc. The specific chemical structures are shown dansTable 1 [11-12]. However, due to the poor membrane permeability of ginsenosides, the oral bioavailability is usually less than 5%, and the efficacy of direct application is not good [7]. Exploring suitable La droguelivraisonsystèmesis an important means of enhancing their medicinal value.
1.2 systèmes de délivrance de nanomédecine
Le développement des nanotechnologies a favorisé le développement de nombreux nanomédicaments. Les nanomédicaments ont été largement étudiés en raison de leurs effets pharmacodynamiques uniques, tels que la grande surface spécifique, une forte stabilité et une charge de médicament élevée. Il a été constaté que les systèmes d’administration de nanomédecine peuvent améliorer l’efficacité des médicaments en augmentant la solubilité, en améliorant la stabilité des médicaments, en favorisant l’absorption des médicaments, en régulant la libération des médicaments et en évitant la reconnaissance immunitaire [13-15]. La modification ciblée des nanomédicaments peut délivrer des médicaments plus précisément aux sites pathologiques [16-17], et le co-chargement de plusieurs médicaments avec des effets pharmacologiques différents peut renforcer l’effet thérapeutique et réduire les effets indésirables [18-19]. De plus, les nanomédicaments ont été largement étudiés pour le traitement des tumeurs [20]. De nombreux chercheurs ont avancé des théories à l’appui pour le ciblage tumoral des nanomédicaments, telles que l’effet EPR (Enhanced permeability and retention effect), c’est-à-dire que le tissu tumoral solide a les propriétés de densité vasculaire élevée, une mauvaise intégrité structurelle, des troubles de reflux lymphatique, et des concentrations moyennes de perméabilité vasculaire locale élevée, ce qui rend plus facile pour les nanoparticules, les liposomeset certaines substances macromoléculaires à pénétrer et rester dans le tissu tumoral [21-22]. Préparer des ginsénosides en tant que nano-formulation est un moyen efficace d’améliorer leur effet thérapeutique.
2 ginsénosides comme médicaments thérapeutiques
2.1 Micelles
Les Micelles sont des agrégats ordonnés de macromolécules nanométriques formées par l’auto-assemblage de molécules amphiphiles [23]. La partie hydrophobe de la chaîne moléculaire forme le noyau de la micelle, tandis que la partie hydrophile forme la coquille [24]. Les molécules amphiphiles peuvent être utilisées pour encapsuler des médicaments peu solubles afin d’améliorer la solubilité des médicaments dans l’eau, d’améliorer la stabilité des médicaments, de prolonger leur temps de circulation dans le sang, de modifier leur distribution tissulaire et d’accroître l’effet thérapeutique [25].
Ginsenoside CK is the main metabolite of protopanaxadiol-type saponins and has a significant inhibitory effect on a variety of tumor cells [26]. However, CK has poor water solubility and low bioavailability, which limits its clinical application. Zhang et Al., et al.[17] prepared a ginseng saponin CK polymer micelle APD-CK with deoxycholic acid-O-carboxymethylchitosan as the carrier modified with a liver cancer-specific targeting peptide A54.
La modification du peptide A54 permet à l’apd-ck de cibler sélectivement les cellules cancéreuses du foie. La valeur ci50 de l’apd-ck après 48 h d’action sur les cellules HepG2 est de 16,32 μg·mL-1, ce qui est beaucoup plus faible que celle du CK libre (28,19 μg·mL-1). En outre, la libération de médicaments dans APD-CK est résistante au ph, et est plus facilement libérée dans des conditions acides. Cette micelle peut aussi avoir une certaine capacité de ciblage de lysosome. En plus de l’incorporation physique, la liaison chimique des médicaments au transporteur est également un moyen courant de préparer des Les micelleschargées de médicaments. Li et Al., et al.[27] ont utilisé le ginsénoside Rh2 et le triptolide pour estérifier le PEG à double fin, et ont préparé avec succès un polymère tribloc «hydrophobe, hydrophilic-hydrophobe». Ce polymère peut s’auto-assembler en micelles et être utilisé pour l’administration de médicaments hydrophobes. Elle libère des médicaments dans des conditions de pH bas et l’action d’hydrolases de sérum sanguin, et peut être utilisée comme système d’administration combinée stable de médicament dans le traitement du cancer du poumon.
2.2 Liposomes
Liposomes are tiny double-layered vesicles composed of amphiphilic phospholipids. Cholesterol is embedded in the membrane to enhance stability. Hydrophobic drugs can be encapsulated inside the lipid bilayer, while hydrophilic drugs can be embedded in the hydrophilic layer of the lipid membrane [28]. Compared with polymèrenanoparticles, they have fewer adverse reactions and are biocompatible. At present, the few FDA-approved nanoformulations are mainly liposomes pourintravenous injection [29-30].
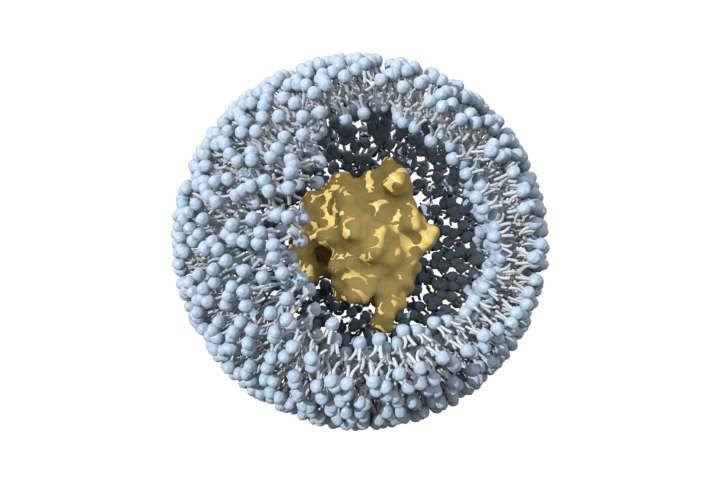
Ginsenoside Rh2 has a good Lutte contre le cancereffect in In vitroand in vivo, but due to its hydrophobicity and significant efflux mediated by ABC Ctransporters, its bioavailability is very low [31]. Xu et Al., et al.[32] prepared mPEG-PLA modified long circulating liposomes Rh2-PLP Pand and an octadecylamine-modified cationic liposome (Rh2-CLP). Compared with conventional liposome Rh2-LP,both have better physicochemical and biological properties in vitro and in vivo. PLP can target drug livraisonto tumor tissue. The fluorescence intensity of DiR-labeled PLP in mouse tumor tissue was 1.3 times that of CLP and 1.6 times that of LP. In vivo anti-tumor studies have shown that Rh2-PLP has the strongest tumor inhibitory effect. This property may be attributed to the PEG modification, which can shield the recognition of liposomes by the reticuloendothelial system (RES), prolong the circulation time of liposomes in the blood, and thus achieve passive targeting of tumors. In addition, other studies have found that the affinity of saponins pourcholesterol and phospholipids can affect the structure and formation of liposomes. When the interaction between cholesterol and phospholipids is stronger than that between cholesterol and saponins, it is more conducive to the stability of liposomes [33-34].
2.3 nanolaits
Les nanoémulsions sont des systèmes thermodynamiquement stables composés d’une phase huileuse, d’une phase aqueuse et d’un tensioactif ou co-émulsifiant. De fortes forces mécaniques sont habituellement nécessaires pour disperser uniformément le médicament et les excipients [35]. Cependant, le processus de préparation nécessite moins de tensioactif, la taille des gouttelettes est faible et l’absorption du médicament peut être améliorée [36]. Il a été étudié pour la libération contrôlée de substances bioactives lorsqu’il est administré par voie orale, par injection, et topique sur la peau [37-39].
Ginsenoside Rg1 has low membrane permeability and is not effective when taken orally [40]. In order to improve the oral bioavailability of Rg1, Khattab et Al., et al.[41] used Caproyl 90, IPN ° de catalogueand Labrafil M1944 as the oil phase, Tween 80, Cremophor EL and Tween 20 as the surfactants, Transcutol HP and propylene glycol as co-surfactants, prepared a Rg1-loaded nanoemulsion SNES. SNES has an ultra-small particle size of 10.05–13.32 nm, which effectively avoids the phagocytosis of RES. The lipid components in the preparation enhance the ability of Rg1 to penetrate the blood-brain barrier, thereby providing higher brain targeting. After oral administration, the metabolites of the lipid components in SNES,such as diacylglycerides, monoglycerides and fatty acids, form mixed micelles with bile acids, which promote the absorption of Rg1 into the blood circulation through the lymphatic system, thereby avoiding the first-pass effect. This nanomilky solution may be an alternative treatment for obese patients with orlistat metabolic disorders.

2.4 nanoparticules d’albumine
Albumin is abundant in serum and has the advantages of being non-toxic, non-immunogenic, biocompatible, and easily chemically modified. Based on these properties, albumin nanoparticles have been widely studied for the livraisonof various types of molecules, including chemical drugs, proteins/peptides, and oligonucleotides [42-44].
Zhang et Al., et al.[45] ont choisi le mPEG-SA pour estérifier les groupes hydroxyle libres sur le ginsénoside Rg3 et ont préparé des nanoparticules d’albumine chargées de médicaments en utilisant l’albumine sérique bovine (BSA) comme support. L’introduction de mPEG hydrophile peut prolonger considérablement la circulation sanguine du médicament, ce qui est propice au mPEG-Rg3-BSA NPs réalisant l’effet EPR. L’intensité de fluorescence du mPEG-Rg3-BSA NPs marqué dir-au site de la tumeur est 5,4 fois plus élevée que celle du DiR libre. Comparé au Rg3 libre, mPEG-Rg3-BSA NPs augmentent l’effet thérapeutique. Le ginsénoside Rg5 a une faible solubilité dans l’eau et une faible biodisponibilité. Dong et al. [46] ont utilisé une méthode de désolation pour préparer des nanoparticules d’albumine sérique bovine modifiées par cible à l’acide folique (af) chargées de Rg5 (FA-Rg5-BSA NPs). Ces nanoparticules ciblent spécifiquement les cellules tumorales en raison de la grande quantité de FA sur la surface, l’absorption accrue de nanoparticules et l’internalisation par l’endocytose médiée par récepteur, induisant l’apoptose des cellules tumorales. Dans un modèle de traitement du cancer du sein humain MCF-7 chez la souris, il a été observé que le Rg5 pouvait s’accumuler efficacement au site de la tumeur rapidement (8 h), et le taux d’inhibition du poids tumoral chez la souris atteignait (79,25 ± 6,36)%, significativement plus élevé que celui du Rg5 libre (48,84 ± 9,74 %) et du Rg5-BSA NPs sans modification de FA (69,91 ± 11,77 %).
2.5 nanoparticules métalliques
Lorsque des particules métalliques sont utilisées comme vecteurs de médicaments, le médicament peut être chargé sur la surface du support de métal par des interactions telles que les forces électrostatiques, les liaisons d’hydrogène, et les forces de van der Waals. Ces dernières années, les nanoparticules métalliques ont attiré beaucoup d’attention en raison de leur grande surface spécifique, de leur facilité de modification fonctionnelle, de leur grande stabilité et de leur capacité de charge élevée. Ils ont été largement étudiés dans l’imagerie tumorale, la thérapie ciblée, et la thérapie photothermique [47-49].
Due to the good biocompatibility and automatic liver targeting function of iron-based nanoparticles, Ren et al. [50] prepared Fe@Fe3O4 nanoparticles Np Rg3 coupled with ginsénosideRg3, qui peut inhiber de manière significative le développement du carcinome hépatocellulaire (CHC), éliminer les métastases pulmonaires du CHC et prolonger efficacement la survie des souris atteintes d’un cancer du foie. Les nanoparticules peuvent également remodener le réseau déséquilibrée entre les microorganismes intestinaux et le métabolisme, retardant les changements microbien intestinaux induits par le HCC pendant au moins 12 semaines, fournissant ainsi une nouvelle stratégie pour le traitement du HCC. En outre, la combinaison de la thérapie photothermique et de la chimiothérapie est également un moyen important de traitement du cancer. Kim et al. [51] ont préparé des nanoparticules de ginsénoside CK-Au à l’aide de Lactobacillus acidophilus DCY51T. Qui ont une charge cationique sur la surface. Quand ils atteignent le tissu tumoral en utilisant l’effet EPR,ils peuvent se lier à la surface anionique des cellules tumorales et envahir les cellules tumorales par l’endocytose, favorisant la lyse des cellules tumorales. Lorsqu’il est combiné avec un traitement à la lumière infrarouge de 635 nm, l’effet inhibiteur sur la prolifération des cellules cancéreuses gastriques humaines est encore renforcé, et c’est un agent thérapeutique synergique efficace pour la photothermie et la chimiothérapie.

3 saponines de Ginseng comme vecteurs de drogue
3.1. - les conditions de travailGinseng saponinesEn tant que transporteur de drogue
La structure chimique unique des ginsénosides les rend précieux en tant que nouveau type de vecteur de médicament, combinant les fonctions d’un vecteur et d’un traitement.
(1) (1) Les ginsénosides ont à la fois une structure hydrophobe de dammarane ou d’oléanane et un groupe hydrophile de glucose [8], qui peut former des nanoparticules auto-assemblées, des micelles ou agir comme tensioactifs dans les nanoémulsions [19, 52-54]. (2) (2) les saponines de Ginseng ont une structure de stérol et peuvent remplacer le cholestérol en tant que nouveau type de stabilisateur de membrane de liposome. Ils ont les caractéristiques d’une bonne stabilité et d’un fort ciblage tumoral [55-56]. (3) les saponines de Ginseng peuvent interagir avec les phospholipides dans les membranes cellulaires. Lorsqu’ils sont utilisés comme vecteurs de médicaments, ils peuvent générer des lacunes transitoires lorsqu’ils sont en contact avec les membranes cellulaires, ce qui augmente l’absorption cellulaire des médicaments, et l’intégrité de la membrane cellulaire peut être restaurée en relativement peu de temps [53]. (4) le groupe glycosyle dans la structure des ginsénosides est un substrat pour le transporteur de glucose 1 (GLUT1). GLUT1 est spécifiquement exprimé dans certaines cellules tumorales, de sorte que les ginsénosides eux-mêmes ont également certaines propriétés de ciblage tumoral [57-58]. (5) GLUT1 est également le transporteur principal de la barrière hémato-encéphalique. Les saponines de Ginseng contenant des groupes glycosyl peuvent également traverser la barrière hémoencéphalique, et ont un certain potentiel pour l’administration ciblée de médicaments dans le cerveau [56, 59].
(2)
3.2 Application des ginsénosides comme vecteurs de médicaments
3.2.1 formation directe de nanoparticules auto-assemblées
Based on the amphiphilic molecular Structure des ginsénosides, ils peuvent former des nanoparticules par eux-mêmes et recouvrir d’autres médicaments en tant que vecteurs. Dai et al. [52] ont utilisé des micelles de ginsénoside Rb1 automontées pour fournir des composés anticancéreux naturels à faible solubilité (acide béthulinique, dihydroartémisinine et hydroxycamptothécine). Les nanoparticules préparées présentaient une capacité de charge élevée (20%-35%), un fort ciblage des tumeurs et une demi-vie prolongée du médicament. Li et al. [19] ont préparé avec succès des micelles de saponine Rb1 de ginseng à microémulsion chargées de diclofénac et dont la taille des particules est inférieure à 10 nm à l’aide de la méthode de dispersion par pellicule mince. Des études In vivo sur la pénétration de la cornée oculaire chez le lapin ont montré que les micelles pouvaient fournir des concentrations élevées de diclofénac à la cornée. Après administration d’une dose unique, les taux de diclofénac dans le groupe d’administration de Rb1-Dic étaient respectivement de 137,54 %, 74,93 % et 255,43 % supérieurs à ceux du groupe de solution ophtalmique de diclofénac disponible sur le marché à 0,5, 1 et 2 h, ce qui constitue une nouvelle stratégie pour le traitement des maladies inflammatoires oculaires. Zou et al. [53] ont utilisé l’extrait de saponine de ginseng comme matériau de membrane préparé des nanoparticules de ginsénoside d’insuline chargée de ginsenoside (INS) par dispersion de film mince, qui peuvent protéger les INS d’être détruites par les hydrolases de la peau. Les nanoparticules peuvent également pénétrer rapidement dans les cellules en 15 minutes en détruisant de manière réversible la barrière lipidique intercellulaire, et basé sur la peau et#En effet, l’efficacité hypoglycémique de la formulation dans un modèle de traitement pour rat diabétique est restée à environ 50% du niveau initial pendant 48 h.
3.2.2 stabilisateur de Membrane pour liposomes
Le ginsénoside a une structure chimique similaire au cholestérol et peut être utilisé comme stabilisateur de membrane pour les liposomes au lieu du cholestérol. Hong et al. [55] ont préparé des liposomes contenant du paclitaxel en utilisant du ginsénoside Rh2 et des phospholipides, et ont confirmé que le Rh2 a les excellentes propriétés d’améliorer la stabilité des liposomes, de prolonger le temps de circulation du médicament dans le sang, de favoriser l’accumulation du médicament dans les tumeurs et d’inverser le microenvironnement immunosuppresseur. Chen et al. [58] ont également constaté que les ginsénosides avec un groupe de sucre substitué c-3 (comme les ginsénosides Rg3 et Rh2) peuvent prolonger le temps de circulation sanguine des liposomes et se lier spécifiquement au GLUT1 exprimé à la surface des cellules 4T1, améliorant la capacité de ciblage de la tumeur. Les résidus de sucre dans la structure ginsénoside sont des substrats pour le transporteur de glucose de la barrière hémato-encéphalique [59]. Zhu et al. [56] ont utilisé le ginsénoside Rg3 comme matériau membranaire pour préparer les liposomes Rg3-PTX-LPs chargés de paclitaxel, qui peuvent également traverser la barrière hémato-encéphalique pour le traitement ciblé des tumeurs cérébrales. Le IC 50 de Rg3-PTX-LPs pour les cellules de gliome C6 de rat est de 0,045 μg·mL-1, ce qui est beaucoup plus faible que celui des liposomes de cholestérol C-PTX-LPs (0,149 μg·mL-1). L’imagerie par fluorescence In vivo a montré que l’intensité du signal DiR détectée dans la région du gliome de Rg3-LPs était environ 3 fois celle du C-LPs, et il a été détecté que l’élimination du Rg3-LPs chez la souris était plus lente que celle du C-LPs, et même proche du PEG-C-LPs. Ce type de liposome a également un certain effet de longue circulation.
3.2.3 Surfactant en tant que nanomulsion
Les ginsénosides sont également un tensioactif naturel [60] parce que leur structure chimique contient des groupes hydrophobes et hydrophiles. Ils sont actuellement à l’étude pour être utilisés dans la conception et le développement de nouveaux aliments fonctionnels. Shu et al.[54] ont dispersé l’astaxanthine dans l’huile de soja en tant que phase huileuse et les ginsénosides dans l’eau de haute pureté en tant que phase aqueuse. Ils ont préparé avec succès des nanoémulsions contenant de l’astaxanthine par homogénéisation à haute pression. Même à un niveau relativement bas, ginsenoside peut effectivement réduire la tension interfaciale entre les interfaces huile et eau. Dans une certaine plage de concentration, à mesure que la concentration de ginsénoside augmente, la taille des gouttelettes devient de plus en plus petite. Cependant, il convient de noter que lorsque cette émulsion nanolaiteuse est stockée à des températures plus élevées, le taux de dégradation de l’astaxanthine est trop rapide, et l’impact spécifique du ginsénoside en tant que surfactant sur la stabilité de l’émulsion doit être étudié plus en profondeur.
4 Conclusion et perspectives
Les ginsénosides ont une variété d’activités pharmacologiques et sont des médicaments naturels avec un grand potentiel de développement. Cependant, ils sont très hydrophobes et présentent une faible biodisponibilité orale, ce qui limite leur application clinique. Le développement de formes nanoposologiques offre un moyen d’application pratique pour de nombreux médicaments peu solubles. Les ginsénosides peuvent être directement encapsulés dans des nanovecteurs tels que des micelles, des liposomes, des nanolaits, des nanoparticules d’albumine et des nanoparticules métalliques, et leur biodisponibilité peut être efficacement améliorée. En outre, le groupe hydrophile du sucre dans la structure ginsénoside hydrophobe lui confère certaines propriétés tensioactives, et il peut être utilisé pour former des nanoparticules ou agir comme tensioactif pour les nanoémulsions. De plus, le ginsénoside a une structure similaire au cholestérol, et peut également être utilisé comme un stabilisateur de membrane pour les liposomes pour améliorer leur stabilité. En général, la préparation des ginsénosides en tant que nano-formulation peut améliorer leur biodisponibilité. Les ginsénosides peuvent également être utilisés comme matériau porteur pour améliorer les propriétés de la nano-formulation. Une fois utilisé pour encapsuler d’autres médicaments, il peut également réaliser un effet thérapeutique synergique, et a une grande valeur de développement et un potentiel d’application. Toutefois, à ce stade, la recherche sur les ginsénosides comme vecteur de médicaments en est encore à ses débuts, et l’élaboration de formulations connexes nécessite des recherches plus poussées.

Références:
[1] Sun Xingyan, Sun Fengyi, comp. Shennong' S classique de Materia Medica [M]. Beijing: The Commercial Press, 1955: 9.
[2] [traduction] SABA, E KIMS H,KIM S D, et al. Soulagement des complications diabétiques par l’extrait de ginseng rouge enrichi de ginsenoside rg3 chez des souris LDL - / - occidentales nourries dans l’alimentation [J]. J J JJ JGinseng Res, 2018,42(3): 352-355.
[3] [traduction] ROSA M T M G, SILVA E K, SANTOS D T, et al. Obtention de miniémulsions d’huile de graines de roseau par ultrasonication en utilisant un extrait aqueux de racines de ginseng du Brésil comme biotensioactif [J]. J Food Eng, 2016,168: 382-390.
[4] [traduction] Qi B, Zhang S, Guo D, et al. Effet protecteur et mécanisme du ginsénoside Rg1 sur les lésions hépatiques aiguës induites par le tétrachlorure de carbone [J]. Mol Med Rep, 2017, 16(3): 2814-2822.
[5] [traduction] WANG R, LI Y N, WANG G J, J,et al. Effets neuroprotecteurs et transport du cerveau du ginsénoside Rg1[J]. Chin J Nat Medicines, 2009,7(4): 315-320.
[6] [traduction] YANG Q Y,LAI X D, JING O Y, et al. Effets du ginsénoside Rg3 sur la résistance à la fatigue et le SIRT1 chez les rats âgés [J]. Toxicology, 2018,409: 144-151.
[7] [traduction] KIM H, LEE LEELEE J H, KIM J E, et Al. Micro-/ nanotaille delivery systèmes Des ginsénosides Pour améliorer Biodisponibilité systémique [J]. J Ginseng Res, 2018,42(3): 361-369.
[8] [traduction] CHEN W, BALAN P,POPOVICH D G. chapitre 6 - comparaison de la composition en ginsénoside du ginseng asiatique (Panax ginseng) et du ginseng américain (Panax quinquefolius L.) et de leurs voies de transformation [J]. Haras Nat Prod Chem, 2019,63: 161-195.
[9] [traduction] MOHANAN P,SUBRAMANIYAM S, MATHIYALAGAN R, et al. Signalisation moléculaire des ginsénosides Rb1, Rg1 et Rg3 et leur mode d’action [J]. J Ginseng Res, 2018,42(2): 123-132.
[10] XU X H, LI T, FONG CM V, et al. Les saponines de médicaments chinois comme agents anticancéreux [J]. Molécules, 2016,21(10): 1326.
[11] WANG H, ZHENG Y, SUN Q, et al. Ginsénosides émergents en tant que médicaments bifonctionnels et nanoporteurs pour des thérapies antitumorales améliorées [J]. J Nanobiotechnol, 2021,19(1): 322.
[12] PIAO X M, ZHANG H, KANG J P, et al. Progrès dans la diversité de la saponine du panax ginseng[J]. Molécules, 2020,25(15): 3452.
[13] BISWAS S, KUMARI P, LAKHANI P M, et al. récent Les avances in polymeric micelles for anti-cancer Administration de médicaments [J]. Eur J Pharm Sci, 2016,83: 184-202.
[14] SHISHIR M R I, XIE L H, SUN C D, et al. Progrès dans la micro et la nano-encapsulation de composés bioactifs à l’aide de biopolymères et de transporteurs à base de lipides [J]. Tendances Food Sci Tech, 2018,78: 34-60.
[15] DEY T K, KOLEY H, GHOSH M, et al. Effets du nano-dimensionnement sur la bioaccessibilité des lipides et la biodisponibilité ex vivo de l’huile riche en EPA-DHA dans l’eau nanoémulsion [J]. Food Chemistry, 2018,275: 135-142.
[16] HOON H, HO P M, GAYOUNG J et al. Hydrogel Injectable de chitosan de glycol contenant un complexe de cyclodextrine-paclitaxel fonctionnalisé à l’acide folique pour le traitement du cancer du sein [J]. Nanomaterials, 2021,11(2): 317.
[17] ZHANG J M, JIANG YY, LI YP. L’invention concerne des Micelles modifiées avec un peptide homing dérivant de l’achitosan pour l’administration intracellulaire ciblée du composé ginsénoside K à des cellules cancéreuses du foie [J]. Carbohydr Polym, 2020,230: 115576.
[18] SUN J J, LIU Y H, CHEN Y C, et al. La doxorubicine administrée par un porteur de promédicament polymérique contenant du dasatinibe réactif à la redose pour un traitement combiné [J]. J libération contrôlée, 2017,258: 43-55.
[19] LI M S, LAN J, LI X F et al. Nouvelles micelles ultra-petites à base de ginsénoside Rb1: une nanoplate-forme potentielle pour l’administration de médicaments oculaires [J]. Drug Delivery, 2019,26(1): 481-489.
[20] GABIZON A A, ROSALES R T M D, LA-BECK N M. Translational considerations in nanomedicine: the oncology perspective[J]. Médicament Adv Deliver Rev, 2020,158: 140-157.
[21] GOLOMBEK S K, MAY J N, THEEK B, et al. Ciblage tumoral via EPR: stratégies pour améliorer les réponses des patients [J]. Adv médicament Deliver Rev, 2018,130: 17-38.
[22] PARK J, CHOI Y, CHANG CHANGH, et al. Alliance avec l’effet EPR: stratégies combinées pour améliorer l’effet EPR dans le microenvironnement tumoral [J]. Theranostics, 2019,9(26): 8073-8090.
[23] DESHMUKH A S, CHAUHAN P N, NOOLVI M N, et al. Micelles polymériques: de la recherche fondamentale à la pratique clinique [J]. Int J Pharm, 2017,532(1): 249-268.
[24] JHAVERI A M, TORCHILIN V P. micelles polymères multifonctionnelles pour l’administration de médicaments et SiRNA [J]. Front Pharmacol, 2014,5: 77.
[25] AHMAD Z, SHAH A, SIDDIQ M, et al. Micelles polymères en tant que véhicules d’administration de médicaments [J]. RSC avances, 2014,4(33): 17028-17038.
[26] SHARMA A, LEE H J. Ginsenoside Compound K: aperçu des études récentes sur la pharmacocinétique et les activités de promotion de la santé [J]. Biomolécules, 2020,10(7): 1028.
[27] LI P, ZHOU X Y, QU D et al. Etude préliminaire sur la fabrication, la caractérisation et les effets synergiques anti-cancer du poumon de micelles auto-assemblées de celastrol-polyéthylène glycol-ginsénoside Rh2 conjugués covalemment [J]. Drug Delivery, 2017,24(1): 834-845.
[28] DIANA G, ARTUR C P, eu[unused_word0006] nian. Conception de liposomes en tant que système d’administration de médicaments pour des applications thérapeutiques [J]. Int J Pharm, 2021,601: 120571.
[29] DE L V, MILANO F,AGOSTIANOA, et al. Progrès récents dans l’assemblage polymère /liposome pour l’administration de médicaments: des modifications de surface aux vésicules hybrides [J]. Polymères, 2021,13(7): 1027.
[30] ALMEIDA B, NAG O K, ROGERS K E, et al. Progrès récents dans les stratégies de bioconjugaison pour l’administration de médicaments par liposome [J]. Molécules, 2020,25(23): 5672.
[31] GU Y, WANG G J, WU X L, et al. Mécanismes d’absorption intestinale du ginsénoside Rh2:stéréosélectivité et implication des transporteurs ABC [J]. Xenobiotica, 2010,40(9): 602-612.
[32] [traduction] L Q, YU L, YIN S P, et al. À base de liposome delivery systems for ginsenoside Rh2: in vitro and in Comparaisons vivo [J]. J Nanopart Res, 2015,17(10): 415.
[33] HAO F, HEY X, SUNY T, et al. Amélioration de la disponibilité orale des saponines de fruits de ginseng par un système d’administration proliposomique contenant du désoxycholate de sodium [J]. Saudi J Biol Sci, 2016,23(1): S113-S125.
[34] GROOT C D, de sken M, de ller-goymann C C. le triterpène bidesmosidique saponinshederacoside C et le ginsénoside Rb1 présentent une faible affinité pour le cholestérol dans les membranes liposomales [J]. J livraison de drogue Sci Tec, 2019,53: 101127.
[35] ANTON N, VANDAMME T F. Nano-emulsions et micro-emulsions: clarifications des différences critiques [J]. Pharm Res, 2011,28(5): 978-985.
[36] MCCLEMENTS D J. Advances in edible nanoemulsions: digestion, biodisponibilité, and potential toxicity[J]. Prog Lipid Res, 2021,81: 101081.
[37] MASKARE R G, INDURWADE N H, DESHMUKH RA, et al. Nanoémulsions: augmenter les possibilités dans l’administration orale de médicaments [J]. Asian J Chem Tec, 2021,11(1): 53-58.
[38] [unused_word0006] Guy L, GROO A C, GOUX D, et al. Conception de nanoémulsions non hémolytiques pour l’administration intraveineuse d’api hydrophobes [J]. Pharmaceutics, 2020,12(12): 1141.
[39] BASHIR M, AHMAD J, ASIF M, et al. Nanoemulgel, un porteur innovant pour l’administration topique diflunisal avec un effet anti-inflammatoire profond: évaluation in vitro et in vivo [J]. Int J Nanomed, 2021,16: 1457-1472.
[40] HE C Y, FENG R, SUN Y P, et al. Quantification simultanée du ginsénoside Rg1 et de ses metabolites par HPLC - MS/MS: excrétion Rg1 dans la bile, l’urine et les matières fécales du rat [J]. Acta Pharm Sin B, 2016,6(6): 593 -599.
[41] KHATTAB A, AHMED-FARID O A, NASR S A. biodistribution cérébrale améliorée du ginsénoside Rg1 à base de Système d’administration de médicaments auto-nanoémulsionnant pour améliorer les syndromes métaboliques et maintenir l’équilibre homéostatique [J]. J Drug Deliv Sci Tec, 2021,61: 1002276.
[42] YHEE J Y, LEE J, CHANG H, et al. moléculaire l’imagerie and ciblé drug delivery En utilisant Nanoparticules à base d’albumine [J]. Curr Pharm Design, 2015,21(14):1889-1898.
[43] LIU Z B, CHEN X Y. la chimie bioconjuguée Simple sert de grandes avancées cliniques: l’albumine comme plate-forme polyvalente pour le diagnostic et la thérapie de précision [J]. Chem Soc Rev, 2016,45(5):1432-1456.
[44] JAIN A, SINGH S K, ARYA S K et al. Nanoparticules de protéines: plates-formes prometteuses pour les applications de délivrance de médicaments [J]. ACS Biomater Sci Eng, 2018,4(12):3939-3961.
[45] ZHANG L J, HUI J F, MA P, et al. Pégylation des nanoparticules d’albumine sérique bovine piégées par le ginsénoside rg3: préparation, caractérisation et études biologiques in vitro [J]. J Nanomater, 2019: 3959037.
[46] DONG YN, FU R Z, YANG J, et al. L’invention concerne des nanoparticules d’albumine sérique bovine de ginsénoside modifié à l’acide folique et chargé de rg5 pour un traitement ciblé du cancer in vitro et in vivo[J]. Int J Nanomed, 2019,14: 6971-6988.
[47] [traduction] RAI M, INGLE A P, GUPTA I, et al. Bioactivité de nanoparticules de métaux nobles décorées avec des biopolymères et leur application dans l’administration de médicaments [J]. Int J Pharm, 2015,496(2): 159-172.
[48] GOKUL P, NAMITHARAN K, ARUL M R, et al. anisotrope noble métal Nanoparticules: Synthèse, Fonctionnalisation de surface et applications en biodétection, en bioimagerie, en administration de médicaments et en theranostique [J]. Acta Biomater, 2017, 49: 45-65.
[49] NOOR NA R, BASMA AA, NATHEER H A R, et al. Magnétisme dans l’administration des médicaments: les merveilles des oxydes de fer et des nanoparticules de ferrites substituées [J]. Saudi Pharm J, 2020,28(7): 876-887.
[50] REN Z G, CHEN X M, HONG L J, et al. La conjuguation nanoparticule du ginsénoside Rg3 inhibe le développement du carcinome hépatocellulaire et les métastases [J]. Small, 2020,16(2): e1905233.
[51] KIM YJ, PERUMALSAMY H, MARKUS J et al. Développement de nanoparticules d’or médiées par Lactobacillus kimchicus dcy51t pour la délivrance du composé ginsénoside K: effets photothermiques in vitro et détection de l’apoptose dans les cellules cancéreuses [J]. Artif Cell, Nanomed, Biotechnol, 2019,47(1): 30-44.
[52] DAI L, LIU K F, SI C L, et al. Nanoparticules de ginsénoside: un nouveau système de livraison de médicaments verts [J]. J Mater Chem B, 2015,4(3): 529-538.
[53] ZOU J J, LE J Q, ZHANG B C, et al. Accélération de l’administration transdermique d’insuline par des nanoparticules de ginsénoside avec perméabilité unique [J]. Int J Pharm, 2021,605: 120784.
[54] SHU G F, KHALID N, CHEN Z et al. Formulation et caractérisation de nanoémulsions enrichies d’astaxanthine stabilisées à l’aide de saponines de ginseng comme émulsifiants naturels [J]. Food Chem, 2018,255: 67 -74.
[55] HONG C, LIANG J M, XIA J X et al. One stone four birds: a novel liposomal delivery system multi-functionalized with ginsenoside Rh2 for tumor targeting therapy[J]. Nano-Micro Lett, 2020,12(10): 73-90.
[56] ZHU Y, LIANG J M, À propos de GAO C F, et al. multifonctionnel Ginsénoside à base de rg3 liposomes Pour la thérapie de ciblage des gliomes [J]. J libération contrôlée, 2020,330: 641-657.
[57] RAMANI P, HEADFORD A, MAY M T. l’expression de la protéine GLUT1 est corrélée à une catégorie histologique défavorable et à un risque élevé chez les patients atteints de tumeurs neuroblastiques [J]. Virchows Arch, 2013,462: 203 -209.
[58] CHEN C, XIA J X, REN H W, et al. Effet de la structure des ginsénosides sur le devenir in vivo de leurs liposomes[J]. Asian J Pharm Sci, 2022, 2022,17(2): 219-229.
[59] WANG Y Z, XU Q, WU W, et al. Profils de transport du ginsénoside Rb1 par le transporteur de glucose 1: In vitro et in vivo[J]. Avant Pharmacol, 2018,9: 398.
[60] ROSA M T M G, SILVA E K, SANTOS D T et al. Obtention de miniémulsions d’huile de graines de roseau par ultrasonication en utilisant un extrait aqueux de racines de ginseng du Brésil comme biotensioactif [J]. J Food Eng, 2016,168: 68 -78.
-
Précédent précédent
Etude sur la synthèse du ginsénoside
-
Suivant:
Ginseng extrait Ginsenoside et régulation immunitaire


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais





