Etude sur la poudre synthétique de lycopène
Lycopene (C40H56) is a natural fat-soluble pigment of plant and microbial origin....... Chemically, it is a carotenoid composed of a straight-chain hydrocarbon with 11 conjugated double bonds and 2 non-conjugated double bonds [1]. Lycopene can effectively scavenge free radicals in the body and quench singlet oxygen. Its ability to quench singlet oxygen is 2 times that of β-carotene and 10 times that of α-tocopherol[2]. It can be used as an effective antioxidant to reduce the damaging effects of oxidative stress on cells. More and more studies have shown that lycopene has a protective or intervention effect on chronic diseases such as type 2 diabetes, malignant tumors and Alzheimer' S maladie, et attire donc beaucoup d’attention dans les domaines de l’alimentation, de l’industrie chimique et de la médecine. L’organisation des Nations unies pour l’alimentation et l’agriculture (FAO), le comité du Codex sur les additifs alimentaires (CCFA) et l’organisation mondiale de la santé (oms) ont identifié le lycopène comme un nutriment de classe a [3].
Avec la reconnaissance croissante des produits fonctionnels naturels, la recherche sur le lycopène en tant qu’additif alimentaire fonctionnel s’approfondit également. Cependant, le corps humain ne peut synthétiser le lycopène directement et ne peut l’obtenir qu’à partir de légumes et de fruits naturels ou de la flore intestinale, et ses sources et quantités sont assez limitées. Cet article se concentre sur la relation entre la structure principale de la poudre de lycopène, la biodisponibilité et les facteurs influençants, la voie de synthèse microbienne, les stratégies de synthèse de trois souches de levure pour produire du lycopène, et la relation et le rôle de l’application du lycopène dans la prévention de maladies chroniques. Il fournit une base théorique pour la production, l’utilisation et l’exploration fonctionnelle du lycopène.

1 structure chimique et biodisponibilité du lycopène et de ses analogues
La structure moléculaire de la molécule de lycopène contient 13 liaisons doubles, dont 11 conjuguées, ce qui rend le lycopène instable et sujet à l’isomérisation sous l’influence de la lumière, de l’oxygène, des acides, des catalyseurs ou d’autres changements environnementaux. Le lycopène existe principalement en deux conformations: l’isomère all-e (isomère all-trans) et l’isomère z-(isomère cis-trans) (Figure 1). Plus de 90% du lycopène naturel dans les fruits et légumes existe sous la forme all-e isomère la plus stable thermodynamiquement [4]; Cependant, des études ont révélé que plus de 50% du lycopène dans le sérum et les tissus humains est métabolisé sous la forme de l’isomère z [4]. Les isomères z courants sont principalement le lycopène 5-cis, 9-cis, 13-cis et 15-cis. Des études ont montré que le 5-cis lycopène a une capacité antioxydante plus élevée et une biodisponibilité plus élevée que d’autres analogues [5].
Par conséquent, l’absorption de 5-cis lycopène peut être plus bénéfique pour la santé humaine que le all-e-lycopène, et a un plus grand potentiel d’application dans les industries alimentaires et pharmaceutiques. Ces dernières années, les chercheurs ont travaillé dur pour développer des méthodes pour obtenir des concentrations élevées de z-lycopène, telles que le traitement thermique, le traitement par micro-ondes, l’irradiation de la lumière, le traitement par électrolyse et le traitement catalytique. Toutefois, ces méthodes peuvent encore être améliorées. Par exemple, le chauffage et le traitement par micro-ondes peuvent causer une dégradation en raison des températures élevées; Le traitement photochimique peut également entraîner une dégradation due à la conversion de l’isomère tout E. Bien que l’utilisation de photosensibilisants puisse empêcher efficacement la photodégradation du lycopène, il apporte le défi de l’élimination des photosensibilisants. De même, si des réactifs chimiques tels que des électrolytes et des catalyseurs sont utilisés, l’élimination des substances toxiques est également un grand défi.
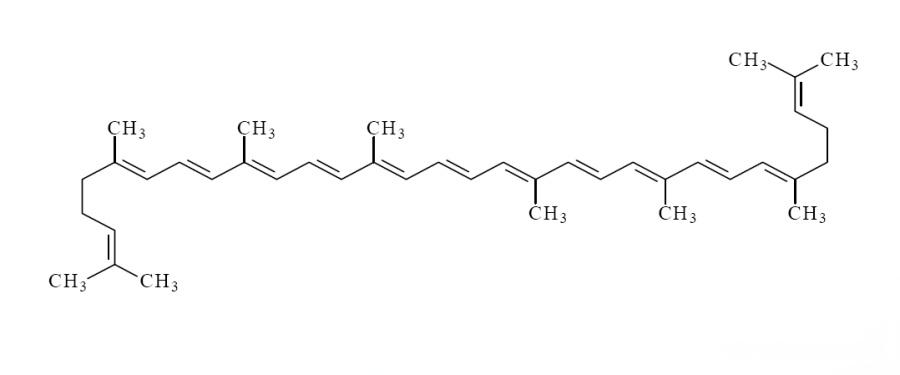
Il y a deux raisons principales qui affectent la biodisponibilité de la poudre de lycopène: le fait que le lycopène soit complètement libéré de la matrice alimentaire et la force de l’émulsification lipides dépendante du lycopène et de la formation micellaire [6] (Figure 2). En raison de la structure chimique extrêmement hydrophobe du lycopène, l’absorption directe et le taux d’utilisation du lycopène dans les fruits et légumes par le corps humain sont très faibles [7]. Cependant, des processus tels que le traitement thermique pendant la transformation des aliments peuvent endommager les membranes cellulaires et favoriser la libération de lycopène à partir de la matrice tissulaire, augmentant ainsi la biodisponibilité du lycopène. La biodisponibilité du lycopène varie considérablement selon la méthode de traitement, l’ordre de grandeur étant: préparations huileuses thermiquement traitées et purifiées > Traitement doux > Tomates crues [8]. Afin d’améliorer encore l’utilisation efficace du lycopène, les chercheurs ont développé avec succès des systèmes de distribution du lycopène tels que des émulsions traditionnelles, des porteurs de nanoémulsion et des porteurs de lipides nanostructurés en fonction de leurs propriétés physico-chimiques et des caractéristiques telles que la structure des cellules du corps (Figure 3). Ces systèmes peuvent considérablement améliorer la biodisponibilité du lycopène en «emballage» pour augmenter la solubilité dans l’eau et la biodisponibilité des ingrédients actifs. Les protéger des conditions défavorables du tube digestif, et les libérer au site d’absorption pour une meilleure absorption.
2 biosynthèse du lycopène
Natural lycopene is mainly derived from tomatoes and fruits such as grapefruit, melons, red guava, red carrots, and wolfberries. In addition, studies have confirmed that some microorganisms, including bacteria, fungi and algae, can accumulate lycopene under specific physiological conditions [9]. For example, the inactivation of lycopene cyclase leads to the interruption of the carotenoid pathway, which helps lycopene accumulate in Blakeslea trispora [10]. The Codex Alimentarius Commission (CAC) has approved three sources of lycopene: tomato extract, chemical synthesis, and Blakeslea trispora extract.
Among them, the tomato extraction method mainly uses vegetable and fruit raw materials rich in lycopene, which are extracted efficiently using various extractants. The advantage of this method is that it can achieve high-quality natural lycopene production in batches, but this method is susceptible to external factors such as the species, origin, and harvest season of the raw materials, which can affect the yield. In addition, large amounts of waste residue, waste liquid, and waste gas are generated during industrial production, which results in high comprehensive treatment costs. The chemical synthesis method is relatively mature, with mild reaction conditions, high recovery rates and low costs. It is currently the main technology for the industrial production of lycopene. However, lycopene has many C=C double bonds, making it difficult to control stereoselectivity. The reaction process is complex and has high technical requirements. There is also the safety issue of organic solvent pollution from the chemical reagents left over from the reaction. In recent years, with the analysis by scientists of the biosynthetic pathway of natural Poudre de lycopène and the great progress in modern microbial genetic engineering, other microorganisms (such as Saccharomyces cerevisiae, Pichia pastoris and Yarrowia lipolytica) can also be used as hosts for lycopene production. Because they have the incomparable advantages of no seasonal restrictions, high yield and a single product, they provide a new way of thinking for the large-scale industrial production of lycopene and have attracted the attention of researchers and the food and pharmaceutical industries.

2.1 voie de biosynthèse du lycopène
Chez les organismes vivants, le lycopène est synthétisé principalement par deux voies biosynthétiques: la voie du mévalonate (mévalonate, MVA) et la voie du 2-méthyl-d-érythritol-4-phosphate (2-méthyl-d-érythritol-4-phosphate, MEP). Parmi eux, les eucaryotes synthétisent principalement le lycopène et ses dérivés par la voie MVA, tandis que les procaryotes les synthétisent souvent par la voie MEP. Les deux voies de biosynthèse utilisent le glycéraldéhyde-3-phosphate (G3P), qui est produit par le corps et#39; S le métabolisme du sucre, pour catalyser une série d’enzymes métaboliques secondaires pour synthétiser des molécules intermédiaires telles que le pyrophosphate d’isopentenyl (pyrophosphate d’isopentenyl, IPP) et son isomère le diphosphate de 3,3-diméthylallyle (DMAPP) et d’autres molécules intermédiaires. Ensuite, l’ipp et le DMAPP sont condensés, modifiés et allongés par des enzymes pour finalement synthétiser le lycopène (Figure 4).
2.2 ingénierie métabolique de la levure pour la synthèse du lycopène
Dans la nature, des levures telles que Rhodotorula glutinis, Rhodotorula graminis et Phaffia rhodozyma peuvent synthétiser des produits naturels caroténoïdes de manière autonome, mais la quantité et l’activité biologique des produits synthétisés ne peuvent souvent pas répondre aux besoins de la production industrielle [11]. Cependant, les levures de fermentation industrielles couramment utilisées comme Saccharomyces cerevisiae, Pichia pastoris et Yarrowia lipolytica sont très sûres, possèdent des outils de modification génétique matures et ont été génétiquement modifiées pour la recherche et la production de lycopène [12]. En réponse à l’absence d’un système métabolique complet chez S. cerevisiae et Y. lipolytica, et au fait que le processus métabolique de la synthèse des caroténoïdes s’arrête à la phase géranylgéranyl diphosphate (GGPP) [13], les chercheurs ont proposé diverses stratégies pour construire des souches de levure producteurs de lycopène (tableau 1). Cependant, l’amélioration du titre final et du rendement de lycopène reste un défi majeur. Il y a plus de stratégies rapportées pour S. cerevisiae que pour P. pastoris et Y. lipolytica, mais il y a moins d’études d’ingénierie systématiques sur S. cerevisiae pour obtenir une production élevée de lycopène. La source des composants de la voie hétérologue et l’efficacité de la voie sont la clé de la production de lycopène chez S. cerevisiae [14], et le faible rendement est probablement causé par le manque de coordination entre la voie endogène et la voie hétérologue.
Par conséquent, afin d’explorer davantage l’adaptabilité de S. cerevisiae elle-même et la voie hétérologique, SHI B et al. [6] ont apporté une solution efficace en crivant les gènes provenant de différentes sources telles que les bactéries, les levures, les champins, les algues et les plantes qui sont concernés par la biosynthèse du lycopène, y compris le crtE (codant la GGPP synthase), le crtB (codant l’octahydro-lycopène synthase) et le crtI (codant l’octahydro-lycopène déshydrogénase) pour améliorer l’activité catalytique; La combinaison des gènes dépistés évite la perte d’étapes clés en raison d’un déséquilibre entre les voies métaboliques endogènes et exogènes; L’élimination des gènes de dérivation endogènes augmente l’apport du précurseur acétylcoenzyme A (acétylcoenzyme A, acétyl-coa) et une utilisation équilibrée du NADPH, un système d’induction de glucose pur A été réalisé et une souche ayant le rendement le plus élevé, BS106 (rendement en lycopène de 3,28 g/L), A été créée. Cette souche fournit une référence pour améliorer la compatibilité de S. cerevisiae' S voie hétérologue pour la production de substances précieuses avec le fond endogène. Actuellement, la production microbienne de composés isoprénoïdes, y compris le lycopène, fait face à deux défis potentiels: la voie naturelle MVA ou MEP est limitée par des cofacteurs; Et la plupart des composés d’isoprénoïdes à longue chaîne sont principalement stockés dans un espace limité en raison de leur hydrophobicité, ce qui empêchera leur accumulation à grande échelle [15].
Pour résoudre ces deux problèmes, LUO Z S et al. [16] ont introduit la voie d’utilisation de l’isopentenol (IUP), qui convertit l’isopentenol directement en pip, améliore la voie MVA et augmente le flux de la pip et des produits en aval [14]. La combinaison de l’iup avec une hydrophobicité élevée convertit Y. lipolytica en un organisme producteur de lipides qui est plus favorable à l’accumulation de composés d’isopentenyle liposolubles. Ces stratégies peuvent être largement utilisées à des fins commerciales. P. pastoris a été choisi comme producteur de substances caroténoïdes parce qu’il présente également des avantages commerciaux importants. P. pastoris a une qualité cellulaire élevée et peut atteindre des densités plus élevées que d’autres levures comme S. cerevisiae sans accumuler d’éthanol et sans utiliser divers types de matière organique comme source de carbone. Par conséquent, BHATAYA A et al. [17] ont d’abord appliqué la technologie de génie métabolique à P. pastoris, en concevant et en construisant deux plasmides: le plasmide pGAPZB-EpBPI*P code la superoxyde dismutase ciblée, tandis que le plasmide pGAPZB-EBI* code l’enzyme non ciblée. Après la transformation de ces deux plasmides en P. pastoris, une souche de clone de type v de P. pastoris produisant du lycopène à haut rendement contenant le plasmide pGAPZB-EpBPI*P a pu être criblée, posant les bases du développement de la production de lycopène à l’aide de P. pastoris.
Avec le développement rapide de la biologie synthétique, de l’ingénierie des protéines et de l’ingénierie métabolique, la levure génétiquement modifiée a non seulement amélioré l’efficacité de la production de lycopène, mais a également augmenté l’utilisation de substrats bon marché, réduisant encore davantage les coûts de production. Les micro-organismes synthétiques fourniront sans aucun doute de nouvelles options pour la synthèse hétérologue de produits naturels.
3 bioactivité antioxydante du lycopène
Des études ont révélé qu’il existe un lien entre le développement et la progression de maladies chroniques comme les tumeurs malignes et le stress oxydatif. Le lycopène, en tant qu’antioxydant naturel, a pour effet de réduire les dommages causés par le stress oxydatif. La principale activité antioxydante de la poudre de lycopène est d’agir sur les radicaux libres tels que le peroxyde d’hydrogène, le dioxyde d’azote et les radicaux hydroxyles pour lutter contre l’oxydation des protéines, des lipides et de l’adn. Lorsque le lycopène est exposé à des oxydants ou des radicaux libres, les doubles liaisons peuvent être clivées ou augmentées, détruisant la chaîne du polyène. Les réactions possibles du lycopène avec des substances actives sont [32]: la formation d’adduits, le transfert d’électrons aux radicaux libres et l’extraction d’hydrogène à partir d’allèles (Figure 5). La description suivante se concentre sur la relation entre plusieurs maladies chroniques et le stress oxydatif et la façon dont le lycopène inhibe les mutations qui conduisent à des maladies chroniques.
Les cellules tumorales ont généralement des niveaux excessivement élevés d’espèces réactives d’oxygène (ROS) [33] et éprouvent un stress oxydatif. Les ROS sont des produits métaboliques normaux des cellules qui jouent un rôle clé dans la transduction des signaux. Des niveaux élevés de ROS dans les cellules tumorales sont impliqués dans divers stades de la tumorigénèse, tels que la croissance des cellules tumorales, la prolifération, l’invasion, l’angiogenèse et les métastases [34]. Il a été constaté que le lycopène et le cisplatine ont un effet synergique en inhibant la croissance des cellules humaines de carcinome du col de l’utérus (HeLa). Les taux de survie pendant 72 heures des cellules HeLa traitées avec du lycopène (10 μmol/L) et du cisplatine (1 μmol/L) étaient respectivement de 65,6 % et 71,1 %, et la viabilité cellulaire a diminué à 37,4 % après l’association. En outre, par rapport au groupe témoin, le groupe cellulaire traité au lycopène a montré une expression accrue du facteur nucléaire e2 (NRF2), et le niveau de NRF2 dans le groupe combiné était significativement plus élevé que dans le groupe cellulaire traité au cisplatine seul. Ces résultats indiquent que le lycopène est susceptible d’exercer un effet anticancéreux en activant NRF2 pour atténuer le stress oxydatif [35] (Figure 6).
La régulation anormale du signal NRF2 est associée à de nombreuses maladies liées au stress oxydatif. L’activation de NRF2 est considérée comme un moyen d’induire une capacité antioxydante et d’atténuer la pathologie, principalement par l’induction d’enzymes antioxydantes médiées par le signal NRF2. Dans une autre étude, il a été constaté que le lycopène peut inhibe l’activation du facteur nucléaire κ-light-chain-enhancer des cellules B activées (NF-κB) et l’expression des gènes cibles NF-κB (cIAP1, cIAP2, et survivin) en réduisant les niveaux de ROS intracellulaires et mitochondriaux, induisant l’apoptose dans les cellules cancéreuses PANC-1 du pancréas. Ces résultats suggèrent que la supplémentation en lycopène peut potentiellement prévenir le cancer du pancréas [36].
L’inflammation est le corps ' sa propre réponse de défense. Dans l’équilibre normal du corps, l’inflammation sert à éliminer les facteurs initiaux causant des dommages cellulaires, à éliminer les cellules nécrotiques et les tissus endommagés causés par les dommages et l’inflammation, et à effectuer la réparation tissulaire. Cette réponse naturelle, l’inflammation aiguë, est un mécanisme clé de survie utilisé par tous les vertébrés supérieurs [37-38]. Cependant, si l’inflammation aiguë ne peut pas être résolue, elle peut entraîner une inflammation chronique et peut être un processus destructeur. Les tissus endommagés libèrent dans le corps des cytokines pro-inflammatoires et d’autres médiateurs biologiques inflammatoires.#39; S l’inflammation des tissus de bas grade en inflammation systémique [39]. En outre, les maladies auto-immunes et l’exposition à long terme à des irritants peuvent également conduire à un état inflammatoire systémique. Une réponse inflammatoire excessive affectera négativement le corps et#Les cellules peuvent devenir cancéreuses sous stimulation prolongée de l’infiltration inflammatoire [40]. Des études ont rapporté que le lycopene peut améliorer le trouble mitochondrial induit par le lipopolysaccharide dans le cerveau et le foie des souris, réduire les niveaux d’expression des cytokines pro-inflammatoires TNF-a, IL-1β et IL-6, et soulager la neuroinflammation et l’hépatite [41].
4 Conclusions et perspectives
This paper provides a systematic review of recent research progress on the structure, bioavailability, heterologous microbial synthesis strategies, and protection against oxidative stress in chronic diseases of lycopene powder....... Le lycopène est un membre de la famille des caroténoïdes, et sa capacité antioxydante a des avantages significatifs pour la santé. Cette propriété a suscité un vif intérêt pour son utilisation dans les formulations alimentaires. Pour utiliser ce composé, il est nécessaire de s’assurer que les processus d’extraction et de rétention tiennent pleinement compte des facteurs affectant la stabilité et la biodisponibilité du lycopène afin d’obtenir un produit fonctionnel très efficace et très utilisable.
Il existe de nombreuses techniques traditionnelles d’extraction des substances bioactives, y compris l’extraction mécanique et ultrasonique, et l’extraction avec des solvants organiques sûrs. Cependant, en raison des développements dans divers domaines, de nouvelles méthodes alternatives ont émergé, y compris le mélange à haut cisaillement, l’homogénéisation à haute pression et le traitement microfluidique, qui ont un grand potentiel pour l’extraction du lycopène. En outre, le broyage ultra-fin est une nouvelle option qui non seulement améliore le taux d’extraction du lycopène, mais est également un bon choix pour les solvants de qualité alimentaire. En termes de protection du lycopène, les systèmes d’administration du lycopène sont devenus une méthode alternative pour protéger et améliorer l’utilisation du lycopène dans le corps. Le développement de porteurs de nanoémulsion, de porteurs de lipides nanostructurés, d’hydrogels et de liposomes est un bon choix pour améliorer la protection du lycopène.
In addition, the use of industrial yeast as a host cell to produce lycopene is also a brand new idea. Yeast that does not have a lycopene powder synthesis pathway can become a lycopene-producing strain by introducing genes from an external source. This strategy improves the production efficiency of lycopene and reduces production costs. Under the premise of achieving high lycopene yields, scholars can also develop other effective methods to synthesize other high-value carotenoids.
Référence:
[1]SOUKOULIS C, BOHN T. A comprehensive overview on the micro- and nano-technological encapsulation advances for enhancing the chemical stability and bioavailability of caroténoïdes [J]. Critiques in Food Science and Nutrition,2018,58(1):1-36.
[2]PRZYBYLSKA S. Lycopene-a caroténoïde bioactif offrant de multiples avantages pour la santé: un examen [J]. Revue internationale des sciences de l’alimentation & Technology,2020,55(1):11-32.
[3]LIANG X P, MA C C, YAN X J et al. Progrès de la recherche sur la bioactivité, le métabolisme, la stabilité et les systèmes d’administration du lycopène [J]. Tendances en sciences de l’alimentation & Technology, 2019,93:185-196.
[4]CLINTON S K, EMENHISER C, SCHWARTZ S J, et al. Cis-trans lycopène isomères, caroténoïdes, et rétinoline la prostate humaine [J]. Biomarqueurs d’épidémiologie du Cancer & Prévention,1996,5(10):823-833.
[5]HONDA M, KAGEYAMA H, HIBINO T, et al. Procédé efficace et respectueux de l’environnement pour l’extraction des caroténoïdes de Paracoccus carotinifaciens utilisant des catalyseurs d’accélération de z-isomérisation naturels [J]. Biochimie des procédés,2020,89:146-154.
[6]SHI B, MA T, YE Z L, et al. Ingénierie métabolique systématique de Saccharomyces cerevisiae pour la surproduction de lycopène [J]. Journal of agriculture and Food Che- mistry,2019,67(40):11148-11157.
[7]SHARIFFA Y N, TAN T B, ABAS F, et al. Produire une nanodispersion de lycopène: les effets des émulsifiants [J]. Transformation des aliments et des bioproduits,2016,98:210-216.
[8]HONEST K N, ZHANG H W, ZHANG L. lycopène: isomérisation effets sur la biodisponibilité et les propriétés de bioactivité [J]. Food Reviews International,2011,27(3):248- 258.
[9]FENG L R, QIANG W, YU X B, et al. Effets des lipides exogènes et de l’acclimatation à froid sur la production de lycopène et la composition en acides gras chez Blakesleatrispora[J]. AMB Express,2019,9(1).
[10]MEHTA B J, CERDAOLMEDO E. Mutants de la production de carotène à Blakesleatrispora[J]. Applied Microbiology and Biotechnology,1995,42(6):836-838.
[11]LI C J, ZHANG N, SONG J, et al. Un gène unique de désaturase de la levure rouge Sporidiobolus pararoseus est responsable de la déshydrogénation du phytoène en quatre et cinq étapes [J]. Gene,2016,590(1):169-176.
[12] Sun Ling, Wang Junhua, Jiang Wei, et al. Construction d’une souche de levure de lycopène synthétique à haute efficacité [J]. Chinese Journal of Bioengineering, 2020, 36(7): 1334-1345.
[13]VERWAAL R, WANG J, MEIJNEN J P, et al. Haut niveau Production de bêta-carotène chez Saccharomyces cerevisiae par transformation successive avec des gènes caroténogènes De Xanthophyllomyces dendrorhous[J]. Appliqué et Environmental Microbiology,2007,73(13):4342-4350.
[14]MA T, SHI B, YE Z L, et al. L’ingénierie lipidique combinée à l’ingénierie métabolique systématique de Saccharomyces cerevisiae pour la production à haut rendement de lycopène [J]. Metabolic Engineering,2019,52:134-142.
[15]JING Y W, GUO F, ZHANG S J, et al. Progrès récents sur la synthèse biologique du lycopène en utilisant la levure industrielle [J]. Industrie &; Engineering Chemistry Research,2021, 60(9):3485-3494.
[16]LUO Z S, LIU N, LAZAR Z, et al. Améliorer la synthèse d’isoprénoïde dans Yarrowialipolytica par Exprimer la voie d’utilisation de l’isopentenol et moduler l’hydrophobicité intracellulaire [J]. Metabolic Engineering,2020,61:344-351.
[17]BHATAYAA, SCHMIDT-DANNERT C, LEE P C. Meta- ingénierie bolique de Pichia pastoris X-33 pour la production de lycopène [J]. Process Biochemistry,2009,44(10):1095-1102.
[18]LI X, WANG Z X, ZHANG G L, et al. Amélioration de la production de lycopène chez Saccharomyces cerevisiae par l’optimisation du métabolisme des voies et du châssis [J]. Science du génie chimique,2019,193:364-369.
[19]HONG J, PARK S H, KIM S et al. Production efficace de lycopène chez Saccharomyces cerevisiae par génie enzymatique et augmentation de la flexibilité de la membrane et de la production de NAPDH [J]. Applied Microbiology and Bio- technology,2019,103(1):211-223.
[20]ALSHEHRI WA, GADALLAN O, EDRIS S, et al. Ingénierie méta-bolique de la voie mep pour la surproduction de lvcopène chez Saccharomyces cerevisiae à l’aide de vecteurs pESC-LEU et pTEF1/Zeo [J]. Applied Ecology and Environmental Sesearch,2020,18(4):5279-5292.
[21]ZHANG Y, CHIU T Y, ZHANG J T, et al. Ingénierie systématique de levure synthétique pour une production accrue de lycopène [J]. Bioengineering,2021,8(1):14.
[22]XU X, LIU J, LU Y L, et al. Ingénierie des voies de Saccharomyces cerevisiae pour efficace Production de lycopène [J]. Bioprocess and Biosystems Engineering, 2021,44(6):1033-1047.
[23]BIAN Q, ZHOU PP, YAO Z et al. Biosynthèse hétérologue de la lutéine chez S. cerevisiae facilitée par le contrôle temporospatial des voies [J]. Metabolic Engineering,2021,67:19-28.
[24]SU B L, YANG F, LI A Z et al. La séquence d’activation en amont peut fonctionner comme un isolateur pour la régulation chromosomique des voies hétérologues contre les effets de position chez Saccharomyces cerevisiae[J]. Applied Biochemistry and Biotechnology,2022,194(4):1841-1849.
[25]SU B L, LAI P X, YANG F, et al. Ingénierie d’un métabolisme équilibré de l’acétyle coenzyme a chez Saccharomyces cerevisiae pour la production de lycopène par l’ingénierie rationnelle et évolutive [J]. Journal of Agricultural and Food Chemistry, 2022,70(13):4019-4029.
[26]ARAYA-GARAY J M, FEIJOO-SIOTA L, ROSA-DOS- SANTOS F, et al. Construction de nouvelles souches PichiapastorisX-33 pour la production de lycopène et de bêta-carotène [J]. Applied Microbiology and Biotechnology,2012,93(6):2483-2492.
[27]ZHANG X, WANG D, DUAN Y et al. Production de lycopène par Pichiapastoris métaboliquement modifié [J]. Bioscience,Biotechnology, and Biochemistry,2020,84(3):463-470.
[28]LIU D, LIU H, QI H et al. Construire des voies chimériques de levure pour stimuler la synthèse lipophile du terpène [J]. ACS Synthetic Biology,2019,8(4):724-733.
[29]ZHANG XK, NIE MY, CHEN J et al. Les intégrants multicopies des gènes CRT et la co-expression de l’ampdésaminase améliorent la production de lycopène chez Yarrowia lipolytica[J]. Journal of Biotechnology,2019,289:46-54.
[30]XIE Y X, CHEN S L, XIONG X C. ingénierie métabolique de la levure Yarrowialipolytica non productrice de caroténoïdes pour la biosynthèse de la zéaxanthine [J]. Avant Microbiol,2021, 12:699235.
[31]LIU X Q, CUI Z Y, SU T Y et al. Identification de sites d’intégration du génome pour le développement d’une boîte à outils d’expression génique basée sur le crispr dans Yarrowialipolytica[J]. Microbienne Bio- technology,2022,15(8):2223-2234.
[32]MAGNE T M, BARROS A O D S D, FECHINE P BA, et al. Lycopène en tant que plate-forme multifonctionnelle pour le traitement du cancer et de l’inflammation [J]. Revista Brasileira De Farmacognosia-Brazilian Journal of Pharmacognosy,2022, 32(3):321-330.
[33]LIBBY P, BURING J E, BADIMON L, et al. Athéro-sclérose [J]. Nat RevDis Primers,2019,5(1):56.
[34]GALADARI S, RAHMAN A, PALLICHANKANDY S, et coll. Les espèces réactives d’oxygène et le paradoxe du cancer: promouvoir ou supprimer?[J]. Biologie et médecine des radicaux libres, 2017,104:144-164.
[35]AKTEPE O H, SAHIN T K, GUNER G, et al. Le lycopène sensibilise les cellules cancéreuses du col de l’utérus au cisplatine en ciblant la voie du facteur nucléaire kappaB (NF-kappaB) [J]. Journal turc des Sciences médicales,2021,51(1):368-374.
[36]JEONG Y, LIM J W, KIM H. le lycopène inhibe la signalisation NF-kappaB médiée par l’espèce réactive de l’oxygène et induit l’apoptose dans les cellules cancéreuses du pancréas [J]. Nutriments,2019, 11(4):762.
[37]TODORIC J, ANTONUCCI L, KARIN M. Targeting inflammation in cancer prevention and therapy[J]. Cancer Prevention Research,2016,9(12):895-905.
[38]MEDZHITOV R. origine et rôles physiologiques de l’inflammation [J]. Nature,2008,454(7203):428-435.
[39]ARULSELVAN P, FARD M T, TAN W S, et al. Rôle des antioxydants et des produits naturels dans l’inflammation [J]. Médecine oxydative et longévité cellulaire,2016,(13): 5276130.
[40]SINGH N, BABY D, RAJGURU JP, et al. Inflammation et cancer[J]. Annals of African Medicine,2019,18(3):121-126.
[41]WANG J, ZOU Q H, SUO Y et al. Le lycopène améliore le dysfonctionnement synaptique induit par l’inflammation systémique en améliorant la résistance à l’insuline et le dysfonctionnement mitochondrial dans l’axe foie-cerveau [J]. Nourriture &; Fonction,2019,10(4):2125-2137.
-
Précédent précédent
Le lycopène est-il bon pour la peau?
-
Suivant:
Comment préparer la poudre de lycopène Microcapsule?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



