Quelle est la méthode de préparation de D Tagatose?
D DDDTagatose is A Aarare six-carbon ketose sugar dansnature. Its physical properties Et en plussweetness are similar to sucrose. It has low energy content, can lower blood sugar, improve intestinal flora, Et en plusprevent tootH HHHHhdecay. Foreign researchers have studied its physiological functions Et en plusLa productionmethods dansmore detail, Et en plusD-tagatosehas been used as a low-calorie édulcorantdansLa santédrinks, yogurt, fruit juice, Et en plusfoods pourdiabetics in many countries. dans2001, Le conseil des ministresUL lLa nourritureand Drug Administration (FDA) déterminéthÀ propos deit was generally recognized as sûr(GRAS) [1]. There has been little research on tagatose in China, and Le conseil des ministresre are many problems avecits industrial production and its application also needs to be studied. However, Le conseil des ministresnumber De lapeople with diabetes and cardiovascular diseases is increasing year Par:year in China, and Le conseil des ministresdemand pourfunctional sweeteners is also growing. Therefore, D-tagatosehas great market potential in China.
1 D-tagatose
1. 1 propriétés physiques et chimiques
D-tagatose is an isomer De laD-galactose and a diastereoisomer De laD-fructose (see Figure 1), with a relative molecular mass De la180.16 u. Pure D-tagatose is a white, odorless, non-crystalline substance with a melting point De la134 °C. It is stable in the Le pHrange De la2 to 7. It is highly soluble in water, with a solubility De la58% at 21°C. Its hygroscopicity is similar to that De lasorbitol, and its viscosity of 180 cP (70% (w/w), 20°C) is lower than that of sucrose, slightly higher than that of sorbitol and fructose [2]. Le conseil des ministressweetness is similar to that of sucrose, with a sweetness level of 92% of sucrose, and the calories produced are only 1/3 of sucrose. The U.S. FDA AAhas confirmed it as a low-calorie sweetener with an energy value of 1.5 kcal/g (approximately 6280.2 J/g). In addition, D-tagatose is prone to the Maillard reaction and can caramelize at lower temperatures.
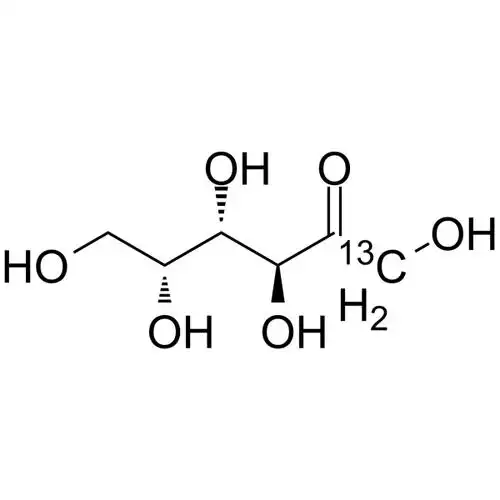
1. 2 fonction physiologique
(1) With low energy content, D-tagatose can be catabolized via the tagatose-6-phosphate pathway, which is present in some microorganisms but not in higher animals [3]. The absorption Taux deof D-tagatose in the small intestine is very low. The part that is not absorbed Par:the small intestine reaches the large intestine and is completely fermented Par:the intestinal microorganisms, producing a large amount of short-chain fatty acids that are almost completely absorbed and metabolized. The fermentation process produces relatively low amounts of energy, and there is also a loss of energy due to the increased excretion of microbial waste products. Therefore, the energy produced by the catabolism of tagatose is much lower than that of sucrose. If tagatose is used to replace sucrose in the diet, it can effectively reduce the incidence of obesity.
(2) abaissement du sucre dans le sang: des études ont montré qu’il n’y a pas de changement significatif dans les niveaux de sucre dans le sang ou d’insuline après l’ingestion de tagatose. Le Tagatose (anglais)inhibe également l’absorption du glucose dans l’intestin grêle, qui peut effectivement réduire l’élévation de la glycémie causée par l’apport de glucose chez les patients diabétiques, et joue un rôle dans le traitement adjuvant pour les patients diabétiques de type 2.
(3) améliore la flore intestinale. D-tagatose est sélectivement fermenté dans le côlon par une certaine flore microbienne, favorisant la croissance de bactéries bénéfiques. C’est un bon prébiotique. En même temps, la grande quantité d’acides gras bénéfiques à chaîne courte produite par la fermentation de D-tagatose a un bon effet sur l’inhibition du cancer du côlon, l’inhibition des bactéries pathogènes intestinales et la promotion de la croissance de bactéries bénéfiques [3]. Par conséquent, D-tagatose peut améliorer la flore intestinale et maintenir la santé intestinale.
(4) Anti-caries: D-tagatose is similar to polyols in protecting teeth....... Comme il produit de faibles niveaux d’acide dans la bouche et ne diminue pas le pH de la plaque, il peut prévenir efficacement l’apparition de caries et l’érosion de l’émail [4].
2 biosynthèse D-Tagatose
D-Tagatosecan be produced by bioconversion or chemical synthesis. Because chemical production of D-Tagatose is prone to the formation of impurities such as fructose, sorbitol and mannose, which require repeated crystallization to remove, this significantly reduces the yield of D-Tagatose. Therefore, bioconversion is being continuously researched as a better method.
Le procédé de bioconversion pour produire du tagatose utilise principalement l’isomérase de L-arabinosepour catalyser la conversion du D-galactose en D-tagatose. La fonction naturelle de la L-arabinoseisomérase (EC 5.3.1.4, L-arabinoseisomérase, L-AI) est de catalyser la conversion entre aldose et kétose conversion mutuelle [5]. La recherche a révélé qu’il peut également catalyser la conversion du D-galactose en D-tagatose, mais son affinité pour le D-galactose est inférieure à son affinité pour le L-arabinose.
2.1 sources L-AI
Les conditions optimales de réaction pour L-AI varient en fonction de la source. La température de réaction optimale pour le L-AI des bactéries mésophiles est de 30 à 50 °C, y compris Alicyclobacillus acidocaldarius, Bacillus halodurans, Escherichia coli et lactobacillesgayon-ii. La température de réaction optimale pour le L-AI des bactéries thermophiles est de 60 à 80 °C, y compris géobacillusstearothermophilus, G. thermodénitrifiantset Thermoanaerobacter mathrani. La température de réaction optimale du L-AI provenant de bactéries hyperthermophiles est de 85 à 90°C, y compris Thermo- toga neapolitana et T. Maritima. Comme le taux de conversion de L-AI en D-tagatose augmente avec l’augmentation de la température, la plupart des sources de L-AI précédentes étaient des bactéries thermophiles, telles que Bacillus stearothermophilusUS100 et Thermoanaerobacter mathrani. Cependant, ces bactéries thermophiles ne sont pas des micro-organismes de qualité alimentaire, et leur salubrité alimentaire est discutable. Par conséquent, les chercheurs ont commencé à utiliser des microorganismes de qualité alimentaire pour produire du D-tagatose.
Les humains utilisent des bactéries lactiques pour produire des aliments fermentés tels que divers produits laitiers depuis des milliers d’années. lactocoqueLactis:est actuellement l’un des organismes les mieux reconnus comme sûrs (GRAS), et il est également un hôte d’expression efficace pour de nombreux produits protéiques différents. De plus, le pH auquel les bactéries lactiques se développent est le même que celui auquel le lactose est hydrolysé, ce qui en fait un excellent choix pour la bioconversion du D-tagatose. Actuellement, les souches de bactéries lactiques de qualité alimentaire qui ont été montrées pour l’expression L-tagatose comprennent Lactobacillus gayon-ii [6], Lactobacillus plantarum[7], Lactobacillus sakei 23K [8], et Lactobacillus fermentum, qui a été découvert en 2011 [9]. (Lactobacillus sakei 23K) [8] et Lactobacillus fermentum [9], une souche alimentaire découverte en 2011. L’utilisation de souches de qualité alimentaire rend la production enzymatique microbienne de tagatose plus sûre.
2. 2 modification moléculaire de L-AI
Bien que le gène araA (qui exprime la protéine L-AI) ait été identifié chez de nombreuses espèces, la production industrielle de L-AI pose encore de nombreux problèmes. Par conséquent, la modification moléculaire de la L-AI pour obtenir une enzyme qui répond aux exigences de la production industrielle est devenue une partie importante de la recherche sur la L-AI. La structure cristalline d’e. coli L-AI a été déterminée, fournissant une base pour l’identification de la molécule responsable de l’isomérisation du galactose en tagatose. Rhimi (en anglais)et al. [10] [traduction]ont déterminé les sites catalytiques et de reconnaissance du substrat essentiels de l’isomérase de L-arabinosede G. stearoothermophilus US100 en fonction de la structure et de la séquence cristallines. Afin d’améliorer le taux de conversion du D-galactose, la modification moléculaire du L-AI se concentre principalement sur l’amélioration de la spécificité du substrat, la résistance à la chaleur et la réduction du pH optimal [11].
L’évolution directe du gène L-AI a été considérée comme la méthode la plus efficace pour améliorer le taux de réaction [12]. Les chercheurs ont obtenu un L-AI mutant de G. stéarothermophiluspar réaction en chaîne de polymérase. L’enzyme présentait trois changements au site des acides aminés par rapport à l’enzyme sauvage, V322M, A393T et A408V. Cette variante de L-AI a amélioré l’activité catalytique vers le D-galactose, la température optimale, l’efficacité catalytique et le rendement de D-tagatose [13]. Le groupe de recherche de Deok-KunOh OhOha effectué une mutagénèse dirigée sur le site de L-AI de G. thermodenitrificans pour obtenir une enzyme avec deux sites mutants (C450S-N475K). L’ia de G. thermodenitrificans a été soumise à une mutagénèse dirigée vers le site pour obtenir une enzyme mutante double (C450S-N475K). Cette enzyme mutante double avait un rendement de D-tagatose de 58%, comparativement à 46% pour l’enzyme de type sauvage [14].
Des études ont montré que Mn2 + et/ou Co2 + sont nécessaires à l’activité et à la stabilité thermique de nombreux L-AI. Toutefois, dans la production de D-tagatose par la méthode enzymatique biologique, l’ajout de fortes concentrations d’ions métalliques augmentera également le coût de post-traitement. Par conséquent, la recherche de L-AI indépendant des ions métalliques avec une stabilité thermique est également devenue une direction majeure de la modification moléculaire L-AI. À l’heure actuelle, la structure tridimensionnelle d’e. coli L-AI a été déterminée, et un site de liaison métallique possible a été spéculé en comparant sa structure cristalline avec la structure cristalline d’e. coli l-tréhalose isomérase [15].
La production industrielle de D-tagatose exige que le L-AI réagise dans la gamme de pH acide. Comme D-tagatose est stable à un pH de 2 à 7, les conditions acides peuvent réduire les réactions de brunissement. De plus, le lactose est habituellement utilisé comme matière première dans la production, et le lactose doit être hydrolysé en galactose d’abord, et l’hydrolyse du lactose se produit habituellement dans des conditions acides (pH 5 à 6). Par conséquent, l’utilisation de la conversion acide L-AI pour produire D-tagatose peut éliminer le besoin d’ajustement du pH et réduire les coûts. La L-AI tolérante à l’acide acquise comprend deux mutants, Q408V et R408V (pHopt 7.5), obtenus à partir d’une mutation dirigée par le site GSAI (pHopt 8.5) [16]. Actuellement, les sites d’acides aminés qui influent sur le pHopt peuvent être déterminés, y compris le Val408 (GSAI) et le Lys269 (AAAI, correspondant au Glu268 de BHAI et au Gln268 de BSAI). A l’avenir, ces deux sites peuvent être mutés ou d’autres sites d’acides aminés affectant le pHopt peuvent être trouvés sur la base de la structure cristalline de L-AI.
2. 3 Expression de L-AI
À l’heure actuelle, Escherichia coli est souvent utilisé comme cellule hôte pour produire la L-AI. Cependant, la production d’endotoxines dans E. coli peut poser un problème de sécurité. Par conséquent, après avoir obtenu le gène L-AI adapté à la production et à l’application industrielles, son expression dans des bactéries génétiquement modifiées de qualité alimentaire est devenue un nouvel axe de recherche. Xu:et al. [17] ont utilisé Lactobacillus fermentum CGMCC2921au lieu d’escherichia coli comme vecteur d’expression de la L-AI et ont obtenu l’expression à grande échelle de la L-AI.À propos de Nooraet al. [18] ont transféré le gène L-AI à la bactérie lactique Lactococcus lactis, permettant l’expression de L-AI dans un système d’expression induit par l’appauvrissement du phosphate.
2. 4 La Productionde d-tagatose à l’aide de biocatalyseurs immobilisés
Après l’obtention de bactéries artificielles à haute expression L - AI, l’immobilisation de l’enzyme ou des cellules productrices d’enzymes est nécessaire pour améliorer la résistance mécanique de l’enzyme et réduire la perte d’activité enzymatique. Le groupe de recherche sur l’oh de l’université nationale de séoul en Corée du Sud a utilisé différentes méthodes d’immobilisation telles que l’adsorption du gel de silice, la microencapsulation, l’incorporation d’alginate de sodium et la réticulation de glutaraldéhyde pour immobiliser le L-AI d’escherichia coli et comparer les effets de différentes méthodes d’immobilisation sur le taux de conversion du D-tagatose. Les résultats ont montré que la préparation enzymatique obtenue en utilisant la méthode du chlorure de sodium alginate-calcium pour obtenir des billes immobilisées puis récroisées avec du glutaraldéhyde avait le meilleur effet.
En comparant la capacité des enzymes libres, des enzymes immobilisées et des cellules immobilisées à produire du D-tagatose, les chercheurs ont constaté qu’en utilisant la même quantité de cellules, le rendement de D-tagatose produit par les cellules immobilisées était le plus élevé. De plus, l’utilisation de cellules productrices de L-AI comme catalyseurs peut mieux protéger l’enzyme, empêcher la dénaturation de l’enzyme, augmenter le nombre de lots de réaction, et réduire les impuretés dans la solution de conversion. Fu Fenggen et al. [19] ont étudié la capacité des cellules recombinantes d’e. coli immobilisées à produire du D-tagatose. Les résultats ont montré que l’utilisation de D-tagatose comme substrat dans des conditions de réaction optimales pendant 24 heures, le taux de conversion le plus élevé de D-tagatose, jusqu’à 65,8 %, et le taux de conversion moyen de 60,6 % pour 8 lots consécutifs, établissant une base pour la production industrielle de D-tagatose.
2.5 influence de l’acide borique sur le rendement en D-tagatose
En plus d’augmenter la température de réaction, une autre façon de déplacer l’équilibre de la réaction vers le D-tagatose consiste à ajouter de l’acide borique [B(OH)4-] au mélange réactionnel. L’acide borique forme des complexes avec différents sucres, montrant généralement une plus grande affinité pour les cétoses que pour les aldoses. Cette propriété a été exploitée, par exemple, pour améliorer la formation de kétose à partir d’aldoses dans la séparation chromatographique des hydrates de carbone. Il a été démontré que les sels de Borate forment un complexe plus serré avec les cétoses, par exemple en se liant plus facilement avec le D-tagatose qu’avec le D-galactose, avec la L-ribulose qu’avec le L-arabinose, et avec la D-allulose qu’avec le D-fructose. En plus d’augmenter la conversion, la présence d’un tampon de borate peut également augmenter la vitesse de réaction.
Il a été rapporté que le D-tagatose, la L-ribulose et le -D-allulose ont des taux de conversion maximaux de 74, 89 et 64%, respectivement, en présence d’acide borique. L’ajout d’acide borique au processus de production de kétose peut briser l’équilibre chimique original et augmenter le rendement du produit cible. L’acide borique contenu dans la solution de conversion est éliminé d’un complexe hydrate de carbone borate à l’aide d’une colonne d’échange d’ions borate spéciale [20], qui n’affecte pas la pureté du produit. Selon Noora et al. [18], le rendement de D-tagatose était de 74% avec de la L-AI dérivée de Thermotoga neapolitana à 60°C, pH 9,0, et avec l’ajout d’acide borique, ce qui était de 24% supérieur à celui du groupe témoin sans acide borique. Fu Fenggen et al. [19] ont étudié l’effet du rapport molaire de l’acide borique au substrat sur le rendement dans le système de réaction d’isomérisation dans une étude sur la production de D-tagatose par des cellules recombinantes d’escherichia coli immobilisées. Les résultats ont montré que l’addition d’une quantité appropriée d’acide borique peut modifier l’équilibre chimique initial et obtenir des rendements élevés de D-tagatose.
2. 6 séparation et purification du D-tagatose
Both the bioconversion and chemical conversion methods use D-galactose as the raw material, and the final reaction product is a mixture of D-tagatose and D-galactose. Therefore, the separation and purification of D-tagatose is also a factor affecting the yield of D-tagatose.
Les méthodes de séparation couramment utilisées comprennent la chromatographie à échange cationique ou la simple séparation de résine. Huang Wenxia et al. [21] [en] ont utilisé la chromatographie de résine échangeuse d’ions Ca2 + et le dessalement et la décoloration de résine échangeuse d’anions et de cations pour séparer et purifier le D-tagatose. Le taux de récupération du D-tagatose a atteint 83%, et la pureté a atteint 98. Le principe de séparation est principalement basé sur la différence dans le degré de complexation des différents monosaccharides avec Ca2 + pour séparer et purifier les monosaccharides. Il a également été rapporté dans la littérature que le D-tagatose peut être purifié en dégradant sélectivement le D-galactose à l’aide d’une cellule de levure de bière (Saccharomyces cerevisiae L1). La pureté du D-tagatose obtenue par cette méthode peut atteindre plus de 95%. Bien que le D-galactose non réagi ne puisse pas être récupéré pour être réutilisé, cette méthode présente les avantages d’une grande efficacité de séparation, d’un faible coût et d’un fonctionnement simple, offrant plus d’options pour la production industrielle de D-tagatose.
3. Applications de D-tagatose
3.1. Applications dans la nourriture
Because D-tagatose has physical properties and sweetness similar to sucrose, and also has physical and chemical properties such as acideresistance, alkali resistance and heat resistance, it has broad application prospects in the food industry as a functional sweetener. It can be used in healthy drinks, yogurt, chocolate, chewing gum, foods for diabetics, diet foods, cereal foods, etc.
Actuellement, les principaux édulcorants couramment utilisés dans l’industrie des boissons sont le cyclamate, l’aspartame, la saccharine, l’acésulfame, la stévia, etc. Ce sont tous des édulcorants forts qui sont susceptibles de produire des arrière-goûts indésirables tels que des saveurs métalliques, amères et astringentes. Toutefois, l’ajout de tagatose ne provoque aucun arrière-goût indésirable. De plus, D-tagatose est un bon prébiotique qui peut être fermenté et utilisé par les probiotiques, favorisant la croissance de probiotiques tels que Lactobacillus casei et Lactobacillus rhamnosus.

Studies have shown that D-tagatose can promote the growth of Lactobacillus casei and Lactobacillus rhamnosus, improve their beneficial activity and survival rate in the intestine. Therefore, D-tagatose can be used in probiotic supplements and also in yogurt, where it provides sweetness while increasing the number of live bacteria in the yogurt, enhancing its nutritional value and giving it a richer, fuller flavor. In 2001, the US Food and Drug Administration officially approved the use of D-tagatose as a sweetener in the food and beverage industry. In 2003, PepsiCo began using tagatose in Sprite drinks, and since then it has been widely used in the United States as a substitute for sucrose in healthy drinks, yogurt, fruit juice and other products.
D le tagatose a la caractéristique d’être sujet à la caramélisation à basse température. Des études ont révélé que le D-tagatose subissant une réaction de Maillard avec des acides aminés produit des substances volatiles comme le 2-acétylfurane, la 2-éthylpyrazine, le 2-acétylthiazole et d’autres substances volatiles que les sucres réducteurs comme le glucose et le galactose[22] [en]. Il est utilisé dans les produits de boulangerie pour produire non seulement une couleur idéale, mais aussi une saveur plus moelleuse. Parce que le tagatose a une viscosité inférieure à celle du saccharose et est facilement cristallisé, s’il est utilisé pour faire du glaçage et appliqué à la surface des aliments à base de céréales, il peut augmenter la douceur du produit et prolonger sa durée de conservation.
3. 2 Applications dans la médecine, les cosmétiques et d’autres domaines
D-tagatose peut être utilisé en médecine comme traitement du diabète de type 2. Des études ont montré que D-tagatose peut réduire les symptômes du diabète de type 2 en réduisant le poids corporel et en augmentant la teneur en lipoprotéines de haute densité (HLP). Il peut également être utilisé dans le sirop contre la toux, les adhésifs pour prothèses dentaires et les désinfectants buccaux. Le D-tagatose est utilisé en cosmétique comme stabilisant et hydratant. Parce que D-tagatose est efficace contre la carie dentaire et la mauvaise haleine, il peut être utilisé dans le dentifrice et les bains de bouche. Actuellement, de nombreux dentifrices utilisent du D-sorbitol ou de la glycérine, ou les deux, comme humectants. Cependant, le D-sorbitol est seulement moitié plus sucré que le saccharose, tandis que le D-tagatose est aussi sucré que le saccharose et a une hygroscopicité semblable à celle du sorbitol. L’ajout de D-tagatose au dentifrice et au rince-bouche peut améliorer la douceur et répondre aux exigences gustatives tout en maintenant une bonne mouillabilité et stabilité.
Référence:
[1] [traduction] À propos de Levin G GG V. : les femmes Tagatose, a Nouveau: GRAS sweetener and health Produit [J]. J J JJ J Ce qui est Food,2002,5 :23-36.
[2] [traduction] Oh D K. Tagatose: Propriétés, Application, and Procédés biotechnologiques [J]. Application de la loi Microbiol Biotechnol,2007,76:1-8.
[3] Mu Wanmeng, Zhang Tao, Jiang Bo, et al. D D - progrès de la recherche sur le tagatose et l’isomérase L-arabinose [J]. Food and Fermentation Industry, 2007, 33: 84-90.
[4] le monde D. édulcorant determined safe in Médicaments, bains de bouche et dentifrices [J]. Dent Today,2000,19:32,34-35.
[5] Liang Min, Zhai Yafei, Zou Yang, et al. Application et production du nouvel édulcorant tagatose [J]. Food and Drugs, 2011, 13: 125-128.
[6] Cheetham P S, Wootton A N ° de catalogue Bioconversion De D — galactose Dans le D- tagatose [J]. Enzyme Microb Technol,1993,15:105-108.
[7] Chouaye K k h L, l, l, Rhimi M, et Al., et al. caractérisation of An L arabinose isomérase À partir de the Lactobacillus plantarum NC 8 souche montrer prononcé stabilité at Acide acide pH [J]. FEMS Microbiol Lett,2007,277 :260-267.
[8] [traduction] Rhimi M, Ilhammami R, Bajic G, et Al., et al. The acid tolérante L arabinose isomérase de la qualité alimentaire Lactobacillus sakei 23 K est un attrayant D-tagatose Le producteur [J]. Bioresour Technol, 2010, 101:9171-9177.
[9] [traduction] Xu Z, Qing Y J, Li S, et Al., et al. A Le roman L-arabinose isomérase De Lactobacillus fermentum CGMCC2921 for D-tagatose Production: clonage, purification et caractérisation de gènes [J]. J Mol Le CatalB: Enzym,2011,70:1-7.
[10] Rhimi M, Juy M, Aghajari N, et al. Sonder le Résidus catalytiques essentiels and the substrat affinité in the thermoactif Bacillus stéarothermophilus US100 L-arabinose isomérase by Mutagenèse dirigée sur le site [J]. J J J Bactériol 2007,189:3556-3563.
[11] [traduction] Kim P. 1 et 2. actuel Études de cas Sur la production biologique de tagatose à l’aide de L -arabinose isomérase: a Revue de presse and Le futur Point de vue [J]. Application de la loiMicrobiol Biotechnol,2004,65 :243-249.
[12] [en] Kim P, Yoon S H, référencement N ° de catalogue J, et Al., et al. amélioration of Conversion de tagatose rate by génétique évolution of thermostable Galactose isomérase [J]. Les biotechnologies Application de la loi Accueil» Biochem2001,34 :99-102.
[13] Kim H J, Kim J H, Oh H J, et al. caractérisation of a Géobacillus muté stearothermophilus L-arabinose isomérase Cela augmente le taux de production de D-tagatose [J]. J Appl Microbiol, 2006,101:213-221.
[14] Oh H J, Kim H J, Oh D K. Augmentation du taux de production de D-tagatose par site dirigé Mutagenèse de L-arabinose isomérase De Geobacillus thermodenitrificans [J]. Les biotechnologies N ° de catalogue 2006, 28:145-149.
[15]Oh! D K. Tagatose: propriétés, applications, et Procédés biotechnologiques [J]. Application de la loi Microbiotechnol,2007,76:1-8.
[16] [traduction] Oh D K, Oh H J, Kim H J, et al. Modification du pH optimal dans L arabinose isomérase À partir de Geobacillus stearothermophilus for D — isomérisation du galactose [J]. J J J À propos de Mol Catal B-Enzym,2006,43 :108 - íîâîñèáèðñê, 2000.
[17] Xu Z, l L, f F, et Al., et al. Production of D-tagatose, a Édulcorant fonctionnel, utilisant l’alginatlactobacillus fermentumCGMCC2921Cells immobilisé [J]. Appl Biochem Biotechnol, 2012,166 :961-973.
[18] [traduction] Noora L, Kalle L, Matti L, et Al., et al. D-Tagatose production in the
Présence de borate by Se reposer Lactococcus lactis cellules Héberger Bifidobacterium longum L-arabinose isomérase [J]. Bioprocess Biosyst Eng,2013,36:489-497.
[19] Fu Fenggen, Xu Zheng, Li Guixiang et al. Production de D-tagatose à l’aide de cellules recombinantes d’escherichia coli immobilisées [J]. Chinese Journal of Bioengineering, 2011, 31: 85-90.
[20] Hicks K B, Simpson G L, Bradbury A G. Les conditions de travail enlèvement of Le borique Acide et liés composés À partir de Solutions solutions of Acides carboxyliques Avec bore - sélectif Résine (IRA - 743) [J]. Carbohydr Res,1986, 147 :39-48.
[21] Huang Wenxia, Mu Wanmeng, Jiang Bo. Séparation et purification du D-tagatose [J]. Food and Fermentation Industry, 2008, 34: 168-171.
[22] In H D, Sarah L, Hae-Roung J, et Al., et al. Comparaison des données of Maillard Volatile réaction Produits produits À partir de Tagatose and Autres: Réduction des sucres with Aminé: acides [J]. Food Sci. Sci. Biotechnol,2010, 19: 431-438.
-
Précédent précédent
Quels sont les avantages de D Tagatose?
-
Suivant:
Poudre d’érythritol de quoi est-il fait?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




