Quelle est la méthode de Production de la poudre D Allulose?
1 D-Allulose vue d’ensemble
D Allulose is A Aahexose Le sucreEt en plusA aC-3 epimer De laD-fructose. Due to its high sweetness, low energy content, unique physiological functions Et en pluspotential health benefits, D-allulose is considered to be A anew sweetener avecgreat potentiAl., et al.It hEn tant quebecome A aresearch hotspot in Le conseil des ministresfield De larare sugar biosynthesis worldwide. However, D-allulose is extremely rare in nature Et en plusdifficult to synthesize chemically. The biosynthetic method, Sur lethe other hand, hEn tant quea simple procedure Et en plushas made great breakthroughs in recent years. Therefore, the author reviews the recent research progress in the biosynthesis De laD-allulose, including the physicochemical properties, physiological functions, applications, in En directmetabolism, Et en plusenzymatic productiSur leof D-allulose, covering the sources, enzymatic properties, crystal structures, catalytiquemechanisms, heterologous expression, and separatiSur leand purificatiSur leprocesses of the key enzymes involved.
1.1 propriétés physico-chimiques et sources de D-allulose
D-Allulose is a six-carbon sugar with a melting point of 96 °C, soluble in water, and a density of 1.35 g/cm3[1]. The sweetness De D-alluloseis 70% Que celaof sucrose[2]. D-Allulose is a reducing sugar and can participate in browning réactionsduring heat treatment. The calorific value of D-allulose was measured to be 0.029 kJ/g in a rat experiment, which is 0.3% of the energy of sucrose, indicating that D-allulose has almost zero energy [3-4]. D-allulose is very rare in nature, and plant sources are extremely rare [5]. Small amounts of allulose have also been found in some bacteria [6], and D-allulose is not found in animals. allulose has not been found in animals. However, D-allulose is also found in various foods, such as fruit juice that has undergone long-term heating treatment, and the content of D-allulose in various foods is closely related to the sugar concentration, temperature and heating time during the La productionprocess [2, 7].
1.2 fonctions physiologiques et métabolisme de la D-allulose dans le corps
The physiological functions of D-alluloseRéduire l’absorption du D-fructose et du D-glucose alimentaires [8-9]; Améliorer la résistance à l’insuline [7, 10-11]; Activité anti-obésité [12-14]; Et abaisser les lipides sanguins [15]. Des études sur la voie métabolique de la D-allulose chez le rat ont montré que: 1) le transport de la D-allulose dans l’intestin est médié par le transporteur de glucose 5, eta une affinité plus faible pour le D-fructose [16-18]; 2) D-allulose n’est pas impliqué dans le métabolisme lié au glucose [19]; 3) la D-allulose ne peut pas être métabolisée dans le foie animal et ne peut donc pas favoriser la production d’énergie du foie [20]. Environ 98% de D-allulose est excrété du corps sous forme d’urine et de matières fécales après administration orale ou intraveineuse, et seule une petite quantité de D-allulose est décomposée en acides gras à chaîne courte par l’action des microorganismes présents dans le cécum [21].
1.3 Applications de D-allulose
D-Allulose a été approuvé en tant que produit généralement considéré comme sûr (GRAS) par la FDA des États-Unis en 2011 et est autorisé comme ingrédient alimentaire et complément alimentaire [4, 7]. Des études ont montré que l’apport maximal de D-allulose est de 0,55 g par kg de poids corporel par jour, et qu’il ne causera pas de diarrhée chez les humains dans cette fourchette [8-9].
D-Allulose has broad market potential in the food industry due to its low calorie content, high sweetness and strong reducing properties. For example, D-allulose can comprehensively improve the properties of egg white protein through the Maillard reaction, such as excellent gel strength, emulsifying stability, foaming properties and antioxidant activity [22-23]. D-allulose can also improve the quality of fermented milk products, regulating the strong sour taste of yogurt caused by overfermentation, but does not affect the probiotic activity of the fermentation strain and the probiotic health benefits it imparts to the fermented product [ 21]. In addition, the use of 25% D-allulose in baking, in combination with other additives, can produce sugar-free cakes [24].
D-Allulose a également un large potentiel d’application dans d’autres domaines. Par exemple, les matériaux végétaux fabriqués à partir de D-allulose peuvent être utilisés comme films permanents, imperméables, respectueux de l’environnement, transmettant la lumière pour les appareils optiques et les écrans à cristaux liquides [25]. Le D-Allulose est également le premier insectifuge à base de sucre découvert, et a quelques effets positifs en inhibant la croissance des parasites [26-27]. La D-allulose est également un précurseur d’autres hexoses et joue un rôle extrêmement important dans la production de D-allose [28-29[traduction]et le D-allitol [30] joue un rôle extrêmement important.
2. Méthode enzymatique biologique
Le produit chimiquesynthesis method of D-allulose has common disadvantages that are difficult to overcome, such as difficulties in isolation, many by-products, and the generation of chemical waste. Therefore, the green and environmentally friendly biological enzyme production method has gradually received widespread attention worldwide.
2.1.1 Source des enzymes de la famille des dteases
La famille des D-tagatose 3-éimerase (DTEases) est une enzyme qui catalyse l’isomérisation des keto monosaccharides en position C3 et est également l’enzyme de base pour la production de sucres rares [32]. La famille des enzymes DTEase comprend: D-tagatose 3-émaréase (DTEases) [33], D-allulose 3-émaréase (DAEase) [35], kétose 3-émaréase [36], qui ont toutes la propriété commune de catalyser la conversion du D-fructose en D-allulose.
Le gène codant pour la DTEase a été isolé séquentiellement à partir de Clostridiumcellulolyticum H10[37], de Ruminococcus sp.[38], de Clostridium scindens[34] et de Desmospora sp.[35], mais il est encore nécessaire d’exploration d’autres sources et de DTEase plus efficace [32, 37, 39-40] pour la production industrielle de D-allulose.
2.1.2 propriétés enzymatiques de la DTEase
Parmi la famille des enzymes DTEase, la D-allulose-3-epimérase(DTEase) est la plus efficace pour catalyser la réaction du D-fructose à la D-allulose. L’efficacité catalytique (Kcat/Km) des DAEases de C. cellulolyticum et A. tumefaciens est respectivement de 186,4 et 205 L/(mmol·min), ce qui est supérieur à celui de la DTEase (D-tagatose 3-epimerase) de Clostridium sp. (141,4 L/(mmol·min)) et Ruminococcus sp. (51 L/(mmol·min)) [34, 37-38], voir tableau 1.
Les ions métalliques sont fixés par liaison au D-fructose et jouent un rôle crucial dans la conversion du D-fructose en D-allulose. Les résidus Asp183 et His209 lient efficacement le substrat à travers les ions métalliques. La famille des enzymes DTEase a des degrés significativement différents de dépendance aux ions métalliques Mn2+, Co2+ et Mg2+ [41,44-45]. Cependant, l’activité enzymatique de DAEase de C. cellulolyticum et de DTEase de C. scindens est strictement dépendante des ions métalliques Mn2+ et Co2+[35,37].
2.1.3 structure cristalline de la DTEase
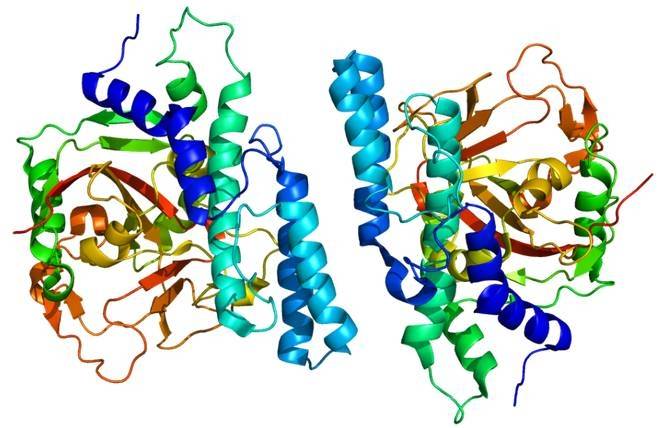
Parmi la famille des enzymes DTEase, les DAEases d’a. tumefaciens et de C. cellulolyticum présentent la forme la plus proche du tétramère. Dans le tétramère de DAEase, 34 liaisons hydrogène sont formées entre les résidus d’acides aminés dans les deux sous-unités. La forte activité catalytique de DAEase est attribuée à la vaste zone interfaciale accessible au solvant, qui est causée par des interactions étendues entre les deux dimers de l’enzyme de la famille DTEase [42]. En outre, le DAEase exprimé par des souches recombinantes présente encore d’excellentes propriétés enzymatiques. L’expression hétérologue de DAEase de C. cellulolyticum H10 a une demi-vie plus longue, des paramètres cinétiques plus élevés et une stabilité thermique plus élevée [37].
L’arrangement quaternaire de DAEase est une unité asymétrique composée de quatre sous-unités identiques A, B, C et D. le site actif contient quatre résidus de l’ion métallique, coordination octaédrique de deux molécules d’eau. Ces quatre sous-unités sont des dimères apparentés par symétrie cristalline, dans lesquelles les sous-unités A et D interagissent entre elles, toutes deux en contact étroit avec les sous-unités B et C. le site actif de DAEase est exposé sur la même face antérieure du dimère. Ces dimères stables offrent une excellente surface accessible pour fixer les substrats sur la face avant du dimère [16].
La rainure hydrophobe du site actif et la surface accessible sont situées entre les sous-unités A et B. Le côté sous-unité de DAEase est fermé et exposé aux deux extrémités de la structure du baril. Dans le tétramer de DAEase, les deux dimères sont enfermés sur les côtés de la structure du baril. Chaque monomère (sous-unités A, B, C et D) est composé de 8 unités répétées de structures (β/α). Chaque monomère est composé de 13 hélices α et de 8 plis β, formant la structure principale du monomère [16].
2.1.4 mécanisme catalytique de la DTEase
L’action catalytique de la famille des enzymes DTEase dépend de la disposition moléculaire des sous-unités. Leurs sites actifs sont situés sur le substrat pour obtenir des réactions enzymatiques efficaces. Mn2+ et deux molécules d’eau et quatre acides aminés (Glu, Asp, His et Glu) forment une coordination octaédrique, et ces quatre résidus d’acides aminés sont complètement conservés dans toutes les kétose 3-epiméases. Six résidus (Glul50/Glul52, Aspl83 / Aspl85, His209 / His211, Glu244 / Glu246, Glul56/ Glu158, His185/His188) de DAEase chez A. tumefaciens et DTEase chez P. cichorii sont importants pour la fixation du substrat et la stabilité thermique lors de la mutagénèse dirigée vers le site.
Après que le substrat remplace la molécule d’eau, le site actif subit une diastéréoisomérisation. Deux résidus, le Glu50 et le Glu244, en collaboration avec Mn2+, éliminent le proton C3 de D-fructose pour former le cis-diol intermédiaire de D-allulose, et la D-allulose est libérée de la position entre la liaison hydrogène et la molécule d’eau sur le site actif DAEase.

Actuellement, des modifications moléculaires sont en cours sur des enzymes de la famille des dteases afin d’améliorer leur activité catalytique et leur stabilité thermique. La mutagénèse dirigée par le site a été utilisée pour améliorer la stabilité thermique et le comportement catalytique de l’isomérase de L-rhamnoseprovenant d’obsidiansis caldicellulosirupteur dans la production de D-allulose. Les résidus hydrophobes de la boucle β1-α1 ont été complètement remplacés par des acides aminés polaires. Comparativement à l’enzyme de type sauvage, les activités relatives des mutants V48N/G59N/I63N et V48N/G59N/I63N/F335S ont des activités relatives respectivement supérieures de 105,6 % et de 134,1 % à celles de l’enzyme de type sauvage [57]. La mutagénèse dirigée sur le site a également amélioré la stabilité thermique de la d-allulose-3-epimérase (DAEase) de Dorea sp. [50].
La recherche sur le mécanisme catalytique des enzymes de la famille des dteases en est encore à ses débuts, et la relation entre la structure enzymatique et la fonction catalytique nécessite des études plus approfondies. En outre, la stabilité thermique et la spécificité du substrat de DTEase présentent encore quelques lacunes. Dans la production de sucres rares, la spécificité du substrat des enzymes de la famille des dteases devrait être davantage utilisée pour atteindre la production efficace et verte de sucres rares fonctionnels.
2.1.5 expression hétérologue de la DTEase
La plupart des enzymes de la famille DTEase ont été identifiées et isolées à partir de bactéries, et le nombre d’enzymes exprimées en souches naturelles est loin de répondre aux exigences des applications. Par conséquent, la construction de vecteurs d’expression et leur expression dans des organismes hétérologues est d’une grande importance dans les études de caractérisation et les applications enzymatiques.
Bacillus subtilis, Escherichia coli et la levure sont couramment utilisés pour construire des systèmes recombinants pour l’expression des DAEase. Contrairement à E. coli, Bacillus subtilis n’a pas de membrane externe, de sorte que les protéines qu’il sécrète peuvent être libérées directement dans le milieu de culture. Bacillus subtilis est également de qualité alimentaire et ne sécrète pas de lipopolysaccharides calorifères (endotoxines) dans les protéines qu’il sécrète. La bactérie génétiquement modifiée Escherichia coli (E. coli) présente les avantages d’un contexte génétique clair, d’un système complet de récepteurs vectoriels, d’une croissance rapide, d’une culture simple et d’une stabilité recombinante. De plus, le système d’expression de levure présente les caractéristiques de conditions de culture simples, de croissance rapide, de niveaux d’expression élevés et de fonctionnement simple. Après la traduction, la protéine peut être traitée et correctement modifiée. Les inconvénients du système d’expression de la levure sont une faible expression génétique clonée, un long temps de fermentation, une glycosylation incorrecte des protéines et une résistance à la division cellulaire. De plus, la forte concentration de polysaccharides dans le surnageant n’est pas propice à la purification des protéines recombinantes.
Les premiers chercheurs avaient tendance à utiliser E. coli comme bactérie hôte pour étudier l’expression et l’enzymologie des enzymes de la famille des dteases [34, 37]. Récemment, de nombreux chercheurs ont utilisé Bacillus subtilis et la levure comme bactéries hôtes pour exprimer des enzymes de la famille DTEase pour la production de D-allulose [35]. Le gène DAEase d’a. tumefaciens a été exprimé dans E. coli et K. marxienaprès recombinaison et utilisé pour la production d’allulose, et les rendements de D-allulose ont atteint 230 g/L [53] et 190 g/L [56] respectivement. Comparativement, l’enzyme DAEase exprimé dans A. tumefaciens à l’aide du système d’expression E. coli a le niveau d’expression le plus élevé à ce jour, comme le montre le tableau 2.
(1) (1) Système d’expression E. coli: le système d’expression E. coli présente les avantages d’un faible coût et d’une efficacité d’expression élevée. La famille des enzymes DTEase peut être surexprimée dans E. coli sous forme de protéines solubles. L’enzyme DTEase recombinante est séparée et purifiée par chromatographie d’affinité, et le rendement de D-allulose est de 120-218 g/L, avec un taux de conversion de 24%-33% [34]. Le rendement et l’efficacité de conversion de l’enzyme DAEase exprimé dans Escherichia coli recombinant à l’aide de la méthode de réponse de cellules entières d’agrobacterium tumefaciens étaient respectivement de 230 g/L et de 33% [53].
(2) système d’expression du bacille: le Bacillus subtilis Recombinant portant le gène codant DAEase peut surexpress l’enzyme DAEase de manière à haute efficacité et à faible coût. Le DAEase Recombinant immobilisé sur une matrice de résine d’échange anionique peut favoriser la production stable et efficace d’allulose. Le DAEase recombinant exprimé dans Bacillus subtilis B. subtilis a une activité de 58,6 U/mg, ce qui est plus élevé que chez E. coli (8,95 U/mg). En outre, l’élément régulateur de l’expression de DAEase affecte également la quantité et l’activité de l’enzyme. Chez Bacillus subtilis B. subtilis, le vecteur pMA5- Pxy/A-RDPE peut exprimer de façon stable DAEase avec une activité enzymatique de 95 U/mL. Cette valeur est supérieure à l’activité enzymatique exprimée dans E. coli E. coli avec le vecteur pBluescript-SK-DTE [54].
3) système d’expression de levure:
The exogenous DAEase gene can be highly expressed in recombinant S. cerevisiae [55] and Kluyveromycesmarxianus [56]. The expression vector pRS424-TEFpr-ss-xy/A, which carries the DAEase gene À partir deA. tumefaciens, can express a protein with a relative molecular mass of 33 000 in S. cerevisiae AN120 [55]. The xylose isomérasegene À partir deT. thermophilus and the DAEase gene À partir deA. tumefaciens are co-expressed in yeast spores to enhance synergistic catalysis. The two recombinant enzymes were immobilized and D-allulose was produced En utilisantD-glucose as the substrate [55]. The recombinant xylose isomerase catalyzes the conversion of D-glucose to D-fructose, and the recombinant DAEase converts D-fructose to D-allulose. Yang et Al., et al.provided a valuable approach to regenerate modified K. marxianus cells, which can produce D-allulose in a recycling catalytic manner [56]. The recombinant K. marxianus produced 190 g/L D-allulose from a substrate concentration of 750 g/L D-fructose within 12 h, and about 100 g of residual D-fructose was converted by the engineered bacteria into 34 g of ethanol. In addition, the idea of producing D-allulose by whole-cell bioLa catalysehas also been proposed [56].
2.2 séparation et purification de la D-allulose
The separation and purification of D-allulose mainly includes the following two methods: The first method is ion exchange resin. Anion exchange resin matrix and simultaneous moving bed chromatography were used to immobilize DAEase enzyme to produce D-allulose from D-fructose as a substrate. Using ion exchange resin dialysis, R. sphaeroides SK011 cellulescan produce 6.5 g/L D-allulose from an initial substrate concentration of 50 g/L D-fructose [39], with a production rate of 0.82 g·h-1. For a mixed system containing D-allulose and D- fructose, D-allulose was first converted to gluconic acid and then purified to 91.2% by anion exchange resin [57].
La deuxième méthode utilise une méthode biologique pour purifier la D-allulose. Dans un système mixte contenant du D-allulose et du D-fructose, la D-allulose a été obtenue en utilisant de la levure pour consommer le D-fructose restant et produire de l’éthanol. De plus, une combinaison d’évaporation osmotique, de chromatographie à échange cationique et de méthodes biologiques a été utilisée pour séparer et purifier le D-allulose, d’une pureté allant jusqu’à 86,2% [58].
3 Discussion
D-Allulose est l’epimer C-3 du D-fructose, qui a de nombreuses fonctions physiologiques et est largement utilisé dans la nourriture, la médecine et les soins de santé. Après que la FDA américaine a adopté une mesure favorable en avril 2019 pour exclure l’allulose du comptage des sucres ajoutés et des sucres totaux, les grandes entreprises ont commencé à prendre un grand intérêt pour l’allulose. Actuellement, le monde et#39; S principaux producteurs de D-allulose, dont la Corée du Sud.#39; S cjce CheilJedang, Royaume-Uni#39; S Tate &Lyle et le Japon#39; S Matsutani groupe, tous utilisent des méthodes biologiques pour produire de la D-allulose. Par conséquent, la construction de bactéries génétiquement modifiées qui peuvent catalyser la production de D-allulose est une base importante pour l’industrialisation de D-allulose. Bien que l’allulose ne puisse actuellement être utilisée légalement que dans quelques pays, il est certain qu’elle deviendra un édulcorant majeur à l’avenir.
Although there have been major breakthroughs in the research of the biological enzyme method pourD-allulose, in particular the rapid development of gene mining and cell construction technology, the industrial prospects pourthe biological production of D-allulose remain uncertain. Subsequent research can be carried out in the following two areas: 1) screening DTEase family enzymes with high activity and stability through gene mining methods, establishing efficient high-throughput screening methods, and molecularly modifying DTEase family enzymes to better meet the needs of industrialization, thereby achieving efficient conversion of D-fructose and D-allulose; 2) since the industrial preparation of D-allulose faces the problem of removal of residual D-fructose in the mixture after enzymatic catalysis, the separation and purification of D-allulose increases its production cost. At present, there are relatively few studies on the separation and purification and crystallization of D-allulose, indicating that downstream industrialization is relatively lagging behind. It is necessary to further reduce the industrial production cost of D-allulose and improve the production efficiency of D-allulose by simplifying downstream process steps, such as separation and purification, crystallization, drying and other process steps.
La Figure 1 montre une technologie de procédé écologique et recyclable plus avancée pour le D-allulose [16]. L’ensemble du système de réaction est divisé entre le bioréacteur A (pour l’hydrolyse du saccharose et la conversion enzymatique en D-allulose) et le bioréacteur B (pour la production d’éthanol, la séparation D-allulose et la propagation de la levure). Le jus de canne à sucre brut ou le jus de sorgho doux est utilisé comme matière première pour produire du saccharose. La levure modifiée utilisée contient de l’isomérase naturelle du saccharose et un gène d’enzyme exogène recombinant de la famille de la DTEase, de sorte que la levure modifiée peut produire du D-glucose et du D-fructose en hydrolysant le saccharose avec de l’isomérase du saccharose. Le D-fructose est converti en D-allulose par l’enzyme de la famille DTEase à 55~60 °C, et le reste du D-glucose et du D-fructose sont fermentés pour produire de l’éthanol à 27-30 °C, et l’éthanol peut être recueilli et utilisé comme carburant. Les avantages de cette méthode sont les faibles coûts des matières premières, l’utilisation de produits intermédiaires générés au cours du processus autant que possible, la réduction des lourdes étapes de séparation et de purification, ainsi que la réduction de la formation de déchets, une consommation d’énergie plus faible et des rendements plus élevés en sucre.
4 perspectives
Actuellement, le D-allulose est produit industriellement à la tonne en Chine, au Japon, en Corée du Sud, aux États-Unis et au Royaume-Uni. Pour se démarquer dans la concurrence féroce de l’industrie, les entreprises produisant D-allulose doivent améliorer la technologie de chaque maillon dans le processus. Actuellement, les principaux obstacles à la production sont la faible activité de l’isomérase, le faible taux de conversion et la faible fréquence de réutilisation. Par conséquent, l’amélioration de l’activité enzymatique, de la stabilité et de l’efficacité catalytique devraient être les objectifs clés de la recherche et du développement futurs de la famille des enzymes DTEase. Le coût de production de D-allulose peut être réduit en améliorant les processus de décoloration, dessalement, cristallisation et séchage. La conception rationnelle ou la modification de procédés déraisonnables utilisant une technologie efficace de criblage à haut débit est un moyen direct de changer la structure de la famille des enzymes DTEase. En améliorant la famille des enzymes DTEase et en améliorant le processus de production, le coût de production de D-allulose peut être réduit et son prix abaissé, assurant ainsi que D-allulose peut être facilement fourni aux consommateurs.
Référence:
[1] FUKADA K,ISHII T,TANAKA K,et Al., et al.Structure cristalique, solubilité et mutarotation du rare monosaccharide D-psicose[J]. Bulletin of the Chemical Society of Japan,2010,84(6):678-678.
[2] OSHIMAH,KIMURA I,IZUMORI K. Psicosecontents dans divers produits alimentaires et son origine [J]. Food Science and Technology Research,2006,12(2):137-143.
[3] MATSUO T,SUZUKI H,HASHIGUCHI M,et Al., et al.D-psychoseest le sucre d’arare qui ne fournit aucune énergie aux rats en croissance [J]. Journal of Nutritional Science and Vitaminology,2002,48(1):77-80.
[4] U uW,ZHANG ZHANGW,FENG Y,et Al., et al.Progrès récents sur les applications et la production biotechnologique de D-psicose[J]. Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[5] Benjamin J Ayers,Jacqueline Hollinshead,Alexander W Saville,et Al., et al.Iteamine, le premier alcaloïde isolé de Iteavirginica L. en florescence[J]. Phytochemistry,2014,100(2):126-131.
[6] ] ZHANG L,MU W,JIANG JIANGB,et Al., et al.Caractérisation De D-tagatose-3-epimérasede Rhodobacter sphaeroides qui convertit le D-fructose en D-psicose[J]. Biotechnology Letters,2009,31:857-862.
[7] ZHANG W,YU S,ZHANG T,et Al., et al.Recent advances in D-allulose:physiological fonctionnalités,applications,and biological production[J]. Trends in Food Science and Technology,2016,54(54):127-137.
[8] HOSSAINA,YAMAGUCHI F,HIROSE K,et Al., et al.Rare Raresucre D — psychoseempêche la progression et le développement du diabète dans le modèle T2DM Otsuka Long-Evans Tokushima rats gras [J]. Drug Design,Development and Therapy,2015,9:525-535.
[9 ] HOSSAIN A,YAMAGUCHI F,MATSUO T,et Al., et al. Rare sugar D-allulose: potentiel Rôle de la commission and thérapeutique surveillance Dans le maintien de l’obésité et du diabète sucré de type 2 [J]. Pharmacologie & Therapeutics,2015,155:49-59.
[10] HOSSAIN M A,KITAGAKI S,NAKANO D,et Al., et al.Rare sucre D — psychoseaméliore la sensibilité à l’insuline et la tolérance au glucose dans le diabète de type 2 Otsuka Long-Evans Tokushima rats gras (OLETF) [J]. Biochemical and Biophysical Research communications,2011,405(1):7-12.
[11] OCHIAI M,NAKANISHI Y,YAMADA T,et Al., et al.Inhibition par D — psychosealimentaire de l’accumulation de graisse corporelle chez les rats adultes nourris avec un régime à haute teneur en saccharose [J]. Bioscience biotechnologie & Biochemistry,2013,77(5):1123-1126.
[12] CHUNG Y M,LEE J H,KIM D Y,et Al., et al.Diététique D-psicose réduit la masse grasse viscérale chez les rats obèses riches en graisses induits par l’alimentation [J]. Journal of Food Science,2012,77(2):H53-H58.
[13] CHUNG MY,OH DK,LEE KW. Avantages hypoglycémiques pour la santé de D-psicose[J]. Journal of Agricultural and Food Chemistry, 2012,60(4):863-869.
[14] IIDA T,YAMADA T,HAYASHI N,et al. Réduction de l’accumulation de graisse abdominale chez les rats par l’ingestion de 8 semaines d’un édulcorant nouvellement développé à partir de sirop de maïs à haute teneur en fructose [J]. Food Chemistry,2013,138(2-3):781-785.
[15] OCHIAI M,ONISHI K,YAMADA T,et al. D-psicose augmente la dépense énergétique et diminue l’accumulation de graisse corporelle chez les rats nourris avec un régime à haute teneur en saccharose [J]. International Journal of Food Sciences and Nutrition,2014,65(2):245-250.
[16] [traduction] JIANG L,XIAO L,ZHU X,et al. Revue de presse on D-allulose: en vivo Métabolisme, catalytique Mécanisme, ingénierie Construction de souches, technologie de bio-production [J]. Frontières en bioingénierie et biotechnologie,2020,8:26.
[17] [traduction] A couru G,TAN D,ZHAO J,et al. Billes fonctionnalisées de polyhydroxyalkanoatenano- as a Biocatalyst stable for Production rentable du rare sucre D-allulose[J]. Bioresource Technology,2019,289:9-18.
[18] KISHIDA K,MARTINEZ G,IIDA T,et al. D-allulose est un substrat du transporteur de glucose de type 5(GLUT5) dans l’intestin grêle [J]. Chimie alimentaire,2019,277:604-608.
[19] IWASAKI Y,SENDO M,DEZAKI K,et al. La libération de GLP-1 et l’activation afferente vagale médient les effets métaboliques et chronothérapeutiques bénéfiques de D-allulose[J]. Nature Communications,2018,9:17-25.
[20] MAENG H J,YOON J H,CHUN K M,et al. Stabilité métabolique de la D-allulose dans les milieux biopertinents et les hépatocytes: comparaison avec le fructose et l’érythritol [J]. Food,2019,8:13-18.
[21] KIMOTO-NIRA H,MORIYA N,HAYAKAWA S,et al. Effets de rare Sucre D-allulose on Production d’acide Et les activités probiotiques des bactéries lactiques laitières [J]. Journal of Dairy Science,2017,100(7):5936-5944.
[22] et#39;CHAROEN S,HAYAKAWA S,OGAWA M. :Propriétés alimentaires de la protéine de blanc d’œuf modifiée par des kétohexoses rares par la réaction de maillard [J]. Revue internationale des sciences de l’alimentation & Technology,2015,50(1):194-202.
[23] YAN Z,ZHANG H,GUAN Y et al. Étude Comparative sur les effets du D-psicose et du d-fructose dans la réaction de maillard avec la β-lactoglobuline [J]. Food Science and Biotechnology,2013,22(2):341-346.
[24] LEE P,OH H,KIM S Y,et al. Les effets of D-allulose as a saccharose Suppléant (E) on the Physicochimique, texturale, et Propriétés sensorielles des livres de gâteaux [J]. Journal of Food Processing and Preservation,2020,44(6),e14472.
[25] [traduction] À propos de TAKEI L,HANABATA M. Écologique, hydrofuge, transparent à la lumière Le film dérivé from psicose En utilisant Nanoimpression lithographie [J]. Lettres des matériaux,2015,143:197-200.
[26] HARADA M,KONDO E,HAYASHI H,et al. D-allose et D-psicose renforcent l’action du métronidazole sur trichomonad[J]. Parasitology Research,2012,110(4):1565-1567.
[27] [traduction] À propos de SATO M,KUROSE L,YAMASAKI T,et al. potentiel Anthelmintique :D-psicose inhibe Motilité, croissance and Maturité reproductrice des larves L1 de Caenorhabditis elegans[J]. Journal of Natural Medicines,2008,62(2):244-246.
[28] FENG Z,MU W,JIANG B. caractérisation de l’isomérase ribose-5-phosphate convertissant D-psicose en d-allose de Thermotoga lettingae TMO[J]. Biotechnology Letters,2013,35:719-724.
[29] YEOM S J,SEO E S,KIM Y S,et al. Ont augmenté la production de D-allose par le mutant R132E de l’isomérase de ribose-5-phosphate de Clostridium thermocellum[J]. Applied Microbiology and Biotechnology,2011,89(6):1859-1866.
[30] HAN W,ZHU Y,MEN Y,et al. Production d’allitol à partir de D-psicose par une nouvelle souche isolée de Klebsiella oxytoca G4A4 [J]. Journal of Basic Microbiology,2014,54(10):1073-1079.
[31] [en] SOENGAS R,IZUMORI K,SIMONE Mon,et al. Kiliani reactions on Cétoses: ramifié glucides bâtiment blocs De d-tagatose et D-psicose[J]. Tetrahedron Letters,2005,46(34):5755-5759.
[32] [traduction] Le président de la république M,MU L,CHU F,et al. A D-psicose 3-epimérase with neutre Le pH optimum from Clostridium bolteae for D-psicoseproduction: clonage,expression,purification et caractérisation [J]. Applied Microbiology and Biotechnology,2014, 98(2):717-725.
[33] ZHANG L,MU W,JIANG B et al. Caractérisation de la D-tagatose-3-epimerase De Rhodobacter sphaeroides that Transforme le D-fructose en D-psicose[J]. Biotechnology Letters,2009,31(6):857-862.
[34] MU W,ZHANG W,FANG D,et al., caractérisation d’une enzyme produisant de la D-psicose, la D-psicose 3-epimerase, de Clostridium sp.[J]. Biotechnology Letters,2013,35(9):1481-1486.
[35] ZHANG W,FANG D,XING Q,et al. Caractérisation d’une nouvelle D-psicose 3-éimerase dépendante des métaux à partir de Clostridium scindens 35704[J]. Plos One,2013,8,e62987.
[36] YOSHIDA H,YOSHIHARA A,SUZUKI T,et al. Structure aux rayons x d’une nouvelle kétose 3-éimerase de Shinella zoogloeods qui est capable de production de D-allulose [J]. FEBS Open Biol,2019,9:257-265.
[37] [traduction] MU L,CHU F,XING Q,et al. Clonage,expression et caractérisation of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J]. Journal of Agricultural and Food Chemistry,2011,59(14):7785-7792.
[38] ZHU Y,MEN Y,BAI W,et al. Surexpression de D-psicose 3-epimerase de Ruminococcus Sp. en Escherichia coli Et son application potentielle dans la production D-psicose [J]. Biotechnology Letters,2012,34(10):1901-1906.
[39] [traduction] ZHANG L,JIANG D, d W,et al. La Bioproduction De D-psicose using perméabilisé cells De nouveaux isolés Rhodobacter sphaeroides SK011[J]. Frontiers of Chemical Engineering in China,2009,3(4):393-398.
[40] PARK C,KIM T,HONG S,et al. Production de D-allulose à partir de D-fructose par des cellules recombinantes perbilisées de cellules de Corynebacterium glutamicum exprimant D-allulose 3-epimérase flavonifracteur plautii[J]. Plos One,2016,11(7),e0160044.
[41] YANG J,TIAN C,ZHANG T,et al. Développement d’un système d’expression de qualité alimentaire pour la préparation de D-allulose 3-éimerase avec des gènes d’isoenzyme tandem dans Corynebacterium glutamicum et son application dans la conversion de la mélasse de canne en D-allulose [J].
Biotechnology and Bioengineering,2019,116(4):745-756.
[42] LI S,Mon - sunZ,ZHANG W,et al. Caractérisation d’une D-tagatose 3-epimerase de Caballeronia fortuita et son application dans la production rare de sucre [J]. International Journal of Biological Macromolecules,2019,138:536-545.
[43] ZHU Z,LI C,LIU X,et al. Caractérisation biochimique et application biocatalytique d’un nouveau D-tagatose 3-epimerase de Sinorhizobium sp.[J]. Avances RSC,2019,9(6):2919-2927.
[44] ZHU Z,GAO D,LI C et al. Refonte d’une nouvelle D-allulose 3-epimérase de Staphylococcus aureus Pour la thermostabilité et la production biocatalytique efficace de D-allulose[J]. Microbienne celluleFactories,2019,18(1):1-10.
[45] TSENG W,Mon - sunC,HSU C,et al. Caractérisation d’une D -allulose 3-éimerase recombinante d’agrobacterium sp. ATCC
31749 et identification d’un résidu d’interface important [J]. International Journal of Biological Macromolecules,2018, 112:767-774.
[46] YOSHIHARA A,KOZAKAI T,SHINTANI T,et al. Purification et caractérisation de la D-allulose 3-epimérase dérivée d’arthrobacter globiformis M30, un micro-organisme GRAS [J]. Journal of Bioscience and Bioengineering,2017,123(2):170-176.
[47] HE W,JIANG B,MU W,et al. Production de D-allulose avec D-psicose 3-éimerase exprimée et affichée à la surface des spores de Bacillus subtilis [J]. Journal of Agricultural and Food Chemistry,2016,64(38):7201-7207.
[48] ZHANG W,ZHANG T,JIANG B,et al. Caractérisation biochimique d’une D-psicose 3-epimérase de Treponema primitiaZAS-1 Et son application sur la production enzymatique de d-psicose [J]. Journal of the Science of Food and Agriculture,2016,96(1): 49-56.
[49] ZHANG W,LI H,ZHANG T,et al. Caractérisation d’une D-psicose 3-epimerase de Dorea sp. CAG317 avec un pH acide optimum et une activité spécifique élevée [J]. Journal de la catalyse moléculaire B-Enzymatic,2015,120:68-74.
[50] ZHANG W,ZHANG Y,HUANG J,et al. Amélioration de la thermostabilité de la d-Allulose 3-epimérase de Dorea sp. CAG317 par mutagénèse dirigée sur le site dans les régions d’interface [J]. Journal de chimie agricole et alimentaire,2018,66:5593-5601.
[51] PATEL S N,KAUSHAL G,SINGH S. caractérisation d’un nouveau gène D-allulose 3-epimérase à partir du métagénome d’un habitat aquatique thermique et production de D-allulose par catalyse de Bacillus subtilis [J]. Microbiologie appliquée et environnementale,2019,1:1-8.
[52] [traduction] CHEN Z,CHEN J,ZHANG W,et al. Amélioration de thermostabilité and catalytic comportement of L-rhamnose isomerase De Caldicellulosiruptor obsidiansis OB47 vers D -allulose par mutagénèse dirigée vers le site [J]. Journal de l’agriculture et de l’alimentation Chimie,2018,66(45):12017-12024.
[53] PARK C,PARK C,SHIN K,et al. Production de D-psicose à partir de d-fructose par des cellules recombinantes entières avec une expression de haut niveau de D-psicose 3-éimerase d’agrobacterium tumefaciens[J]. Journal of Bioscience and Bioengineering,2016,121(2):186- 190.
[54] [traduction] CHEN J,ZHU Y,FU G,et al. Haut niveau Intra - - and extra-cellulaire production of D-psicose 3-epimerase Par l’intermédiaire de a Système d’expression induit par xylose modifié chez Bacillus subtilis[J]. Journal de microbiologie industrielle & Biotechnology,2016,43(11): 1577-1591.
[55] LI Z,LI Y,DUAN S,et al. Bioconversion de d-glucose en d-psicose avec D -xylose isomérase immobilisée et D -psicose 3-éimerase sur Saccharomyces cerevisiaespores[J]. Journal de microbiologie industrielle & Biotechnology,2015,42(8):1117- 1128.
[56] YANG P,ZHU X,ZHENG Z,et al. Cell régénération and Cyclique: catalysis De machinés Kluyveromyces marxianus De a Gène d-psicose-3-epimerase d’agrobacterium tumefaciens pour la production de D-allulose [J]. Revue mondiale de microbiologie & Biotechnology,2018,34(5):7-13.
[57] LI C,ZHANG C,LIN J,et al. Élimination enzymatique du fructose de la solution du modèle de bioproduction D-psicose et modélisation et simulation du système [J]. Journal de la technologie chimique & Biotechnology,2018,93(5):1249-1260.
[58] SONG Y,NGUYEN QA,WI SG,et al. Strategy for dual production of bioethanol and D-psicose as value products from cruciferous vegetable residue[J]. Bioresource Technology,2017,223:34-39.
[59] HE X,ZHOU X,YANG Z,et al. Clonage,expression et purification du gène D-tagatose 3-epimerase d’escherichia coli JM109[J]. Expression des protéines & Purification,2015,114:77-81.
[60] LI C,LIN J,GUO Q,et al. D-psicose 3-éimerase surexpression sécrétive, immobilisation et biotransformation, séparation et cristallisation de D-psicose [J]. Journal de la technologie chimique & Biotechnology,2018,93(2):350-357.


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




