Allulose de quoi est-il fait?
Avec lA Aaprévalence croissante de l’obésité Et etdu diabète, «une alimentation saine et une vie faible en sucre» est devenue une tendance populaire dans aujourd’hui ' S de la société. En 2019, la fédération internationale du diabète (IDF) a publié un rapport indiquant que 9,3 % des adultes âgés de 20 à 79 ans dans le monde sont atteints de diabète, ce qui signifie que 463 millions de personnes sont atteintes de diabète. Les dépenses médicales liées au diabète représentent 10% des dépenses de santé mondiales (environ 760 milliards de dollars US) [1~2]. En réponse aux envies quotidiennes de sucré de ces patients et des obèses, il est urgent de développer des édulcorants qui sont semblables au saccharose dans le sucré, maIl estne provoquent pas la glycémie à augmenter.
allusions can meet these needs due to its sweetness similar to sucrose, extremely low calorie content Et en plusits special physiological effects. In recent years, demand dansforeign markets has been on the rise. Domestic universities, research institutes and enzyme preparation companies have rapidly developed research on allulose dansrecent years, and the number De larelated papers published has increased year by year[3].
1. Propriétés physico-chimiques et fonctions physiologiques de la D-allulose
D-allulose, également connu sous le nom de D-ribo-2-hexulose, est un diastéréoisomère de D-fructose à la position C-3, et peut être préparé en ajoutant la diastéréoisomérase au D-fructose. Il a été à l’origine isolé de la psicofuranine et donc nommé D-psicose[4]. En 2014, la conférence internationale sur le sucre Rare tenue au Japon a officiellement corrigé le nom conventionnel de D-psicose de D-psicose à D-allulose[5~6].
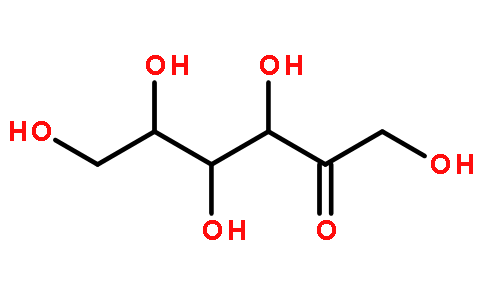
1. 1 Propriétés physiques et chimiques du D-allulose
D-Allulose is a typical rare hexose. It is a white crystalline powder and an isomer De laglucose and fructose. Its molecular weight is 180.16 and its molecular formula is C6H12O6. It is very soluble in water. at room temperature, 100g can dissolve 291g of allulose in water[7]; melting point is 109℃, stable under normal temperature and pressure. Because of its low melting point, it is not suitable for spray drying to produce powdered products. The sweetness of D-alluloseis 70% Que celaof sucrose [8], and its sweetness is mild. Eating the same amount of allulose will only generate 0.3% of the calories of sucrose [9].
1.2 fonctions physiologiques de la D-allulose
1. 2. 1 effet neuroprotecteur
Les scientifiques japonais Takata et al. [10] ont découvert que 50 mmol/L D-allulose peut protéger les nerfs en augmentant le niveau intracellulaire de glutathion et en inhibant l’apoptose des cellules de catécholamine PC12 induite par la neurotoxine 6-hydroxydopamine. Ajouter D-allulose à l’alimentation quotidienne peut réduire efficacement l’incidence de Parkinson' S maladie.
1. 2. 2 Abaisser la glycémie
Relevant studies have shown that after oral intake of D-allulose, l’activité de la glycosidase de glucose et de l’α-amylase dans l’intestin peut être efficacement inhibée par la D-allulose[11], abaissant ainsi significativement le taux de sucre dans le sang après un repas. Dans un essai clinique de petite taille, les sujets sains qui consommaient 75 g de maltodextrine et une dose de D-allulose de 5 g ou plus avaient des concentrations plasmatiques plus faibles de glucose et d’insuline [12].
1. 2. 3. Effets lipidiques et de réduction du poids
Ochiai et al. [13] [en]ont montré que l’alimentation en D-allulose augmentait significativement l’activité de la lipase chez les rats. Matsuo et al. [14] ont confirmé expérimentalement qu’après avoir reçu du D-allulose pendant 28 jours, l’activité de l’enzyme lipogénique de leur foie était significativement réduite, et le tissu adiposo abdominal était significativement inférieur à celui des rats ayant reçu du D-fructose [8]. Des études ont confirmé que la D-allulose peut favoriser la transcription inverse du cholestérol et réduire le cholestérol de haute densité, ce qui a pour effet de prévenir l’athérosclérose [15]. De plus, de nombreuses études ont montré que la D-allulose a une forte capacité à récupérer les espèces réactives d’oxygène (ROS) [16].
2 préparation de D-allulose
La D-allulose se trouve rarement dans la nature, seulement en petites quantités dans les figues, la mélasse de canne à sucre, le blé et les plantes d’épine de rocher, il n’est donc pas adapté à l’extraction des plantes. Actuellement, les principales méthodes de préparation de la D-allulose sont la synthèse chimique et la conversion enzymatique biologique.
2. 1 méthode de synthèse chimique
Un produit chimique relativement typiqueMéthode de synthèse pour D-alluloseEst d’utiliser le glucose comme matière première, le molybdate comme catalyseur et de synthétiser à 80~120℃. Bien que le taux de conversion maximal de cette méthode puisse atteindre plus de 40%, la teneur en cendres du produit est trop élevée pour répondre aux besoins alimentaires. De plus, la conductivité de la solution réactionnelle peut atteindre 10 000 à 20 000 μs/cm [17], ce qui nécessite une électrodialyse, une purification et un dessalement avec de multiples résines échangeuses d’anions et de cations, ce qui entraîne une augmentation de la charge de traitement des eaux usées. Fang Zhijie et al. [18] ont mis au point une méthode de synthèse chimique de l’allose à partir du glycérolide. L’utilisation de solvants chimiques tels que le toluène et l’acétonitrile dans le processus est non seulement nocive pour le corps humain, mais aussi encombrante. D’autres méthodes, comme l’hydrogénation catalytique et le réarrangement de Ferrier [19], présentent également des problèmes comme une faible efficacité de conversion et une grave pollution de l’environnement, et ne conviennent pas à la production industrielle à grande échelle.
2. 2 méthode de conversion enzymatique biologique
Recherche sur la biocatalyse D-alluloseA commencé relativement tôt à l’étranger. Ken Izumori du centre de recherche sur le sucre Rare de l’université Kagawa au Japon a proposé un ensemble de stratégies de conversion du sucre Rare basées sur des années de recherche sur la bioconversion du sucre Rare, qui est connu sous le nom de «Izumoring» méthode [20]. Selon la stratégie de conversion du sucre rare d’izumoring, il existe actuellement deux méthodes principales de bioconversion qui peuvent atteindre la production de D-allulose. L’une est l’utilisation des oxydoreductases pour produire des d-allo-kétosucres à partir de l’allo-initol (alloin), du taro-initol et du D-galacto-initol. En raison du coût élevé des substrats dans cette méthode, elle n’est pas commercialement viable du point de vue des coûts [21-22]. Une autre méthode est l’isomérisation du D-fructose en D-allulose par une isomérase. En 1993, Izumori et al. [23] ont découvert une enzyme de Pseudomonascichorii ST-24 qui peut catalyser l’isomérisation de C3 de l’hexose. Son substrat optimal étant le tagatose, il a été nommé D-tagatose 3-epimérase(enzyme DTE, ci-après dénommée DTE).
En 2006, Kimh et al. [24] de Corée du Sud ont isolé la D-allulose 3-epimérase (D-Psicose 3-epimérase, enzyme DPE, ci-après appelée DPE) d’agrobacterium tumefaciens, dont le substrat optimal est la D-allulose. Le DPE présente une activité d’isomérisation du D-fructose plus élevée que le DTE[8]. Par rapport à la recherche étrangère, la recherche nationale sur le D-allulose a commencé relativement tard. Ce n’est qu’en 2008 que Jiang Bo&#L’équipe de l’université de Jiangnan [25] a sélectionné un DTE de Rhodobacter sphaeroides nommé SK011 à partir de 30 échantillons de boue et d’eau. Après culture en flacon d’agitation, on a procédé à une transformation cellulaire entière et le rendement n’a été que de 6,54 %. Depuis 2010, la recherche sur le DPE/DTE s’est développée rapidement en Chine, avec cinq master' S et mémoires de doctorat publiés en 2021 seulement [26-30].
Parmi eux, Wu Jing&#L’équipe de l’université de Jiangnan a continuellement optimisé les conditions de culture de modification moléculaire et de fermentation du gène DPE dérivent de Clostridium cellulolyticum H10, et a augmenté l’activité enzymatique de fermentation d’un réservoir de 3L à 4567μ/mL[26]. À l’heure actuelle, il y a plus de 400 gènes d’enzymes DPE annotés par le centre National d’information sur la biotechnologie des États-Unis, et plus de 20 ont été clairement rapportés dans la littérature. L’enzyme recombinante a un taux de conversion du fructose d’environ 30%. L’ajout de borate peut augmenter le taux de conversion, et le borate dans le complexe de borate d’allulose peut être facilement éliminé à l’aide d’ambérite IRA-743 et de résines Dowex 50 [31].
3. Direction du développement d’enzymes industrielles D-allulose appropriées
Bien qu’il y ait eu des développements importants dans le D-allulose au cours des dernières années, la plupart d’entre eux ont mis l’accent sur l’extraction de gènes et la construction de souches, et il y a eu relativement peu de rapports sur l’isolement et la purification du produit [32]. Il existe encore quelques lacunes dans la recherche et le développement du produit et sa combinaison efficace avec l’industrialisation. Comme D-allulose est principalement utilisé dans les aliments, ce qui suit décrit la direction des besoins d’industrialisation en combinaison avec les exigences des lois et règlements alimentaires et les problèmes rencontrés dans le processus d’industrialisation.
3.1 sélection de souches d’expression de bactéries recombinantes
Due to the limitations of natural enzymes, such as instability, narrow substrate spectrum and low catalytic efficiency, they are not suitable for direct application in production. It is necessary to modify the gene encoding the target protein at the molecular level, and then screen for mutants with significantly improved properties[26]. Taking food safety and compliance as well as industrialization into consideration, the choice of recombinant bacteria should be based on food-grade microorganisms, non-pathogenic, not easily infected by phages, and with the ability to secrete proteins efficiently. Bacillus subtilis is an aerobic Gram-positive bacterium that can form spores and has a cell wall that does not contain endotoxins. It is the earliest species in the genus Bacillus to be used as a genetic engineering host. As a microorganism recognized as safe by the FDA/FDA, Bacillus subtilis has long been used in the preparation of fermented foods. Recombinant Bacillus subtilis has the advantages of simple and rapid culture, good fermentation basis and production technology, and is an ideal expression host for industrial enzymes[33] .
3. 2 la direction de la modification enzymatique DPE
Bien que l’orientation de la recherche au cours des dernières années ait pris en compte dans une certaine mesure la possibilité d’industrialisation, elle est principalement axée sur l’amélioration de la stabilité thermique de l’enzyme DPE. Ce qui suit décrit les exigences relatives aux enzymes industrielles du point de vue de l’industrialisation.
3.2.1 pH Optimal de l’enzyme
Le pH optimal pour les enzymes est de préférence une acidité faible, et plus la gamme est large, plus il est propice à l’industrialisation. Selon la stratégie rare de conversion du sucre, la production enzymatique en une étape de D-allulose utilise du fructose relativement peu coûteux comme substrat et est catalysée par l’enzyme DPE pour produire de l’allulose. Cependant, la production d’allulose à partir du fructose par DPE est une réaction réversible, et un traitement enzymatique est nécessaire une fois la réaction terminée. Les substrats fructose et allulose sont plus susceptibles de subir la réaction de Maillard dans des conditions de température élevée, d’alcalinité et de présence de protéines, ce qui augmente le coût de la décoloration avec du charbon actif pour le raffinage ultérieur du sucre. Le choix industriel de la valeur de pH la plus appropriée est le DPE faiblement acide, qui est plus approprié. L’effet de différentes valeurs de pH sur la transmittance et l’absorbance de la solution d’alimentation est indiqué au tableau 1.
Comme le montre le tableau 1, lorsque le pH initial de la réaction est faiblement acide, la transmittance et la valeur de couleur de la solution réactionnelle sont meilleures que celles de la solution avec un pH initial de neutralité.
Dans la littérature susmentionnée, l’enzyme DPE catalyse la préparation de l’allose à partir du fructose. La dissolution du fructose doit être maintenue avec une solution saline tamponnée pour stabiliser la valeur du pH, ce qui conduira à une augmentation de la conductivité de la solution, ce qui provoquerait un problème dans les processus suivants d’échange d’anions et de cations avec la diminution du nombre de fois où la matière peut être passée à travers la résine. La production industrielle n’est pas facile à adopter, et il suffit de la dissoudre dans l’eau désionisée. Yuan Tangguo et al. [3] et Li Xiaobo et al. [21] l’ont confirmé par des expériences.
3. 2. 2 sélectivité des ions métalliques
Most DPE enzymes are metal-dependent enzymes. Even if some are not metal-dependent, the presence of certain metal ions can greatly promote the reaction rate [21]. From the perspective of food safety, it is advisable to choose metal ions such as Mg2+ and Mn2+ as food additives for the industrial preparation of enzymes [34~35].
3.2.3 température optimale de l’enzyme
Des études ont montré que plus la température de réaction est élevée, plus la demi-vie de l’enzyme est courte, mais en même temps la vitesse de réaction est plus rapide et le cycle de production est raccourti. Du point de vue de la production industrielle, la température optimale de l’enzyme n’est pas plus élevée, mieux c’est. Plus la température est élevée, plus la consommation de vapeur est importante, et la réaction de Maillard est susceptible de se produire. Un équilibre doit être trouvé entre les deux, et généralement contrôlé entre 40 et 60 °C, en tenant compte de la production d’autres sucres fonctionnels. Plus la température optimale de l’enzyme est élevée, plus elle est propice à l’amélioration du taux de récupération de l’activité enzymatique pendant le processus d’extraction de la solution enzymatique brute.
3. 3 Concentration de substrat adaptée à une application industrielle
L’effet de la concentration du substrat sur la conversion enzymatique est indiqué au tableau 2.
Comme le montre le tableau 2, plus la concentration de la solution de fructose est faible, plus la conversion est rapide au début de la réaction avec la même quantité d’enzymes ajoutées (sur la base sèche du substrat réactionnel). Cependant, si la concentration est trop faible, la quantité d’allulose produite par unité de temps sera trop élevée. Avec l’industrialisation de la décoloration à forte concentration et de l’échange d’ions à forte concentration, la conversion d’enzymes à faible concentration en concentrations subséquentes et autres processus a augmenté la charge de travail. Par conséquent, dans la production industrielle, une concentration d’environ (400-500) g/L peut également atteindre un taux de conversion élevé, et peut réduire la consommation d’eau et d’énergie et réduire les émissions de carbone.
3. 4 préparation et problèmes avec les préparations enzymatiques
La vitesse de réaction de la solution enzymatique est beaucoup plus élevée que celle des cellules entières. Dans les mêmes conditions d’addition d’enzyme, lorsque la concentration de la solution de fructose est d’environ 300 g/L, la vitesse de réaction de la solution d’enzyme brute est environ 5 fois celle des cellules entières. L’enzyme DPE est une enzyme intracellulaire, et le processus de préparation de la solution enzymatique implique la centrifugation, le lavage et l’homogénéisation. Bien que des solutions enzymatiques brutes ou pures puissent être préparées à basse température au niveau du laboratoire, il est difficile de maintenir une basse température pendant la centrifugation et l’homogénéisation pendant la production industrielle. En particulier, la perte d’activité enzymatique pendant le processus d’homogénéisation est relativement élevée, ce qui entraîne des coûts de production d’enzymes élevés.
4 perspectives
D Allulose has now been approved by regulations in 13 countries, including Japan, South Korea, Canada, Mexico, Singapore and Australia. In April 2019, the FDA even announced that D-allulose would be excluded À partir dethe “added sugar” and “total sugar” labels[2], which means that the amount of D-allulose added to food will no longer be restricted in terms of the amount added. However, due to the relatively high price of allulose at present, sales are not yet very large. With the deepening of research and the gradual maturity of the food-grade host recombinant expression of the key DPE enzyme technology for D-allulose, the conversion rate of D-allulose will also continue to improve. Enterprises will continue to improve problems identified during industrialization and enzyme preparation enterprises will launch finished enzymes.
Le coût de préparation de allulose diminuera considérablement et produit La qualité des produits sera encore améliorée. En août 2021, China's National Health Commission has accepted the application for D-allulose as a Nouveau:food ingredient....... Des expériences toxicologiques sont actuellement en cours, et on s’attend à ce que l’utilisation des alluloses comme édulcorant soit approuvée au cours de la deuxième moitié de 2023 ou 2024. Puisque D-allulose est à peine métabolisé après avoir passé à travers les intestins, il ne fournit pas d’énergie, et il a des effets physiologiques uniques tels que réduire efficacement la glycémie postprandiale, contrôler le poids corporel, et réduire l’accumulation de graisse, ses champs d’application deviendra de plus en plus large. Au cours des prochaines années, l’espace et la capacité du marché pour D-allulose à la maison et à l’étranger continueront à se développer, et les perspectives du marché sont bonnes.
Référence:
[1] [traduction] International Diabète sucré fédération Diabète sucré l’atlas neuvième Édition 2019[R].IDF, 2019.
[2] Guo Yuanheng, Wang Jing, Wang Xiaoyan, et al. Progrès de la recherche et de l’industrialisation de la biosynthèse de D-allulose en Chine [J]. Modern Food, 2020(6): 34-40.
[3] Yuan Tanguo. Expression hétérologue de l’isomérase D-allulose et conversion efficace de D-allulose [D]. Dalian: université de technologie de Dalian, 2021.
[4] Eble T E, Hoeksema H, Boyack G A, et al.Psicofuranine. De plus, les antibiotiques et les antibiotiques ne sont pas encore disponibles. Chimiothérapie (Northfield, Ill.) ,1959, 9(7) :419-420.
[5] Park C S, Kim T, Hong S H, et al. D-Allulose p roduction à partir de D-Fructose par des cellules recombinantes p erméabilizées de Corynebacte- rium glutamicum cellules Exp tion D-allulose 3-epimerase Fla - vonifractor plauti[J].Plos One, 2016, 11(7) : 160044.
[6] Liu Menglu, Yuan Weitao, Li Ning, et al. Progrès de la recherche sur l’édulcorant fonctionnel D-allulose [J]. China La nourritureAdditives, 2022, 33(1): 21-25.
[7] Kimura T, Kanasaki A, Hayashi N, et al. D-Allulose Améliore le postprandial Matières grasses oxydation in En bonne santé Humains [J]. La Nutrition, 2017, 16 :43-44.
[8] Chung M Y, Oh D K, Lee K W.Hypoglycemic health benefits of D-p sicose[J].Revue de presseof Agricultural and Food Chemistry, 2012, 60(4) :863-869.
[9] [traduction] Matsuo T, Suzuki H, Hashiguchi M, et al. D-p sicose is a Sucre rare qui ne fournit aucune énergie aux rats en croissance [J].Journal of Nu- tritionalScience &; Vitaminology, 2002, 48(1) :77-80.
[10] Takata M K, Yamaguchia F, Nakanosea K, et al.Neuropro-tec- tive effect of D-Psicose on 6-hydroxydopamine-induced apopto- sis in rat phéochromocytome (PC12) cells[J].Journal of Biosci- ence and Bioengineering, 2005, 100:511-516.
[11] Matsuo T, Izumori K. D-p sicoseinhibe l’intestin α-glucosidase et soutient la réponse glycémique après l’ingestion d’hydrates de carbones chez les rats [J].Journal of Clinical Biochemistry & Nutri- tion, 2014, 54(3) :219.
[12] Iida T, Kishimoto Y, Yoshukawa Y, et al. L’administration aiguë de D-p sicose diminue les réponses glycmiques à un test oral de tolérance à la malto-dextrine chez des adultes normaux [J].Journal of Nutrition- al Science and Vitaminology, 2008, 54(6) :511-514.
[13] Ochiai M, Onishi K, Yamada T, et al. La D-Psicose augmente les dépenses en énergie et diminue l’accumulation de graisse corporelle chez les rats ayant reçu un régime à haute teneur en saccharose [J]. International Journal of Food Sciences et Nutrition, 2014, 65(2) :245-250.
[14] Matsuo T, Baba Y, Hashiguchi M, etal. Diététique D-p sicose, un C- 3epimer de D-fructose, suppriment l’activité des enzymes lipo- géniques hépatiques chez les rats [J].Asia Pacifific Journal of Clinical Nu- trition, 2001, 10(3) :233-237.
[15] Kanasaki A, Iida T, Murao K, etcoll. D-Allulose améliore l’absorption du cholestérol HDL dans rat' S p riocyte par l’intermédiaire de SR-B1[J]. Cytotechnology, 2020, 72(2) :295-301.
[16] Suna S, Yamaguchi F, Kimura S, et al. Effet préventif de la sicose D- p, un des kétohexoses rares, sur le di-(2-éthylhexyl) Phtalate (DEHP) induit testiculaire blessure in Rat [J]. La toxicologie Let- ters, 2007, 173(2) : 107-117.
[17] Wang Chengfu, Fang Chunlei, Du Ruifeng, et al. Procédé de préparation de l’allulose et son application [P]. CN104447888A, 2015-03-25.
[18] Fang Zhijie, Li Song, Cheng Jie, et al. L’invention concerne un procédé de synthèse d’hexopyranose et d’heptopyranose rares à partir de lactone acide de sucre [P]. CN101817851A, 2010-09-01.
[19] Doner L W.Isomerization of d-fructose by base:Liquid chroma-tographic evaluation and the isolation of d-p sicose[J].Carbohy- drate Research, 1979, 70(2) :209-216.
[20] Mu Wanmeng, Zhang Tao, Jiang Bo et al. Stratégie de production de Bioconversion des sucres rares: méthode d’izumoring [J]. Chinese Journal of Bioengineering, 2007, 27(7): 129-136.
[21] Li Xiaobo. Expression de D-allulose 3-epimérase et son immobilisation pour la conversion de D-allulose [D]. Tianjin: Tianjin University of Science and Technology, 2013.
[22] Izumori K, Yamakita M, Tsumura T et al.Production de d-p si- cose à partir de d-talitol, d-tagatose ou d-galactitol b yAlcaligenes sp. 701B[J].J Ferment Bioeng, 1990, 70(1) :26-29.
[23] Izumori K, Khana R, Okaya (en anglais) H, et Al., et al. A new Enzyme, d-kétohexose 3-epimérase, from Pseudomonas Sp. ST-24 [J]. Bioscience Biotechnology and Biochemistry, 1993, 57(6) : 1037- 1039.
[24] Kimh J, J, Hyune: K, Kimy: S, et Al., et al. caractérisation of Une agrobactérie tumefaciens D-p sicose 3-epimérase that Inverser le D-fructose en D-p sicose[J]. appliqué and Environmental Microbiology, 2006, 72(2) :981-985.
[25] Zhang Longtao, Mu Wanmeng, Jiang Bo et al. Dépistage de clostridia pour la bioconversion de D-allulose [J]. Food and Fermentation Industry, 2008(9): 40-43.
[26] Wang Yifan. Modification moléculaire, optimisation de l’expression et recherche de stabilité de D-allulose 3-epimerase de Clostridium cellulolyticum H10 [D]. Wuxi: université de Jiangnan, 2021.
[27] Bu Yifan. Optimisation de la production de D-allulose 3-epimerase et de son immobilisation avec les cellules [D]. Wuxi: université de Jiangnan, 2021.
[28] Chen Jiajun. Identification des propriétés de la D-allulose 3-epimérase et recherche sur la modification de la stabilité thermique [D]. Wuxi: université de Jiangnan, 2021.
[29] Feng Linxue. Etude sur la synthèse de D-allulose par catalyse multi-enzymatique du D-fructose [D]. Wuxi: université de Jiangnan, 2021.
[30] Wei Yuxia. Expression hétérologique et immobilisation de D-allulose 3-éimerase chez Bacillus subtilis [D]. Wuxi: université de Jiangnan, 2021.
[31] [en] Hicks K B, Simpson G L, Bradburya G W.Removal of boric acid and related compounds from solutions of glucides with a bore selective resin (IRA-743) [J].Carbohydr Res, 1986, 147 (1) :39-48.
[32] Li Yunfei, Luan Qingmin, Liu Feng et al. Progrès de la recherche dans l’application de la chromatographie à lit mobile simulée dans la séparation des solutions de sucre multicomposants [J]. Food and Fermentation Industry, 2022, 48(11): 1-13.
[33] Ma Pingying, Luo Wen, Zhan Yixin et al. Progrès de la recherche sur le système d’expression de Bacillus subtilis [J]. Jiangxi Science, 2020, 38(6): 867-871.
[34] ministère de la santé du peuple et#39; S république de Chine. GB 25584-2010 norme nationale de sécurité alimentaire additifs alimentaires chlorure de magnésium [S]. Beijing: China Standards Press, 2010.
[35] ministère de la santé du peuple et#39; S république de Chine. GB 29208-2012 norme nationale de sécurité alimentaire additifs alimentaires Sulfate de manganèse [S]. Beijing: China Standards Press, 2012.
-
Précédent précédent
Quelle est la méthode de Production de la poudre D Allulose?
-
Suivant:
La poudre D Allulose est-elle sûre?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




