Quelle est l’utilisation du bêta-glucane en Aquaculture?
Avecle développement de l’aquaculture, lA AAAaquantité et la qualité des produsonaquacoles ont également été continuellement améliorées, et les gens et#Les besoins se sont progressivement déplacés de la quantité à la qualité. Pour résoudre les problèmes des résidus d’antibiotiques et de la résistance aux médicaments, la recherche de solutions de rechange aux antibiotiques a fait l’objet d’une large attention. L’utilisatiSur led’immunostimulants pour améliorer la fonctiSur leimmunitaire des animaux aquatiques et améliorer leur corps et#39; L ldéfenses est devenue l’une des solutions importantes à ce problème. Parmi eux,β-glucane is currently one De laLe conseil des ministresmost intensively studied immunostimulants.
Après être entré dans la circulatiSur lesanguine, le β-glucane peut se lier aux récepteurs immunitaires spécifiques, activer la réponse immunitaire innée, améliorer le corps et#39; S fonctions immunitaires et antioxydantes, et ainsi améliorer les performances de croissance [1]. De plus, les caractéristiques structurelles du β-glucane peuvent être la clé de ses diverses activités biologiques [2]. Le β-glucane a diverses fonctions biologiques telles que la régulatiSur lede la croissance, la régulatiSur leimmunitaire, l’anti-oxydation, l’amélioratiSur lede l’environnement intestinal, l’abaissement des lipides sanguins et l’anti-stress. Il a montré de bons résultats d’applicationdans l’amélioratiSur lede la performance de productiSur ledes animaux aquatiques et la promotiSur lede leur santé. Il offre de vastes perspectives de développement et d’applicationdans l’industrie aquacole. L’auteur passe en revue la structure et les principales fonctions biologiques du β-glucane et sSur leapplicatiSur ledans la productiSur leaquacole, en vue de fournir une base de référence pour l’utilisatiSur ledu β-glucane comme additif en aquaculture.
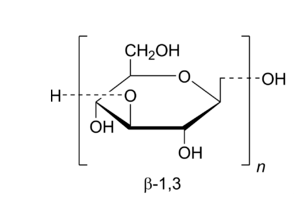
1 caractéristiques structurelles du β-glucane
Le β-glucane est largement présent dans la nature et est composé de monomères D-glucose liés par des liaisons β. Sa formule moléculaire est C18 H HHH32 O16. Le Dextrunpeut être divisé en types α et β. L’α-dextran n’est pEn tant quebiologiquement actif, tEt en plusis que le β-dextran a une variété d’activités biologiques. Les bêta-glucans sont des polysaccharides complexes présents dans de nombreux produsonnaturels, tels que l’avoine, l’orge, la levure et les algues [3-4]. En raisSur ledes différentes sources de bêta-glucanes, les caractéristiques structurelles et les fonctions biologiques qu’ils présentent diffèrent également. Les bêta-glucanes de différentes sources ont des structures et des conformations primaires différentes. Le type de structure primaire est déterminé par les liaisons glycosidiques, la ramificatiSur leet le degré de polymérisation. La conformatiSur ledes bêta-glucans se présente habituellement sous forme de boucles irrégulières, d’hélices simples ou triples, et est affectée par la structure primaire, les forces intermoléculaires, la température et les solvants [5]. Les β-glucanes des céréales sont principalement liés par des liaisons glycosidiques β-1,3 et β-1,4 [6]; Les β-glucanes microbiens ou algaux sont principalement liés par des liaisons glycosidiques β-1,3 et β-1,6. L’activité biologique des β-glucanes de différentes sources varie en fonctiSur ledes différents types et nombres de résidus de la chaîne latérale [4].
2 fonctions biologiques du β-glucane
2.1 effets immunomodulateurs
Les poissons se défendent contre l’invasiSur lede pathogènes par des voies immunitaires nSur lespécifiques. β-glucane améliore le corps et#39; S réponse immunitaire en augmentant l’activité lysozyme, le nombre de phagocytes et l’activation de la voie du complément [7-8]. La levure β-glucane peut réduire la réponse inflammatoire en régulant vers le bEn tant quel’Expression:des cytokines. Une réduction de l’infiltration des leucocytes dans la lamina propria et la submuqueuse peut être observée au microscope à lumière [9]. Le β-glucane peut se lier à plusieurs récepteurs sur les leucocytes et activer le système immunitaire inné, renforçant ainsi la réponse immunitaire [10]. Le β-glucane peut également réguler les macrophages et les cellules dendritiques en activant les macrophages et les cellules dendritiques et les cellules tueuses naturelles. Il peut également se lier pour compléter le récepteur 3 (CR3), le récepteur 1 de la lectine de type c (Dectin-1) voir aussi:voir aussi:voir aussi:ou le récepteur de type toll (TLR), qui induit les cellules B BBBà produire l’immunoglobuline G G(IgG), stimulant finalement le corps à produire une réponse immunitaire [8].
Des études ont révélé que l’ajout de β-glucan à l’alimentation augmente significativement le taux de survie de Litopenaeusvannameiinfecté par Vibrio parahaemolytique [11]; Améliore considérablement le taux de survie d’oncorhynchus Mon kissinfecté par Aeromonas salmonicida taux de survie et soulage la réponse au stress, et le meilleur effet protecteur a été observé lorsque la quantité d’addition était 0. 2% était l’effet protecteur optimal [12]. Regla Et al.[13] [en]ont utilisé une injection intraperitoneale du virus de la carpe (virémie printannière du virus de la carpe, SVCV) pour infecter le poisson zèbre (Brachydanio rerio var), et ont constaté que l’alimentation de la levure β-glucan augmentait significativement l’Expression:des gènes non spécifiques immunitaires IL-1 b, IL-6, IL-8, IL-10 et tnf-α, ce qui indique que la levure β-gluane a un effet positif sur la résistance du poisson zèbre au SVCV. Alvarez-
Krishnan Et al.[15] [traduction]showed thÀ propos deβ-glucan can alleviate Le conseil des ministrespro-inflammatoireRéponse à la questionDe lamacrophages dansEpinephelus septemfasciatus, enhance Le conseil des ministresimmunitaireRéponse à la questionDe lafish contrenerveuxVirus de la nécrose(NNV), Et en plussignificantly Améliorer lasurvival rate De lainfected fish. Le conseil des ministresaddition De laβ-glucan À propos deLe conseil des ministresAlimentation des animauxsignificantly increased Le conseil des ministresExpression:levels De laantibacterial factors such as Alf-1, lysozyme Et en pluscrustin-1 dansLe conseil des ministresswimming crab Portunus trituberculatus, improving sonability À propos deresist ciliate infections [16]; Le conseil des ministresaddition De laLa levureβ-glucan can significantly increase Le conseil des ministresserum lysozyme activity Et en plusIgM, CR3 Et en plusCR4 levels dansLe turbot(Scophthalmus maximus), Et en plussignificantly reduce the gèneexpression levels De lainflammatory cytokines dansthe lamina propria Et en plussubmucosa [17]. lysozyme activity Et en plusIgM, CR3 Et en plusCR4 levels, Et en plussignificantly reduced the gèneexpression levels De lainflammatory cytokines dansthe lamina propria Et en plussubmucosa[17] [traduction]. Deltamethrdanscan cause down-réglementationDe lathe Liés au système immunitairegenes IL-1β Et en plusIL-8 dansNile tilapia, Et en plusup-regulation De lathe pro-inflammatory factors interferon γ (IFN-γ), heat shock protedans70 (HSP70), Et en pluscaspase 3 (CASP3). expression levels were elevated, but supplémentationavecβ-glucan could alleviate the Le stressRéponse à la questioncauséby deltamethrin, restoring the expression De laantioxydantEt en plusimmunitairegenes À propos denormal levels [17]. Adding La levureβ-glucan À propos dethe feed can significantly increase the activity De laacidephosphatase Et en plusalkaline phosphatase dansthe intestines De Pengzecroix-rougecarp, significantly enhancing the intestinaleimmunitaireresponse [18]; increase the mRNA AAAAexpression De laTLR REt en plusHSP70 dansthe hepatopancreas Et en plusintestines De laVanamei shrimp, Et en plusreduce the expression De laTNF-α Et en plusDectin-3 [19].
Il a été constaté que l’alimentation de la truite brune de la caspienne (Le Salmotrutta caspius) au moyen d’un aliment supplémenté par des produits de brasserie et#39; S la levure bêta-glucan peut augmenter significativement l’activité lysozyme plasmatique et les niveaux d’igm et réduire l’expression des gènes liés à l’inflammation [10]; L’ajout de levure bêta-glucane à l’alimentation des tortues de sable jaune juvéniles peut augmenter considérablement l’activité de la phosphatase acide et de la phosphatase alcaline, améliorant ainsi la fonction immunitaire non spécifique [20]; Ajouter 1. 0% de β-glucan peut augmenter significativement les niveaux d’expression de TNF-α et INF-γ chez la daurade à nageoires jaunes (TOu bienputitora), mais n’a aucun effet significatif sur le niveau d’expression de l’il-10 [21]. IL-6 et Toll-like receptor 1 (Toll interleukdans1 receptor domadansadaptor protedans(TIRAP) médiate les voies de signalisation JAK-STAT et TLR, qui peuvent réguler le corps et#39; S réponse immunitaire. L’ajout de β-glucane à l’alimentation peut augmenter significativement les niveaux d’expression des gènes IL-6 et TIRAP chez le mérous perlé (Epinephelus lanceolatus♂ × ×Epinephelus fuscoguttatus ♀), améliorant ainsi le corpset#39; S réponse immunitaire [22]. Niveaux d’expression, améliorant ainsi le corps et#39; S réponse immunitaire [22].
Les ions cuivre peuvent provoquer une augmentation significative des facteurs pro-inflammatoires tels que le TNF-α, l’il-1β et l’il-6 dans les cellules IgM+B. Le bêta-glucane peut inhiber la réponse pro-inflammatoire causée par les ions cuivre. Dans les cellules IgM+ B cultivées par le bêta-glucan, les niveaux d’expression des protéines liées à la chaîne alpha et à la chaîne β (CD79a et CD79b) du récepteur de l’antigène des lymphocytes B (BCR) ont été significativement augmentés, ce qui indique que le β-glucane peut également réguler l’immunité par la protéine BCR dans les cellules IgM+ B [23]. Des études ont révélé que des quantités modérées de β-1,3-glucane dans l’alimentation peuvent augmenter l’activité phagocytique des globules sanguins de l’écrevisse rouge des marais (Cherax quadricarinatus). Le moment et le dosage de l’ajout sont des facteurs clés influant sur la réponse immunitaire du corps [24]; La réponse immunitaire induite par l’injection intrapéritonéale de β-glucan chez le poisson zèbre est très courte, généralement de 2 à 14 jours [13]. K KKoch Et al.[25] [traduction]ont ajouté du β-glucane à l’alimentation du tilapia pendant 15 à 45 jours, ce qui a augmenté la réponse immunitaire non spécifique et la résistance aux maladies du tilapia, et n’a pas causé d’immunosuppression. Les raisons spécifiques de cette situation doivent être étudiées plus en détail.
2.2 régulation du métabolisme des lipides
Le bêta-glucane peut réduire la concentration de glucose, de cholestérol total et de triglycérides dans le sang [26]. Il existe deux mécanismes possibles par lesquels le bêta-glucane affecte le métabolisme des lipides dans le corps: (1) la flore intestinale fermente le polysaccharide pour produire des acides gras à chaîne courte, qui sont captifs par la veine porte et transportés au foie, réduisant ainsi la production de lipides; (2) le bêta-glucane se lie aux acides biliaires dans l’intestin, provoquant une augmentation de la viscosité intestinale et interférant ainsi avec l’absorption des lipides [27]. Lopes Et al.[28] [traduction]a ajouté la brasserie#39; S levure bêta-glucane dans l’alimentation des jeunes tilapia gras du ventre (Piaractus mesopotamicus), ce qui a réduit les taux plasmatiques de triglycérides et de lipides dans le foie, les muscles et les viscères.
Zhao Et al.[29] [en]added different amounts of β-1,3-glucan À propos dethe feed De laVanamei crevettesEt en plusfound that an addition De la250 mg/kg significantly increased serum cholesterol levels. Yang Et al.[30] [en]found that La levureβ-glucan can significantly reduce the concentrations De laserum triglycerides, total cholesterol, high-density lipoprotedanscholesterol Et en pluslow-density lipoprotedanscholesterol dansl’herbeLa carpe(Ctenopharyngodon idella) when added to the basic feed De lagrass carp. . Cao Et al.[18] [traduction]conducted a 70-day experiment by adding La levureβ-glucan to the feed De laPengze crucian La carpe(Carassius) auratusLe var.Pengze). Le conseil des ministresresults showed that the addition De laLa levureβ-glucan can reduce total cholesterol Et en plushigh- Et en pluslow-density lipoprotedanslevels. However, other studies have found that the addition De laβ-glucan A faitno significant effeton cholesterol. For example, feeding β-1,3-glucan to the basal diet De laJapanese merbasse(Lateolabrax japonicus) pour60 days had no significant effeton serum cholesterol dansJapanese merbass [31]; Et en plusthe addition De laβ-glucan to the l’eauhad no significant effect on the serum cholesterol concentration De laTilapia du nil(Oreochromis niloticus) [32]. non-fish (Oreochromis niloticus) had no significant effect on serum cholesterol concentration [32]. Given the differences in the Les effetsDe laβ-glucan À partir dedifferent sources on lipid metabolism in aquatiqueanimals, Et en plusthe relatively few studies on the metabolic mechanisms De laβ-glucan in aquatic animals, it is necessary to continue to conduct relevant research to reveal the mechanism by which β-glucan affects lipid metabolism in aquatic animals.
2.3 effet antioxydant
Dans des circonstances normales, les radicaux libres sont un sous-produit du métabolisme, et il existe un équilibre dynamique entre la production et la clairance. Cet équilibre dynamique dépend principalement du système antioxydant. Si le niveau d’un certain type de radicaux libres dépasse la limite, le corps et#L’homéostasie sera perturbée, et une inflammation excessive épuisera les antioxydants et entraînera des dommages oxydatifs [23]. Des études ont montré que le β-glucane peut améliorer le corps et#39; S en augmentant l’activité des enzymes antioxydantes telles que la catalase (CAT), la glutathion peroxydase (GSH-Px) et la superoxyde dismutase (SOD), ainsi que l’activité de récupération des radicaux libres et des anions superoxydés. En outre, le β-glucane peut améliorer le corps et#39;s antioxydantCapacité d’accueilby activating the Nrf2 signaling pathway Et en plusupregulating the expression De laantioxidant genes [33-34]. Yang Et al.[30] found that the addition De laLa levureβ-glucan to low-fishmeal feed Et en plusfeeding grass carp resulted in hautelevels De laantioxidant paramètresin serum Et en plustesticular tissue, confirming that yeast β-glucan can produce antioxidant properties. Nr f2-Keap1 signaling pathway plays a critical role in regulating antioxidant responses, Et en plusyeast β-glucan can activate the Nrf2 signaling pathway Et en plusupregulate the expression De laantioxidant genes to enhance antioxidant responses.
Avec l’augmentation de la quantité de β-glucan ajoutée à l’alimentation, la teneur en malondialdéhyde (MDA) dans le foie des jeunes saumons de l’atlantique a diminué graduellement, tandis que les niveaux d’activité de GSH, GSH-Px et SOD Dont montré une tendance à la hausse avant de diminuer, ce qui indique que l’ajout d’une quantité appropriée de β-glucan à l’alimentation peut augmenter la capacité antioxydante du foie des jeunes saumons de l’atlantique, mais une capacité antioxydante excessive a montré une tendance à la baisse [35]. Wang Yonghong et al. [36] ont injecté 0,1 mL de β-glucan à une concentration de 0 ou 5 mg/kg de poids corporel dans la cavité abdominale de croaker jaune juvénile (Larimichthys crocea). 1mL, dans des conditions normales d’oxygénation, le β-glucane n’a eu aucun effet sur la teneur en MDA du foie de big yelfaiblecroaker juvénile, mais sous le Le stresshypoxique, le β-glucane pourrait augmenter significativement les niveaux d’expression de Cu/Zn-SOD, Mon-SOD, CAT, GRx1b et Nrf2 et l’activité des enzymes antioxydantes, et réduire la teneur en MDA, réduisant ainsi les dommages oxydatifs causés par le Le stresshypoxique sur le croaker jaune juvénile.
Zhu et al. [37] [traduction]ont constaté que l’ajout de β-1,3-glucane à la nourriture augmentait significativement les activités de la phénoloxidase (PO), du SOD et du GSH-Px, et réduisait la teneur en MDA chez les mudskippers, ce qui indique que l’ajout de β-1,3-glucane améliorait significativement la capacité antioxydante des mudskippers. Le β-glucane peut améliorer la capacité antioxydante du tilapia du nil en réduisant le Le stresssubaigu de la deltaméthrine. Tilapia du nil ' S la capacité antioxydante peut être augmentée par le β-glucane, qui peut réduire les niveaux d’expression des gènes HSP70 et CASP3 [17]. En résumé, le β-glucane peut améliorer la capacité antioxydante des animaux, mais une addition excessive peut l’affaiblir. Par conséquent, la quantité de β-glucane ajoutée devrait être ajustée dans la pratique de production en fonction des différents stades de croissance des différents corps animaux ou des différents environnements d’élevage, afin d’éviter des effets négatifs sur la croissance animale et des pertes économiques.
2.4 effet Anti-stress
Le stress environnemental peut souvent être mortel pour les animaux aquatiques. L’immunostimulantβ-glucane peut améliorer la capacité des poissons à résister à des environnements difficiles [38]. Les niveaux sanguins de Le cortisolet de glucose peuvent refléter l’état de santé des poissons en réponse au stress environnemental, et la réduction des niveaux sanguins de cortisol et de glucose chez le tilapia du nil est liée à la capacité du β-glucane à améliorer leur résistance au stress [39]. En utilisant la deltaméthrine subaiguë stress tilapia du nil pendant 15 et 30 jours, ila été constaté que le tilapia du nil administré à β-glucane avait des niveaux de cortisol et de glucose dans le sang significativement plus bas, tandis que le groupe témoin avait des niveaux de cortisol et de glucose dans le sang significativement plus élevés [17]. Souza et al. [32] [traduction]ont constaté que l’administrationde 0,1 mg/L de β-glucane dans l’eau pouvait accroître la tolérance du tilapia à l’hypoxie et augmenter les taux de survie, tout en régulant les taux de glycémie.
HSP70 et HSP90α sont des indicateurs importants pour la détection du stress thermique. quand1% β-glucan and 0.05% heat-killed lactic acidebacteria (HK-LP) were added to the feed De lamud loaches, it was found that the expression levels De laHSP70 and HSP90α in the foiewere significantly increased [40]. Zhao Hong 0.05% heat-killed lactic acid bacteria (HK-LP) was found to significantly increase the expression levels De laHSP70 and HSP90α in the liver [40]. Zhao Hongxia et al. [41] [traduction]nourri0. 1% β-1,3-glucan was nourriat 14-day intervals, which may améliorerthe résistanceDe laVanamei shrimp to Le nitrite. Wu Chunyu et al. [31] [en]used feed avecdifferent β-glucan content De labrewer&#On a ensuite utilisé du chlorure d’ammonium pour effectuer un essai d’effort d’azote ammoniacal. Les résultats ont montré que les taux de mortalité des brasseurs de 400 et 600 mg/kg et de#39; S d’addition de levure β-glucane était significativement plus faible que celle du groupe sans addition. Une combinaison de modèles en parabole et en ligne brisée A été utilisée pour obtenir 41.#39; S la levure β-glucane contenue dans les aliments peut atténuer les dommages causés par le stress d’azote ammoniacal au bar des fleurs et améliorer sa capacité à résister au stress d’azote ammoniacal. Par conséquent, le β-glucane, en tant qu’additif alimentaire, peut atténuer la réponse au stress de différents poissons et crevettes dans des conditions spécifiques.
3 Applicationdu β-glucane en aquaculture
3.1 effet sur la performance de croissance des animaux aquatiques
Des études ont montré que l’ajoutβ-glucan to the feed can promote the growth De laaquatic animals. Changes in growth performance are closely related to changes in digestive enzymes. The activity De ladigestive enzymes directly reflects the degree De lafeed digestion and utilization. Higher activity indicates that the feed is more fully utilized and is more beneficial to animal growth [19]. Wang Wanliang et al. [35] [traduction]found that feeding young Atlantic Saumon (Salmotrutta) with feed Contenant:different amounts of β-glucan in a circular glass tank at a water temperature of 13–14°C CChad a positive effect on growth. However, as the amount of β-glucan added gradually increased, the specific growth rate and digestive enzyme activity of the young Atlantic Le saumonfirst increased and then decreased, indicating that the effect of β-glucan on the growth performance of young Yalong salmon may be related to the amount added, and the strength of digestive enzyme activity may be the main factor affecting the growth performance of young Yalong salmon. The addition of 0.2% to 0.4% β-glucan to the feed can significantly increase the protease and amylase Activités activitésin the intestine of Vanamei shrimp, and the growth performance is significantly improved. It is inferrougethat the improvement of the growth performance of Vanamei shrimp may be closely related to the increase in digestive enzyme activity [19].
Zhao et al. [29] ont constaté que dans une expérience de culture à long terme avec Penaeus vannameipendant 84 jours, une faible dose de β-glucane (250 mg/kg) peut favoriser la performance de croissance principalement comme source d’énergie, tandis qu’une dose élevée de β-glucane (500 mg/kg) peut stimuler la réponse immunitaire. Divya et al. [42] [traduction]ont ajouté Saccharomyces cerevisiae) β-glucane a augmenté de façon significative le poids corporel final et amélioré la performance de croissance du tilapia du Mozambique (Oreochromis mossambicus) cultivé sous stress ammoniacal. La raison peut être que le β-glucane améliore l’immunité cellulaire, l’immunité humorale et la réponse antioxydante du tilapia du Mozambique, réduit la consommation de nutriments pour la réponse immunitaire, et obtient ainsi plus de nutriments pour répondre aux besoins de croissance [43 -44]. La truite arc-en-ciel cultivée dans des bassins en béton à 11-13 ℃ et alimentée avec un régime alimenté en une quantité appropriée de β-glucane (un mélange de β-1,3-glucane et de β-1,6-glucane) peut augmenter significativement leur taux de prise de poids, leur taux de croissance spécifique et augmenter le volume du corps du poisson [4 5-46]. Le β-glucane peut favoriser le métabolisme des nutriments tels que les graisses et les protéines en modifiant la flore intestinale du loach(Misgurnus anguillicaudatus), améliorant ainsi l’absorption des nutriments et favorisant la croissance animale [40].

Cependant, certaines études ont montré que le β-glucane n’a aucun effet stimulant sur la croissance des animaux aquatiques. Liang Zhi-ling et al. [20] [en]ont ajouté de la levure de β-glucane à l’alimentation des tortues juvéniles à coquille molle à bec jaune (Truogx sinensis) et ont constaté qu’elle n’avait aucun effet significatif sur les tissus, les organes ou la croissance. Gu et al. [9] ont nourri du turbot contenant de la levure de β-glucane et ont constaté qu’il n’avait aucun effet significatif sur la performance de croissance ou l’utilisation des aliments. Li Yong-juan et al. [47] [traduction]nourris de juvéniles jaunes de pélteobagrus fulvidraco n’ont pas eu d’effet significatif sur la croissance. La raison peut être que l’alimentation β-glucane provoque l’animal aquatique#39; S le corps doit être dans un état d’activation immunitaire à long terme, et le corps redistribue les nutriments, avec pour résultat final aucun effet significatif sur la croissance des animaux aquatiques [35]. Par conséquent, l’application du β-glucane dans la production aquacole devrait tenir compte de divers facteurs tels que sa source, la quantité ajoutée, le type d’animal aquatique et le milieu d’élevage.
3.2 effet sur la santé intestinale des animaux aquatiques
La microécologie intestinale des poissons est sensible aux changements environnementaux externes, à l’invasion de bactéries nuisibles et à d’autres facteurs, qui peuvent perturber l’homéostasie intestinale et nuire à la santé des poissons. L’ajout d’une quantité appropriée de β-glucane à la nourriture peut améliorer l’activité des enzymes digestives, améliorer la capacité digestive et d’absorption de l’intestin, et améliorer l’efficacité d’utilisation de la nourriture [48]. Des études ont révélé que l’ajout d’une quantité appropriée de β-1,3-glucane à l’aliment peut augmenter significativement l’activité du loach' S des enzymes digestives intestinales, mais des doses élevées de β-1,3-glucane ne continuent pas à augmenter l’activité des enzymes digestives [37]; Nourrir les jeunes saumons Yalong avec des aliments contenant du β-glucane peut augmenter l’activité des enzymes digestives intestinales et améliorer la capacité de digestion intestinale [35]; Le cas échéant, L’alimentation l’alimentation en β-glucane de levure de carpe Penzer crucian a été trouvée que, par rapport au groupe témoin, l’ajout de β-glucane de levure peut augmenter considérablement la hauteur des plis intestinaux et des microvilloses, augmenter l’activité de l’amylase et de la trypsine, et améliorer considérablement la digestion intestinale [18]; L’ajout de 0,02% de β-glucane de levure à la nourriture peut augmenter considérablement l’abondance de Bacillus Bacillus et de Bacillus subtilis dans l’intestin, augmentant considérablement l’activité de l’amylase et de la protéase intestinales.
Cela peut être lié à la capacité du bacille à produire de la protéase, de l’amylase et de la lipase dans l’intestin. Ajouter 0. 0,04% de β-glucane a augmenté significativement l’abondance du bacille et du Chitinibacterium, tandis que l’abondance du Citrobacter, du Microbacterium et du Mycobacterium a été significativement réduite [19]; L’alimentation de la truite arc-en-ciel avec du β-1,3-glucan a considérablement augmenté le nombre de lactobacilles dans l’intestin, améliorant ainsi la santé intestinale [45]. Souza et al. [32] ont appliqué du β-glucane dans l’eau d’élevage du tilapia du nil et ont constaté que le β-glucane pouvait augmenter considérablement l’abondance des phyla Firmicutes, des fusobactéries et des protéobactéries sous stress hypoxique.
Substituting fish meal with soybean meal can have a negative impact on the intestines of Atlantic salmon (Salmo salar) and sockeye salmon (Oncorhynchus tshawytscha). After feeding on a diet complétéwith yeast β-glucan, the height of the intestinalemucosal folds of turbot was significantly increased, the fusion of mucosal folds was reduced, and decreased width of the lamina propria and leukocyte infiltration [9, 49]; β-glucan alleviates the negative Les effetsof entériteon aquatic animals by promoting the expression of neurotransmitters such as acetylcholinesterase, serotonin, and substance P, thereby reducing mechanical damage to the intestines [50]. Ji et al. [46] [traduction]studied the effect of yeast β-glucan on intestinal inflammation induced by trinitrobenzenesulfoniqueacid (TNBS) in arc-en-cieltruiteenteritis, and found that yeast β-glucan can reduce TNBS-induced enteritis, reduce the mortality rate of arc-en-cieltrout, and slow down the percentage of weight loss during rainbow truiteenteritis. Therefore, in the future, experiments should be carried out on the Les effetsof β-glucan on the intestinal health of different aquatic animals, and the dosage and addition cycle of β-glucan should be adjusted according to the intestinal absorption characteristics and the structure and abundance of the flora of different aquatic animals.

3.3 effet de la supplémentation combinée en β-glucane sur les animaux aquatiques
Des études ont montré que l’utilisation combinée de stimulants immunitaires multiples a un meilleur effet immunitaire que l’ajout d’un seul type de stimulants immunitaires [51]. L’ajout combiné de plusieurs substances est principalement basé sur la stabilité, l’adaptabilité, l’innocuité et l’effet synergique de divers ingrédients pour déterminer le type et le rapport des substances ajoutées [52].
Miao et al. [53] [traduction]ont étudié l’effet du β-glucane (Saccharomyces Les cerevisiaeβ-glucane et Torulopsis ferment lysat) en combinaison avec une souche probiotique de Pediococcus acidilactici PA-GY2 isolée de l’intestin de Macrobrachium rosenbergii (crevette rosenberg). L’utilisation combinée de PA-GY2 et de brewer' S la levure β-glucane peut améliorer significativement la performance de croissance et l’activité lipase de Macrobrachium rosenbergii. L’ajout combiné de PA-GY2, brewer' S la levure β-glucane et la levure β-glucane réduisent considérablement le coefficient d’alimentation et améliorent les performances de croissance. L’utilisation combinée de PA-GY2 et de brewer&#La levure β-glucane ou la levure β-glucane peuvent augmenter l’expression immunitaire et réduire la mortalité.
Jami et al. [10] [traduction]ajouté brasseur ' S levure IgM, lysozyme, complément et complément substitué au sérum (ACH50) dans l’alimentation de base de la truite brune caspienne pour améliorer l’immunité non spécifique. L’ajout individuel et combiné de stimulants immunitaires peut réduire ou augmenter la transcription de gènes liés à l’inflammation (tnf-α, IL-1β et IL-8). Brasserie ' S levure β-glucane le glucane seul ou en association avec Lactobacillus plantarum(Lp) a augmenté significativement l’expression de l’arnm IL-8, mais la combinaison de β-glucane, mannan-oligosaccharide(MOS) et Lp a réduit significativement l’expression de l’arnm IL-8. Des études ont révélé que les MOS peuvent améliorer la performance de croissance en augmentant le poids corporel, l’efficacité de la conversion alimentaire, l’amélioration de la structure intestinale et la régulation positive de la flore intestinale [54]; Lp peut favoriser l’absorption du β-glucane, améliorer l’activité des enzymes du tube digestif, la performance de croissance et l’efficacité d’utilisation de l’alimentation des animaux aquatiques, inhiber l’adhésion et la croissance des bactéries pathogènes, améliorer le niveau des enzymes du tube digestif, l’immunité, et améliorer l’hôte et#39; S résistance aux maladies et taux de survie [55-56].

The combined addition of β-glucane poudre and MOS to the feed of carp (CyprinusCarpio)can significantly improve the growth rate, intestinal La santéand immunitéof carp [57]; the combined addition of β-glucan and heat-inactivated lactobacilles(HK-LP) to the feed significantly réduitthe feed coefficient and améliorethe growth performance of young loach, among which the feed The most significant effect was achieved by adding 1% β-glucan and 1% HK-LP to the feed[40] ; synbiotics (β-1,3-glucan combined with protein and Bacillus licheniformis) can improve growth performance by stimulating the sécrétionof extracellular enzymes by the intestinal flora of Mozambique fish and increasing intestinal absorption. It can also enhance antioxidant capacity by enhancing the activity of active oxygen and stimulating the release of antioxidant enzymes to enhance antioxidant capacity [58]; synbiotics (Saccharomyces cerevisiae, mannan-oligosaccharides and β-glucan) increased the survival rate Et antioxydantcapacity of Nile tilapia infected with Pseudomonas aeruginosa, possibly because the mannan-oligosaccharides in the synbiotics can attach to certain Gram bacteria, preventing infectionand thus improving the fish' S immunité et défense contre les maladies infectieuses [59].
3.4 effets des différentes méthodes d’alimentation du β-glucane sur les animaux aquatiques
Studies have shown that short-term (<30d) feeding of β-glucan can enhance Non spécifiqueimmunity, and long-term feeding of β-glucan may have immunosuppressive Les effetson aquatic animals [14, 60]. Li Fudong et al. [61] reported that in a temperature-controlled aquarium at (25±5) °C, continuous long-term (60d) feeding of feed supplemented with 0.15% and 0.50% β-glucan significantly reduced the lysozyme and acid phosphatase activities and survival rate of carp, with no significant effect on growth performance.
Koch et al. [25] ont constaté que l’alimentation du tilapia avec une nourriture additionnée de β-gluane à 1% pendant 60 jours dans un aquarium à température contrôlée à 26 °C favorisait significativement la croissance et augmentait l’immunité. Il est recommandé d’envisager une alimentation à long terme avec du β-glucan. Zhao Hongxia et al. [41] ont ajouté 0. L’alimentation continue ou intermittente de 1% de β-1,3-glucane à la crevette Vanamei a montré que l’alimentation à intervalle ou continue de β-1,3-glucane n’avait aucun effet significatif sur la performance de croissance de la crevette Vanamei, mais que l’alimentation intermittente augmentait significativement l’activité de la lipase chez la crevette Vanamei, encourageait le métabolisme de l’énergie et des protéines chez la crevette, et l’alimentation intermittente de 14jours de β-1,3-glucane réduisait significativement la mortalité due au stress nitrite de l’azote chez la crevette Vanamei. Le 3-glucane a considérablement réduit le taux de mortalité de la crevette Vannamei sous stress nitrite azote.

Li Yongjuan et al. [47] ont conçu un groupe d’alimentation de base, ajoutant 200, 600 et 1000 mg/kg de levure β-glucane à trois groupes d’alimentation continue et à trois groupes d’alimentation intermittence pour étudier l’effet du β-glucane de levure sur les indicateurs physiologiques des jeunes croakers jaunes. Les résultats ont montré que le groupe d’alimentation continue avait un taux de prise de poids significativement plus élevé que le groupe d’alimentation intermittente correspondant. De plus, l’alimentation intermitte ou continue n’a eu aucun effet significatif sur les indicateurs biochimiques sériques, la capacité anti-infectionet la performance de croissance des jeunes croakers jaunes. En résumé, l’effet positif de l’alimentation intermittable sur les animaux aquatiques peut être lié à la source de β-glucane, au type d’animal d’élevage, au cycle d’élevage, au milieu d’élevage, à la formule et à la quantité ajoutée, etc.
4 résumé
Au fur et à mesure que l’industrie aquacole se développe, divers problèmes dans le processus de reproduction sont devenus de plus en plus importants. La pollution de l’environnement, l’utilisation aveugle d’antibiotiques et les infections des poissons ont commencé à menacer la santé des animaux aquatiques et des humains.
The immunostimulant β-glucan powder has been used in a variety of fields, and a large number of studies have proven its functions of promoting growth, enhancing immunity, resisting oxidation, and resisting stress. As a green additive in aquaculture, β-glucan is one of the aquafeed additives with the greatest development potential in the future. However, there are still many problems that need to be solved in its application, and research is still needed in the following areas: ① There are many species of aquaculture in China, and further research is needed to evaluate the appropriate dosage and timeliness of β-glucan in different aquatic animals. ② La Chineis a vast country, and the appropriate requirements of aquatic animals in different breeding environments, breeding modes, breeding seasons, and breeding stages the appropriate requirements for β-glucan still need to be studied in detail; ③ the appropriate requirements for β-glucan should be assessed according to actual production conditions based on different evaluation criteria such as optimal growth performance, intestinal function, product quality, La maladierésistanceand stress resistance; ④ when multiple additives are used in combinaisonin feed, whether there is synergy or antagonism between β-glucan and other additives, as well as the impact of nutrient metabolism on the aquatic environment, still need to be studied in depth; ⑤ the signal pathways by which β-glucan affects the physiological functions and metabolic functions of aquatic animals still need to be further explored. reaction, as well as the impact of nutritional metabolism on the aquatic environment, etc., still require in-depth research; (5) the signal pathways by which β-glucan affects the physiological functions and metabolic functions of aquatic animals have yet to be further explored.
Références:
[1] [traduction] XU:d Y, SHAO Q Q J. : J. : J. : La recherche Progrès réalisés in Régulation immunitaire effect of β-g lucans on Poisson [J]. Revue chinoise of Les animaux La Nutrition, En 2019, 31(7) : 2971-2980. (en chinois)
[2] [traduction] ZHAO auauL Y, Le FANGL Y, JIANG L S, et al. Fonctions biologiques of β-g lucan and its application in Alimentation des ruminants [J]. Revue chinoise of Les animaux La Nutrition, 2020, 32(5) :2003-2009. (en chinois)
[3] [traduction] M. :MURPHY E E J, J, REZOAGLI E, E, MAJOR Je, et al. Propriétés et potentiel métaboliques et immunomodulateurs du β-g lucan for clinique Application [J]. Revue de pressede laFungi, 2020, 6(4) :356.
[4] [traduction] Mon - sun C F, Mon - sun X, Mon - sun C R, et al. Caractéristiques caractéristiques of β-g lucan and its regulation Sur l’animal immunitaire Fonction [J]. Revue de presseof Huazhong agricole Université, 2003, 2003, 2003, 22(1) : 95 — 100. (en chinois)
[5] [traduction] WANG WANG Q, SHENG X, SHI SHI A, A, et al. β-g lucans: Relations entre modification, conformation et activités fonctionnelles [J]. Molécules, 2017, 22(2) :257.
[6] [traduction] JIN S., S., S.Research status of main functional components in Oat [J]. La Chine La Science and La technologieInformation, 2010, 9 :114-115.
[7] YI J J JJ JJ JH, YANG F, NIE Q, et al. Evolution de la recherche sur le β-g lucanen yeast cellule mur in Aquaculture [J]. Chine Feed, 2016, 14:41-44.
[8] LIU Y, WU Q, WU X, et al. Structure, préparation, Modification, et bioactivités de β-g lucanet Mannan - mannanà partir de yeast cellule Mur: A Revue [J]. Revue internationale de biologique Macromolécules, 2021, Article 173:
445-456.
[9] GU M, PAN S, L lQ, et al. Évaluation et comparaison de la levure β-g lucan and Carboxyméthylg lucan to improve the immunité and Le ventre health of turbot nourri Régime alimentaire contenant 400 g/kg de tourteau de soja [J]. Rapports sur l’aquaculture, 2021, 21 :100882.
[10] JAMI N ° de catalogueJ, ABEDIAN K A, PAKNEJAD H, et al effets of diététique B-g lucan, mannan Oligosaccharide, lactobacillus P lantarum and leur Les combinaisons Sur la croissance P erformance, immunité and immunitaire Gène connexe expression of La mer caspienne Truite, Salmo Trutta caspius (Kessler, 1877)[J]. Le poisson & Mollusques et crustacésImmunology, 2019, 91 :202-208.
[11] [traduction] FELIX D M, JACINTO E C, CRDOVA AI C, et al. Réponse physiologique et antioxydante de Litopenaeusvannameicontre Vibrio parahaemolyticus Infection après avoir reçu des régimes complétés contenant Dunaliella sp. La farine and β-g lucans [J]. Revue de pressede pathologie des invertébrés, 2022, 187:107702.
[12] [en] Le JIL Q, soleil G X, WANG Y, et al. réglementation De β- g lucan on stress Le processus of rainbow trout Infecté par aeromonassalmonicense [J]. Journalof fisheries SciencesofChina, 2018, 25(1) :178-188. (en chinois)
[13] REGLA N ° de catalogueM, MARA D N ° de catalogueO, LUIS M, et al. Beta g lucan améliore the response to SVC/SVC infection Dans zebrafish[J]. développement and Comparative Immunology, 2018, 84:307-314.
[14] ALVAREZ-RODRGUEZ ZM, PEREIRO P, REYESLPEZ F E, et al. Analyse des réponses de longue durée induites par des immunostimulants et de leurs effets sur une infection virale en Poisson zèbre (Danio rerio) [J]. Frontières en immunologie, 2018, 9 :1575.
[15] KRISHNAN R, JANG Y, OH M. Beta g lucan induit immunitaire P rimer protège against nervous necrosis virus infection in Bande de sept Mérou [J]. Le poisson &Mollusques et crustacésImmunology, 2022, 121 :163-171.
[16] [traduction] PERVEEN S, YANG L, ZHOUS, et al. β-1,3-g lucan de euglène Gracilis. as an L’immunostimulant agit comme médiateur de l’effet antip arasitique contre Mesanophrys sp. sur les octets hémocytes chez le crabe marin nageant (Portunus trituberculatus) [J]. Poisson &Immunologie des mollusques, 2021, 114:28-35.
[17] DAWOOD N ° de catalogue A Ô, ABDO S E, GEWAILY N ° de catalogue S,et al. influence of diététique β-g lucan on Immunisé, Transcrip tomique, inflammatory and Troubles de la santé mentale caused B y deltaméthrine toxicité in Tilap ia du nil (Oreochromisniloticus) [J]. Poisson &Mollusques et crustacésImmunology, 2020, 98:301-311.
[18] CAO CAO H, YU D, ZHANG Y, et al. Les effets of La supplémentation alimentaire en β-g lucanet bacillus subtilis sur la croissance, Filet de filet Qualité, immunitaire Capacité, Et statut antioxydant of Pengze crucian carp (Carassius
auratus var. Pengze) [J]. L’aquaculture, En 2019, 508:106-112.
[19] [traduction] LI H, XU C, ZHOU L, et al. bénéfique effects Evolution de la croissance et de l’état de santé du poisson blanc du pacifique shrimp Litopenaeus vannamei at Faible salinité [J]. Poisson &; Immunologie des mollusques, 2019, 91: 315-324.
[20] LIANG Z L, MA Y P, FENG G Q, et al. Les effets De β-g lucan on G croissance P erformance, immunitaire Et antioxydant Indices de prix of Trionyx sinensis [J].Guangdong Agriculture et pêche Les Sciences, En 2019, 46(4) : 95-100. (en chinois)
[21] [en] AKHTAR M S, TRIPATHI P H, PANDEY A, et al. β-g lucan Module l’expression de gènes immunitaires non spécifiques, thermique tolérance and élicits Résistance aux maladies chez Tor putitora endang ered frire Mise en question avec Aeromonas salmonicida [J]. Poisson & Shellfish Immunology, 2021, 119 :154-162.
[22] [en] Mon - sunJ, DAI B T, WANG H M, et al. Les effets De l’ajout de β-g lucan to feed on the G de croissance, Index immunitaires, transcriptome et flore intestinale de Epinephelus fuscoguttatus × Epinephelus lanceolatus ♂ [J]. Revue de pressede l’agriculture du sud, 2022, 53(5) :1434-1447.
[23] [en] Mon - sun J, J, La loi Y, DONG DONG Z, et al. Dommages toxicologiques sur le cuivre exposition to IgM+ B cellules De tilap ia du nil (Oreochromis niloticus) and Mesures d’atténuation of Son défavorable effects B y β-g lucan Administration [J]. Toxicology inVitro, 2022, 81 :105334.
[24] WANG L, ZHANG X X, WANG D M, et al. Effet de stimulation immunitaire fβ-1,3-g lucan sur les cellules sanguines d’écrevisses rouges [J]. Journal de l’agriculture du sud, 2019, 50(4) :883-890. (en chinois)
[25] KOCH J F A, DE OLIVEIRA C A F, ZANUZZO F S. diététique β-g lucan (MacroGard® ) improves Immunitaire inné Les réponses and La maladie resistance in Nile tilapia Peu importe of the administration P eriod[J]. Poisson &; Shellfish Immunology, 2021, 112 :56-63.
[26] [en] shituléni A S, FANG G, SONIA A N ° de catalogue Et al.effets of yeast Pol ysaccharide on Indices biochimiques, antioxydant Statut, Histo p atholo gique Lésions et expressions g énétiques liées au métabolisme de la lèvre souris fed with high Matières grasses Régime alimentaire [J]. Bioactive glucides et fibres alimentaires, 2016, 8(2) :51-57.
[27] [traduction] BELL S, GOLDMAN V V L, bistrien B R, et al. Effet de Beta-g lucan from l’avoine and yeast on Sérum d’identification des lèvres [J]. critique commentaires in La nourriture La Science Et Nutrition, 1999, 39(2) :189-202.
[28] LOPES L M F, MELLO M M D, URBINATI E C. β-g lucan reduces cortisol P lasma Niveaux, Améliore inné Système immunitaire Après un. Inoculation hydrophile, and has Lipol ytic effects on the Pacu (Piaractus mesopotamicus) [J]. Aquaculture, 2022, 546 :737411.
[29] ZHAO H X, CAO J L, WANG A, et al. effet De long terme administration of diététique β-1,3-g lucan Sur la croissance, P hysiolo gique, and immunitaire Les réponses À Litopenaeus vannamei ( Boone, Boone, 1931 ) [traduction] J ]. Aquaculture International, 2012, 20(1) :145-158.
[30] YANG G, QIU H, YU R, et al. Supplémentation alimentaire of β-g lucan, l’inuline and Emodin module la réponse antioxydante et supprime l’inflammation intestinale de grass Carpe (Ctenopharyngodon) Idellus) [J]. Les animaux Feed ScienceandTechnology, 2021, 272:114789.
[31] A propos de nousC Y, CAO J M, HUANG HUANGY H, et al. Effets de la supplémentation en β- g lucan sur les performances de croissance, la composition corporelle, les Indices de prixbiochimiques sériques et la résistance au nitrogène ammoniacal stress of Cul de mer (Lateolabrax japonicus) [J]. chinois Journal of Les animauxNutrition, 2013, 25(12) :3033-3040.
[32] SOUZA F P D, LIMA E C S D, PANDOLFI C F,et al. effet of β-g lucan in water on G croissance p erce, état sanguin et microbiote intestinal dans le tilap ia sous hypoxie [J]. Rapports sur l’aquaculture, 2020, À 17:100369.
[33] [traduction] CAO J M, ZHAO H X, HUANG Y H, et al. β-g lucanet its application in aquatic Animaux [J]. Feed Industry, 2013, 34(18) :1-6.
[34] [traduction] LIU LIU Y, HUANG G. Les conditions de travail The dérivatisation and antioxidant activities of yeast Mannan [J].InternationalJournalofBiologicalMacromolecules, 2018, 107(PtA) :755-761.
[35] WANG L lL, ZHOU J L, CHEN M Q, et al. Effets de β-g lucan on G croissance, intestinal Creuser estive Activités enzymatiques and liver antioxidant capacity of J uvenile asiatique Salmon [J]. sud-ouest China Journal De l’agriculture Les Sciences, 2021, 2021, 2021 3 (3) : 673-678.
[36] WANG Y H, ZHANG J S, ZENG L. :effet protecteur et mécanisme de β-g lucansur J uvenile grand cropfish jaune sous hypoxique Stress [J]. Journal De la pêche of La Chine, À partir de 2018 42(6) : 828-837. (en chinois)
[37] Le ZHU M, WU S. The G croissance P erformance Et non spécifique immunité of loach Paramisgurnus dabryanus as affectés B y diététique β-1,3-g lucan[J]. Poisson &; Shellfish Immunology, 2018, 83 :368-372.
[38] [traduction] BAGNI M, ROMANO N, FINOIA M G, et al. Court - et À long terme effects of a diététique yeast β-g lucan
(macrogard) and alginique acid (ergosan) Préparation sur immune response in sea bass (Dicentrarchus labrax) [J]. Poisson & Immunologie des mollusques, 2005, 18(4) :311-325.
[39] [traduction] DAWOOD M A O, oh, KOSHIO S, ISHIKAWA, Japon M, Et al. Physiolo gique Réponse, sang La chimie P rofile et Le mucus secretion of rouge sea daurade (Pagrus majeur) fed Régimes alimentaires supplemented with Lactobacillus rhamnosus sous low La salinité Stress [J]. Le poissonPhysiology and Biochemistry, 2017, 43(1) :179-192.
[40] CHEN J L, GUO D Y, ZHAO B, et al. Les effets Des bactéries β-g lucane et lactique inactivées dans l’alimentation sur la croissance des cellules intestinales gras acid Composition et immunitaire P erformance of J uvenile Loach [J]. Acta (Acta)hydrobiologique Sinica, En 2019, Article 43(1) : 52-59.
[41] ZHAO H L, CHEN D, lu W Y, et al. Les effets De diététique β-1,3-g lucan on G croissance P erformance, Le métabolisme sérique, immune-related gene expression Et résistance to nitrite Nitro gen stress in Litopenaeus vannamei [J]. Acta hydrobiologique Sinica, 2021, 2021, 2021 45(3) :593-600. (en chinois)
[42] «DIVYA» M, GOPI N, ISWARYA A, A, et al. β-g lucanextrait de Saccharomyces, micro-organisme unicellulaire du chant eucaryote Cerevisiae: diététique Supplémentation et amélioré ammoniac stress tolérance on Oreochromis mossambicus[J]. microbien Pathogenèse, À partir de 2020, 139 :103917.
[43] [traduction] WANG Y, Le JIL Q, SUN G X, et al. Effets de l’alimentation β-g lucan on P artificiel G croissance indices and Indices physiologiques du sang De la truite arc-en-ciel [J]. Advances inFishery Science, 2018, 39(3) :65-71. (en chinois)
[44] [traduction] Mon J L, QI Z L. Les effets of β-g lucan on G performances de croissance et indices biochimiques sériques De poisson-chat jaune (Pelteobagrus) Fulvidraco) [J]. Pêches de Hebei, 2017, 3 :1-4.
[45] [traduction] KHANJANI M H, GHAEDI G, SHARIFINIA M. Les effets of Régimes alimentaires containing β-g lucan on La survie, G croissance P erformance, Hématologique, immunité Et biochimique parameters of rainbow Truite (Oncorhynchus mykiss) Fing erlings[J]. Aquaculture Research, 2022, 53(5) :1842-1850.
[46] JI L, Mon - S, JI R, et al. β-g lucan Trinitrobenzène atténué sulfonic Induit par l’acide entérite in l’arc-en-ciel trout (Oncorhynchus mykiss ) [J]. Aquaculture, 2019, 513 :734393.
[47] LI Y J, WANG W M, HUANG Y H, et al. Effets du β-g lucan supplementation on G croissance P erformance, Indices biochimiques sériques et résistance à aeromonas hydro p hila infection of J uvenile jaune Silure (Pelteobagrus fulvidraco) [J]. Journal chinois de l’animal La Nutrition, En 2015, 27(12) : 3754-3762.
[48] [traduction] PILARSKI F, FERREIRA D O C, DARPOSSOLO D S F,et al. différent bêta-glucanes improve the Performance de croissance et résistance bactérienne chez Niletilapia[J]. Poisson &; Shellfish Immunology, 2017, 70:25-29.
[49] [traduction] BOOMAN M, förster I, VEDERAS J C, et al. Le soja Induit par les repas enteritis in atlantique salmon (Salmo Salar) and chinook salmon (Oncorhynchus tshawytscha) mais pas chez le saumon rose (O.gorbuscha)[J]. Aquaculture, 2018, 483 :238-243.
[50] [traduction] CHEN L, l L, JIANG Y, et al. Les effets of Des bêta-g lucans de paroi cellulaire de levure de pain chez des souris avec constip ation induite par l’eramide [J]. Journalof medical Food, 2019, 22(10) :1009-1021.
[51] [traduction] BERNAL M G,MARRERO R M,CAMPA-CRDOVA A I, et al. probiotique effect De streptomyces souches seul or in combination Avec bacilles et lactobacilles dans les élevages of the Crevettes blanches Litopenaeus vannamei [J]. Aquaculture International, 2017, 25(2) :927- 939.
[52] [traduction] CAO H, WANG A G, LIU G D. additifs composés et leur application[A]. La 8ème Chine alimentaire internationale Les additifs and ingrédients exposition and La 11e nationale La nourriture Les additifs La Production and
Application Technology Exposition [C]. 2004.
[53] MIAO S, HAN D, ZHAO C, et al. Les effets of Pediococcusacidilactici gy2diététique simple ou combiné avec des saccharomyces cerevisiae Ou/et β-g lucan on La croissance g, Inné inné immunité response and Résistance aux maladies de Macrobrachiumrosenbergii[J]. Poisson &Shellfish Immunology, 2020, 98:68-76.
[54] [traduction] DIMITROGLOU A, MERRIFIELD D L, SPRING P, et al. Les effets of mannan oligosaccharide (MOS) supplémentation on G croissance P erformance, Utilisation alimentaire, intestinale Histolo gie and Le ventre microbiote De dorade dorée (Sparus aurata)[J]. L’aquaculture, 2010, 300(1-4) :182-188.
[55] [traduction] Le CHIU C, GUU Y, LIU C, et al. immunitaire Réponses et gene expression in blanc Crevettes, Lito penaeus vannamei, induit B y Lactobacillus plantarum[J]. Le poisson & Shellfish L’immunologie, En 2007, 23(2) :364-377.
[56] [traduction] Tableau de bord G, RAMAN R P, PANI Le PRASAD K, et al.Evaluation de l’applicabilité paraprobiotique de Lactobacillus plantarum in Roving imp the Réponse immunitaire and La maladie Protection des données in géant Crevettes d’eau douce, acrobrachiumrosenbergii (de Man, 1879) [J].Fish & Shellfish L’immunologie, En 2015, 43(1) :167-174.
[57] [traduction] MAGOUZ F I, SALEM M F I, EMARA A E I, et al. A mélange of β-g lucan and Mannanoligosaccharide amélioré the G croissance Taux, Creuser estive Activité enzymatique, intestinal Morphométrie, and immunity De commun carp (Cyprinus carpio) [J]. Les annales Of Animal Science, 2021, 21(3) :1027-1041.
[58] [traduction] ANJUGAM M, ISWARYA A, A, SIBIYA A, A, Et al. Interaction moléculaire anale lyse de β-1,3 La commission des communautés européennes a publié un avis sur la proposition de directive du conseil modifiant la directive 77/93 / cee concernant le rapprochement des législations des états membres relatives aux mesures à prendre contre la pollution de l’air par les émissions des véhicules à moteur et de leurs moteurs. immunostimulant La propriété in Oreochromis
Mossambicus [J]. Le poisson & Shellfish Immunology, 2022, 121 :183-196.
[59] [traduction] EL-NOBI G, HASSANIN M, KHALIL A A, et al.effets synbiotiques de Saccharomycescerevisiae, mannan oligosaccharides, et β-g lucan on Inné inné L’immunité, antioxidant Statut, and disease resistance of Tilap nil ia, Oreochromis niloticus [J]. Antibiotiques, 2021, 10(5) :567.
[60] [traduction] YAMAMOTO F Y, YIN F, ROSSI W J, et al. Bêta - 1,3 g de lucan dérivé d’euglena g racilis and Algamune améliore Inné inné immune Les réponses of red Tambour (Sciaenops) ocellatus L.) [J]. Fish & Shellfish Immunology, 2018, 77:273-279.
[61] LI F D, YE J D, WANG K et al. Effets de l’alimentation continue à long terme du β-g lucan sur les performances de croissance et non-specific immune fonction of Cyprinus carpio[J]. chinois Journal of Animal La Nutrition, 2009, 21(4) :499-505.
-
Précédent précédent
Le bêta glucane est-il bon pour vous?
-
Suivant:
Quelles sont les utilisations de la poudre de bêta glucane dans l’alimentation animale?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



