Le Stachyose peut-il être utilisé dans l’alimentation animale?
Stachyosebelongs to α-galactose oligomers and is mainly found in various plants such as the Lamiaceae, Fabaceae, and Scrophulariaceae families, especially in plants in the Lamiaceae family' S Osmundaceae genre. Actuellement, les principales méthodes de préparation du stachyose sont l’extraction physique et les méthodes enzymatiques. En utilisant le plantain, l’herbe verte et stachys tuberifera comme matières premières, la teneur en stachyose extraite à l’aide de la méthode d’extraction physique est généralement de 20% à 70% [1]. En utilisant stachys tuberifera comme matière première, la pureté du stachyose préparé à l’aide de techniques de purification biologique et de séparation par chromatographie industrielle atteint 90% [2].
La teneur en stachyose dans les oligosaccharides de soja produits à partir du soja et de leurs sous-produits transformés est généralement de 18 à 71%. Dans la définition des oligosaccharides de soja dans GB/T 22491-2008, les oligosaccharides de soja d’une pureté de 75% contiennent généralement 18% de stachyose, 6% de raffinose et 24% de saccharose. Zhang Shuangshuang et al. [3] ont extrait le stachyose avec une pureté de 90% en fermentant le lactosérum protéiné de soja avec de la levure. Le Stachyose est également le principal composant fonctionnel des oligosaccharides de soja [4]. Ces dernières années, la recherche sur le stachyose en Chine a progressivement augmenté. En plus des domaines originaux de l’alimentation et de la médecine, l’application du stachyose dans la production animale a également attiré de plus en plus d’attention.
1 structure moléculaire et propriétés physiques et chimiques du stachyose
Le Stachyose est composé d’une molécule d’α-glucose, d’une molécule de β-fructose et de deux molécules d’α-galactose, liées de la manière du galactose (α1→6) -galactose (α1→6) -glucose (α1→2β) -fructose, et est donc également connu sous le nom de tétrose [5]. La formule moléculaire du stachyose est C24 H42 O21, avec une masse moléculaire relative de 666,59. La formule de la structure moléculaire est illustrée à la Figure 1. Selon la diffraction monocristalline à rayons x, le stachyose appartient au système cristallin monoclinique et forme une structure en couches tridimensionnelles par liaison d’hydrogène [5-6], comme le montre la Figure 2.
Figure 1 formule de structure moléculaire du stachyose
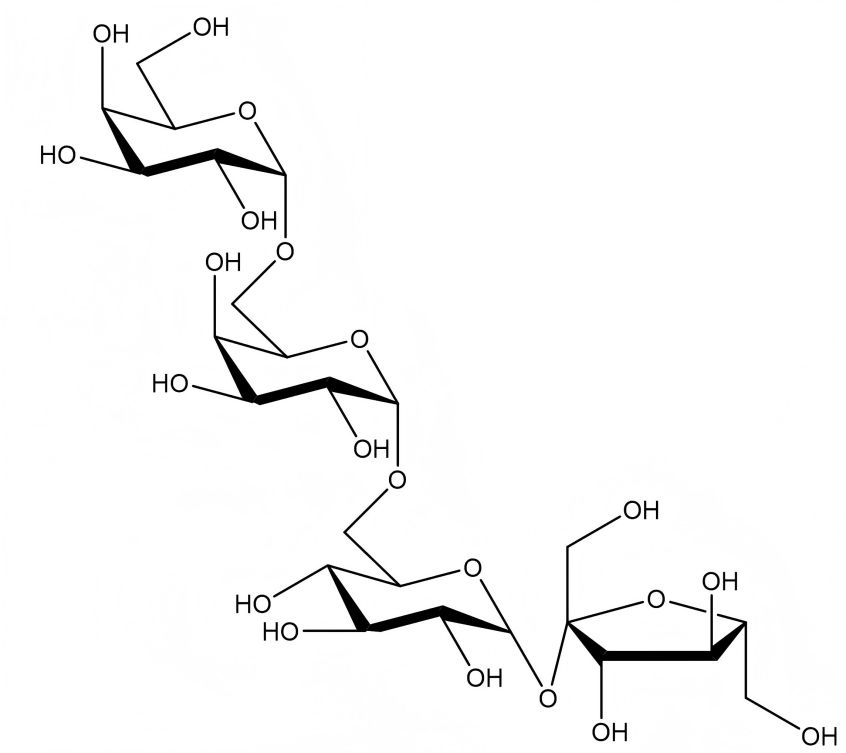
Pure stachyose is a white poudre. Its sweetness is 22% that of sucrose, and it has a refreshing taste with no peculiar smell. Stachyose crystallizes into small crystals combined with 4 molecules of water. It is easily soluble in water, with a solubility of 130 g (20 °C). It is insoluble in organic solvents such as ether and ethanol. Its melting point is 101 °C. It can lose its crystal water when heated in a vacuum. The melting point of anhydrous stachyose is 167 ~ 170 ℃, and its moisture retention and moisture absorption are both lower than those of sucrose. It has no reducing properties. Guo Meili et al. [7] proved in a series of toxicological tests that stachyose is safe and non-toxic.
2 Application du stachyose dans l’industrie alimentaire
En raison du manque d’enzymes digestives qui digèrent les liaisons α-1,6-glycosidiques dans le système digestif des humains et des animaux monogastriques, le stachyose peut entrer directement dans l’extrémité inférieure du tube digestif, où il est fermenté et utilisé par les bifidobactéries et un petit nombre de lactobacilles dans l’intestin. Par conséquent, les oligosaccharides non digestibles comme le stachyose sont également connus sous le nom de fibres alimentaires ou de prébiotiques [8]. Le développement et l’utilisation des fructooligosaccharides se sont répandus dans les pays développés comme les États-Unis, le Japon et l’europe. Avec la maturité de la technologie de production de fructooligosaccharide et la promotion de son application, ses perspectives de développement ont progressivement attiré l’attention et l’attention de la Chine. De nos jours, il existe 153 brevets liés aux fructooligosaccharides en Chine, dont 29 brevets sur la technologie de production de fructooligosaccharides, 2 brevets sur la technologie de test de fructooligosaccharides, et le reste sont tous des brevets sur l’application des fructooligosaccharides [1].
2.1 réguler l’équilibre de la flore intestinale
Hayakawa et al. [9] ont montré que les oligosaccharides de soja contenant 23% et 71% de raffinose après purification peuvent être efficacement utilisés par Bifidobacterium dans l’intestin humain, augmentant significativement le nombre de bifidobactéries dans les selles. Luo et al. [10] ont préparé un milieu de culture à base d’oligosaccharides de soja, de stachyose, de raffinose et de saccharose, et l’ont inoculé avec Bifidobacterium adolescentis et Escherichia coli provenant respectivement de matières fécales humaines. Ils ont découvert que le stachyose était le principal facteur favorisant la croissance des bifidobactéries. Shu Guowei et al. [11] ont montré que l’addition de 0,8% et 1,0% de raffinose au milieu pour les bactéries lactiques (MRS) peut accélérer considérablement la croissance de Bifidobacterium bifidum BB01. En plus d’utiliser de préférence des oligosaccharides non digestibles dans l’intestin, Bifidobacterium peut également consommer de préférence du xylose dans des conditions où plusieurs oligosaccharides non digestibles coexistent. Par conséquent, le xylose peut directement et sélectivement proliférer Bifidobacterium [12].
2.2 améliore le body' S fonction immunitaire
En raison de la structure α-1,6-galactose dans la molécule de raffinose, et basé sur le mécanisme moléculaire du récepteur sympathique activé, il est impliqué dans les processus biologiques tels que l’adsorption entre les cellules immunitaires et les pathogènes. Cela donne à raffinose la fonction de prévenir les infections pathogènes, de neutraliser les toxines et de réguler le système immunitaire [13]. Après avoir administré à des souris une dose quotidienne de 0,2 mL de saccharose soluble dans l’eau (pour 10 g de poids corporel) par gavage pendant 30 jours consécutifs, on a constaté que leur immunité corporelle et leur fonction macrophage mononucléaire étaient toutes deux positives [14]. En outre, sous l’action des bifidobactéries, le saccharose soluble dans l’eau peut être décomposé pour produire de multiples facteurs de fonction immunitaire qui améliorent le corps et#39; S immunité.
2.3 soulage la constipation et prévient la diarrhée
Les Xylooligosaccharides sont petits,Fibres alimentaires solubles dans l’eauQui sont préférentiellement utilisés par les bifidobactéries dans le gros intestin, produisant de grandes quantités d’acides gras à chaîne courte tels que l’acide acétique, l’acide propionique et l’acide butyrique [15]. Il a été rapporté que 103 patients constipé qui prenaient un supplément quotidien contenant 5 g de xylooligosaccharidesont connu une amélioration des selles et une amélioration de la fonction intestinale [16]. En outre, la molécule de fructan a un grand nombre de groupes hydroxyle, qui peuvent bien absorber l’eau dans l’intestin, soulageant la diarrhée [17]. En outre, fructan a également les fonctions de protéger le foie, inhiber le cancer, inhiber la dermatite atopique, anti-arthrite, prévenir la carie dentaire, prévenir la colite, excréter le plomb, abaisser la pression artérielle et les lipides sanguins, anti-oxydation et anti-vieillissement [18].
3 Application du stachyose dans l’alimentation animale
3.1 effet du stachyose sur la flore intestinale de la volaille
Pacifici et al. [19] [traduction]ont montré que l’injection artificielle de raffinose à 5% et 10% dans la cavité amniotique d’embryons de poulet incubés jusqu’au jour 17 et incubés jusqu’au jour 21 (éclosion) a montré que raffinose ou raffinose avait un effet bénéfique sur la flore intestinale, l’utilisation biologique du fer et la fonction morphologique du tissu muqueux intestinal chez les embryons de poulet. Les Xylooligosaccharides peuvent être fermentés et utilisés par Bifidobacterium et un petit nombre de Lactobacillus dans le cecum des poulets de grattage, et leur taux de fermentation est le deuxième après celui du raffinose dans les oligosaccharides de soja [20].
Yi Zhonghua [21] a montré que l’ajout de 1,0% d’une préparation de xylooligosaccharide à l’alimentation augmentait significativement le nombre de bifidobactéries et de lactobacilles dans la digesta cecale des poulets de chair, et réduisait significativement le nombre de Escherichia coli et de Salmonella dans la digesta cecale. Lan et al. [22] [en]ont utilisé des bactéries de cecum de poulets de grillage de 14 jours comme inoculum et des oligosaccharides de soja fermentés in vitro. Les résultats ont montré que, comparativement aux oligosaccharides de soja et au raffinose, le stachyose avait la plus grande production de gaz et le taux de production de gaz, et inhibait significativement la croissance d’escherichia coli et de Clostridium perfringens. Yang Guiqin et al. [23] ont montré que l’ajout de 1,0% de stachyose augmentait significativement la richesse de la flore dans le contenu des cecaux in vitro des poulets de chair et favorisait la propagation de bactéries du genre Brachysporangium, du genre Bacteroides et du genre Lactobacillus.
Sous l’action de la fermentation des bifidobactéries, raffinose produit une grande quantité d’acides gras à chaîne courte dans l’intestin, ce qui réduit considérablement le pH dans l’intestin. Dans cet environnement, la prolifération de bactéries nuisibles peut être inhibée et l’équilibre microécologique intestinal peut être ajusté. Toutefois, Jiang et al. [24] [traduction]ont signalé que, à l’exception de l’effet important du raffinose sur la concentration de butyrate dans le cecum des poulets de chair au stade initial, il n’a pas eu d’effet positif à d’autres égards. Cependant, Yizhonghua [22] a constaté dans son étude que l’addition d’une préparation d’eau et de sucre à l’alimentation augmentait significativement la concentration d’acide acétique et d’acides gras à chaîne courte dans la digesta cecale des poulets de chair, ainsi que le pourcentage mole d’acide butyrique dans la quantité totale d’acides gras à chaîne courte. Augmenté, le pH des digesta cecal et iléal a montré une tendance à la baisse; En outre, l’addition de 0,5% d’une préparation de xylose a permis de réduire efficacement la teneur en azote basique volatil dans l’intestin, empêchant ainsi la prolifération des bactéries putréfactives intestinales précoces des poulets à griller.
3.2 effets du raffinose sur la morphologie des organes digestifs et des muqueuses intestinales de la volaille
Des facteurs tels que les polyamines intestinales, le facteur de croissance épidermique, les acides gras à chaîne courte et le pH affectent tous la structure morphologique du tube digestif de la volaille. La plupart de ces facteurs sont régulés par les nutriments dans les aliments, et les oligosaccharides non digestibles sont l’un des régulateurs importants [25]. Yi Zhonghua et al. [26] ont montré que l’ajout de différents niveaux de stachyose augmentait le poids absolu des organes digestifs des poulets de chair, en particulier le cécum et le côlon. Le conseil des ministresAddition de 0,5% de stachyoseAugmentation significative de la hauteur des villottes du duodéum, du jéjunum et de l’iléon des poulets de chair, réduction significative de la profondeur de la crypte du jéjunum et de l’iléon, et augmentation de la hauteur des villottes et de la profondeur de la crypte du jéjunum et de l’iléon.

3.3 effets du raffinose sur le rendement de la volaille et la digestibilité des nutriments
Raffinose est un oligosaccharide non digestible. En raison de sa fonctionnalité unique et de sa non-digestibilité, il a un effet important sur la physiologie digestive et le métabolisme des nutriments des animaux, affectant ainsi la digestion et l’absorption de divers nutriments et, finalement, la performance des animaux. Jiang et al. [24] ont montré qu’en ajoutant 1,2% de raffinose à la nourriture dans la nourriture par rapport à la farine de soja normale, il n’y avait aucune différence significative dans la digestibilité des nutriments dans la nourriture par les poulets de chair, mais que la quantité de sucre soluble dans l’eau ajoutée augmentait, la digestibilité des nutriments dans la nourriture par les poulets de chair diminuait légèrement. Yi Zhonghua [21] a montré que l’ajout de 0,5% d’une préparation de xylooligosaccharide avait des degrés divers d’amélioration du taux d’utilisation apparente des nutriments dans l’alimentation, tandis que l’ajout de 2,0% d’une préparation de xylooligosaccharide diminuait considérablement l’utilisation apparente a été considérablement réduite. Parmi eux, le calcium, le phosphore, les fibres de détergent neutre et les fibres de détergent acide ont été plus affectés par la quantité de xylose ajoutée à l’alimentation. La raison principale est qu’une dose élevée de xylose accélère le débit de la nourriture dans le tube digestif.
L’ajout de stachyose à l’alimentation des poulets à griller peut entraîner une diminution du gain de poids quotidien moyen et de l’efficacité alimentaire. À mesure que la quantité de stachyose ajoutée augmente, la croissance des poulets de chair montre une diminution linéaire et une tendance de croissance quadrangulaire [24]. Yi Zhonghua et al. [27] ont montré qu’il existe une relation dose-réponse entre l’effet du stachyose sur la performance de croissance des poulets de chair. Une faible dose (0,5%) A montré un léger effet de promotion, tandis qu’une dose élevée (2,0%) A montré un effet inhibiteur. De plus, le degré de réponse de la dose au cours de la première période de croissance était plus élevé qu’au cours de la dernière période de croissance.
3.4 effet du focuse sur la fonction immunitaire de la volaille
Wang Liwan et al. [2, 8] ont montré que certainsoligosaccharides, including fucose, can promote the development of immune organs such as the thymus and bursa of Fabricius in egg-laying chicks, and reduce the emission of ammonia (NH3), hydrogen sulfide (H2 S) and other malodorous substances in feces. Adding 0.5% of a fructooligosaccharide preparation to the feed has a tendency to increase the spleen index of 18-day-old broiler chickens, and can significantly increase the serum immunoglobulin A (IgA) content of 18-day-old broiler chickens, but significantly reduce the spleen index of 36-day-old broiler chickens [29]. Therefore, fucose can be used as an immune enhancer to improve the immune function of animals, and its immunomodulatory effect may be achieved mainly by regulating the intestinal microecology of animals [30].
4 Application de focuse dans l’alimentation des porcs
4.1 effet de la focalisation sur la flore intestinale des porcs
Le mécanisme d’action des xylooligosaccharides dans l’intestin du porc est le même que chez les poulets de chair, et l’effet est également similaire. Krause et al. [31] [en]ont d’abord signalé que, dans des conditions in vitro,xylooligosaccharides Peut être complètement fermenté par le porc post-sevrage ' S microorganismes de l’intestin arrière, et que ce processus de fermentation peut être accéléré par l’addition de niveaux élevés de lactose à l’alimentation. Accélérez. Zhang et al. [32] [traduction]ont montré que l’ajout de 1,0% de raffinose à l’alimentation augmentait significativement le nombre de Lactobacillus dans l’iléon porcin et le nombre de Bifidobacterium dans le cécum et le côlon, réduisait significativement le nombre de bactéries dans le côlon et augmentait significativement la teneur en acides gras volatils dans l’iléon, le cécum et le côlon. Cependant, des doses élevées de raffinose peuvent réduire le nombre de lactobacilles et de bifidobactéries dans le jéjunum, l’iléon, le cécum et le côlon [33].
4.2 effets du stachyose sur les performances du porc et la digestibilité des nutriments
Raffinose and stachyose in soybean meal are considered to be anti-nutritional factors in monogastric animals, mainly because they ferment in the hindgut of animals and have no positive effect on the provision of metabolic energy [34]. Smiricky et al. [35] [traduction]also showed that raffinose and stachyose reduced the digestibility of nitrogen and amino acids in pig feed, and that the digestibility of dry matter decreased significantly with increasing addition. It was found that adding α-galactosidase to a diet containing raffinose can eliminate this negative effect [36], because the enzyme can hydrolyze 80% of the raffinose in the small intestine of piglets, thereby significantly increasing the digestibility of dietary α-galactose. Although xylose has a negative effect on nutrient digestibility in pigs, the addition of 1.0% xylose to a soybean-free diet had no significant effect on piglet performance compared to a normal soybean meal diet, but significantly reduced the diarrhea rate of weaned piglets. However, when the addition reached 2.0%, piglet performance was significantly reduced in the first 2 weeks after weaning [32]. This shows that the dose effect of the impact of raffinose on piglet performance is very obvious, and also shows that the anti-nutritional properties of raffinose are mainly manifested in the digestibility of nutrients.

5 Application de stachyose Dans la production d’autres animaux tels que les animaux aquatiques
Cai Yinghua [37] a montré que le taux d’ingestion du flet augmentait de façon significative avec l’augmentation de la teneur en stachyose dans les aliments, mais que la digestibilité apparente de la matière sèche et des protéines dans les aliments tendait à diminuer. Après l’ajout de stachyose, de raffinose ou d’une combinaison des deux à l’alimentation, le poids et le taux de croissance du saumon atlantique se trouvaient entre ceux d’un régime contenant de la farine de poisson entier et d’un régime contenant de la farine de soja remplaçant une partie de la farine de poisson. Elle n’a pas eu d’effet significatif sur la digestibilité des protéines et des graisses [38]. Comparativement à un régime contenant 100% de farine de poisson, l’ajout de 300 g/kg de farine de soja a considérablement réduit la performance de croissance de la carpe argentée hétéromorphe juvénile, mais l’ajout d’une quantité modérée de stachyose, de raffinose ou de stachyose + raffinose n’a pas modifié significativement le statut de croissance et la morphologie intestinale des poissons au cours de la période d’essai de 8 semaines [39].
Le Stachyose n’a pas non plus eu d’effet significatif sur la composition corporelle et la flore intestinale de la carpe argentée hybride [40]. De plus, raffinose peut améliorer la fonction immunitaire non spécifique de la carpe argentée hétérotrophe dans une certaine mesure [41]. Des aliments fonctionnels (produits brevetés) contenant du stachyose ont été développés pour la prévention et le traitement de la maladie de la peau rouge chez la carpe de roseau [42]. Hu et al. [43] [traduction]ont montré que l’ajout de 1,25% de raffinose à la moulée a considérablement amélioré la performance de croissance, l’utilisation de la moulée et l’activité enzymatique digestive du turbot juvénile. L’ajout de 1,25% et de 5,00% de stachyose a considérablement augmenté l’abondance des bactéries cellulolytiques intestinales liées à la digestion et a augmenté la fonction barrière de la muqueuse intestinale du turbot juvénile. Toutefois, l’ajout de 2,5% à 5,0% de fructooligosaccharides a également entraîné une augmentation de l’apport alimentaire et une diminution de l’efficacité alimentaire du flétan. Lorsque l’ajout a atteint 5,0 %, bien que le nombre de bactéries bénéfiques dans l’intestin du turbot ait augmenté, le nombre de certaines bactéries pathogènes potentielles a également augmenté [44]. Cela montre que l’effet des fructooligosaccharides sur différentes fonctions (croissance, digestion, barrière muqueuse intestinale, etc.) d’un même animal varie avec la dose.

Outre les poulets, les porcs et les poissons, les effets positifs des fructooligosaccharides ont également été démontrés chez des animaux tels que les vers à soie, les singes rhésus et les souris. Chen Chuanjie et al. [45] ont montré que l’ajout de 0,50 % de fructooligosaccharides au régime alimentaire des vers à soie augmentait significativement le taux de vie global des pupes de vers à soie, la quantité de cocons entiers, la quantité de couches de cocons et le taux de couches de cocons. Li Haifang [46] a montré qu’après l’ajout de raffinose dans l’alimentation du singe rhésus, le nombre de lactobacilles dans l’intestin augmentait et le nombre d’escherichia coli diminuait. Après avoir nourri du stachyose poudre Pendant 6 semaines, les singes ont eu des selles normales et les fèces étaient d’aspect jaune et sous forme de bandes mobiles, ce qui indique que raffinose a amélioré la fonction intestinale des singes.
En outre, l’ajout de stachyose powder A également considérablement amélioré l’immunité et la résistance aux maladies des macaques. Li et al. [47] [traduction]ont constaté dans leur étude qu’une préparation oligosaccharide de soja contenant 55,3 % de stachyose, 25,8 % de stachyose et 9,7 % de stachyose favorisait la prolifération de bactéries bénéfiques dans l’intestin des souris, inhibait la prolifération de bactéries pathogènes et favorisait de façon significative le péristalse intestinal et l’élimination. Wei Yan et al. [48] ont montré que le synbiotique prébiotique fructo-oligosaccharide-Lactobacillus plantarum peut améliorer considérablement l’immunité cellulaire spécifique, l’immunité humorale et la fonction immunitaire non spécifique des souris à faible immunité, augmenter les niveaux de certains facteurs immunitaires dans le sérum et améliorer la fonction immunitaire des souris. Un essai de 4 semaines sur l’alimentation de rats atteints de diabète de type 2 (modèle) avec du stachyose A révélé que le stachyose affecte l’équilibre de la flore intestinale en modifiant l’expression de l’arn de la flore intestinale [49]. Une étude de Jiang-li Dou et al. [50] A montré que l’addition de 50 et 100 μg/mL de stachyose augmentait significativement l’activité des neutrophiles d’élevage in vitro de lapins, et augmentait également significativement la capacité des neutrophiles à phagocyter Staphylococcus aureus.
On peut constater que les recherches actuelles sur l’utilisation desstachyose in animal production mainly focuses on its effects on the intestinal flora, digestion and immunity of animals such as poultry, pigs and fish. 1) Similar to its effect on the human intestinal environment and intestinal flora, stachyose has a positive effect on adjusting the intestinal flora balance of animals such as chickens, pigs, fish, macaques monkeys and rats has a positive effect on the balance of the intestinal flora; 2) Fructooligosaccharides can increase the weight of the digestive organs of animals to varying degrees, improve the morphology of the intestinal villi, and enhance the barrier function of the intestinal mucosa; 3) Fructooligosaccharides have the function of preventing pathogen infection, neutralizing toxins and regulating the immune system. The main research results on the effects of stachyose on the intestinal flora, digestive capacity and immune function of poultry, pigs and aquatic animals are shown in Table 1.
6 résumé
Poudre de StachyoseEst dérivé de plantes naturelles, est très sûr et a un large éventail d’applications. L’application rationnelle de Stachyose peut considérablement améliorer l’équilibre de la flore gastro-intestinale et améliorer le body' S système immunitaire, mais il a peu d’effet sur les performances de production animale, et l’effet de dose est également très évident. Son application dans la production animale pose encore de nombreux problèmes, tels que les questions de coût, l’impact de la source de xylooligosaccharides, le niveau d’addition et la teneur en xylooligosaccharides dans l’alimentation de base sur son effet, et l’impact de l’ajout de xylooligosaccharides dans l’alimentation sur la qualité des produits animaux, la teneur en composés nalisants dans le fumier et d’autres fonctions physiologiques potentielles. D’autres recherches sont nécessaires, notamment sur le mécanisme d’action au niveau moléculaire. Bien que la recherche sur le stachyose en Chine ait commencé relativement tard, le développement et l’application du stachyose attirent une attention croissante. Au fur et à mesure que le coût de préparation du stachyose diminue, on pense que la portée des applications du stachyose continuera de s’élargir avec la poursuite des recherches, et les perspectives du marché deviendront encore plus larges.
Références:
[1] Zhang Jinzhe. Aperçu de la recherche et statut d’application de la fibre alimentaire soluble dans l’eau stachyose [J]. Food Safety Herald, 2014(13): 62-63.
[2] Zhang Jinzhe, Zhou Zhiqiao, Zeng Ming, et al. Méthode de préparation du stachyose de haute pureté à l’aide de la technologie de séparation chromatographique industrielle: Chine, CN: 101633676 [P]. Le 27 janvier 2010.
[3] Zhang Shuangshuang, Wang Liping, Wang Xichang. Conditions de Fermentation pour la préparation du stachyose à l’aide de lactosérum concentré de protéines de soja [J]. Soybean Science, 2008, 27(1): 137-140.
[4] Shi Yun. Étude sur le procédé et le mécanisme de purification des oligosaccharides dans la mélasse de soja [D]. Thèse de doctorat. Wuxi: université de Jiangnan, 2015.
[5] [traduction] Extraction et structure cristalline absolue du stachyose [J]. Chinese Journal of Structural Chemistry,2014,33(1) :65-70.
[6] Ma Yucui, Wang Chun, Wang Wei, et al. Élaboration d’un échantillon standard de stachyose [J]. Chinese Journal of Experimental Pharmacology, 2017, 23(14): 68-73.
[7] Guo Mei, Wanli Fang, Ping, Feng Xuan, et al. Essai toxicologique de sécurité du stachyose [J]. Journal of Toxicology, 2012, 26(3): 236-238.
[8] [traduction] PATEL S, GOYAL A. oligosaccharides fonctionnels :production, propriétés et applications [J]. World Journal of Microbiology and Biotechnology,2011,27 (5) :1119-1128.
[9] [traduction] HAYAKAWA K, MIZUTANI J, WADA K, et al.effets des oligosaccharides de soja sur la flore fécale humaine [J]. Microbienne Ecology in Health and Disease, 1990,3(6) :293-303.
[10] Luo Yu, Ma Lina, Cai Fangqin. L’effet probiotique des oligosaccharides de soja sur les bifidobactéries et les entéroobactéries dans l’intestin [J]. Advances in Modern Biomedicine, 2007, 7(3): 399-400.
[11] Shu Guowei, Ji Liyuan, Chen He, et al. Effet du raffinose, de l’oligosaccharide et du galactose sur la croissance des bifidobactéries [J]. Food Science and Technology, 2011, 36 (6): 6-8, 17.
[12] [en] MILANI C, LUGLI G A, DURANTI S, et al.les bifidobactéries présentent un comportement social par le partage des ressources carbohy- drate dans l’intestin [J]. Rapports scientifiques,2015,5 :15782.
[13] [en] HASHIMOTO H,YAMASHITA A,FUJITA K,et al.synthèse enzymatique de la galactooligosaccha- ride α-liée (α-GOS) et ses fonctions [J]. Journal of Ap- plied Glycoscience,2004,51(2) :169-176.
[14] Liu Xiuying, Hu Yixiu, Hu Yuming, et al. Étude expérimentale sur l’amélioration de l’immunité par l’administration orale de stachyose et d’extrait de jujube [J]. Chinese Journal of Tropical Medicine, 2009(3): 571-572,576.
[15] [traduction] TUOHY K M,ROUZAUD G C, br
[16] [traduction] LI T,LU X S,YANG X B.Evaluation of clinical safety and beneficial effects of stachyose-enriched α-ga- lacto-oligosaccharides on gut microbiote and intestinal function in humans[J].Food & function,2017,8(1) : 262-269.
[17] Duan Sufang. Fonction et application de stachyose [J]. Beverage Industry, 2016, 19(5): 74-78.
[18] Huang Weizhi, Zhong Xianfeng, Peng Jiawei et al. Une brève introduction à la production, la fonction et l’application du stachyose [J]. Food Industry Science and Technology, 2018(1): 327-332.
[19] PACIFICI S,SONG J,ZHANG C,et al.l’administration intra amniotique de raffinose et de stachyose affecte la fonctionnalité du bordé de la brousse intestinale et modifie les populations de mi- croflore intestinale [J].Nutrients,2017,9(3) :304- 313.
[20] [en] Grmanov
[21] Yi Zhonghua. Effets du raffinose sur la performance de croissance, la physiologie intestinale et la fonction immunitaire des poulets de chair [D]. Thèse de doctorat. Beijing: China Agricultural University, 2006.
[22] LAN Y,WILLIAMS B A,VERSTEGEN M W A,et al.Soy oligosaccharides in vitro fermentation charac- teristics and its effect on caecal microorganismes of young broiler chickens[J].Animal Feed Science and Technology,2007,133(3/4) :286-297.
[23] Yang Guiqin, Yang Hang, Liu Jizhe et al. Effets des oligosaccharides de soja et de leurs composants fonctionnels sur la production de skatoles fécaux et sur la composition de la flore dans le contenu du cecum des poussins de chair dans des conditions in vitro [J]. Journal de la Nutrition animale, 2017, 29(11): 4058-4068.
[24] JIANG H Q,GONG L M,MA Y X,et al. British Poultry Science,2006,47(4) :516-522.
[25] Zhang Pei, Yang Guiqin, Liu Haiying. Progrès de la recherche sur les effets et les mécanismes des oligosaccharides du soja sur la microécologie intestinale de la volaille [J]. Feed Industry, 2016, 37(5): 60-64.
[26] Yi Zhonghua, Ma Qiugang, Wang Xiaoxia et al. Effets du raffinose sur le développement des organes digestifs et la morphologie de la muqueuse intestinale des poulets de chair [J]. Journal of Jiangxi Agricultural University, 2010, 32(3): 566-570, 576.
[27] Yi Zhonghua, Ji Cheng, Ma Qiugang et al. Effet de l’ajout de stachyose à un régime à faible teneur en oligosaccharides sur les performances de croissance des poulets de chair [J]. China Feed, 2008(16): 12-13.
[28] Wang Li, Sun Ning, Su Jun, et al. Effet des oligosaccharides sur la performance de production d’œufs et la qualité de la coquille des œufs des poules pondeuses [J]. China Poultry, 2002, 24(3): 11-13.
[29] Yi Zhonghua, Ji Cheng, Wang Xiaoxia et al. Effet du stachyose sur l’indice des organes immunitaires et l’immunoglobuline sérique des poulets de chair [J]. Poultry Farming and Prevention of Poultry Diseases, 2009(2) :4-9.
[30] [en] Gao Yuming, Yang Xiaojun. Nutrition et immunité interagissent [J]. China Animal Husbandry Journal, 2005, 41(5) :3-5, 9.
[31] KRAUSE D O,EASTER RA,MACKIE R I.Fermentation of stachyose and raffinose by hind-gut bacteria of the weanling pig[J].Letters in Applied Microbiolo- gy,2010,18(6) :349-352.
[32] ZHANG L Y, LI D F, QIAO S Y, et al. Effects of stachyose on performance, diarrhée incidence and in testinal bacteria in weanling pigs[J].Archives of Ani- mal Nutrition,2003,57(1) :1-10.
[33] Pan Baohai, Sun Dongyan. Effet de la α-galactosidase et du stachyose sur les performances de croissance des porcelets sevrés [J]. Feed Industry, 2011 (supplément 1): 69-72.
[34] [traduction] HAGELY K B,PALMQUIST D,BILYEU K D.Classification of distinct seed gluate profiles in soy- bean[J].Journal of Agricultural and Food Chemistry, 2013,61(5) :1105-1111.
[35] SMIRICKY M R,GRIESHOP C M,ALBIN D M,et al.influence des oligosaccharides de soja sur la digestibilité apparente et réelle des acides aminés iléaux et la teneur en matières fécales chez les porcs en croissance [J]. Journal of Animal science - ence,2002,80(9) :2433-2441.
[36] [traduction] PAN B H,LI D F,PIAO X S,et al. Effet de la supplémentation alimentaire avec de la préparation de la α-galactosidase et du stachyose sur la performance de croissance, la digestibilité des nutriments et les populations bactériennes intestinales de porcelets [J].Ar- chiv
[37] Cai Yinghua. Effets de plusieurs facteurs anti-nutritionnels du soja sur la croissance et la physiologie digestive du flet (Paralichthys olivaceus) [D]. Maître ' S thèse. Qingdao: Ocean University of China, 2006.
[38] [traduction] Sørensen M, PENN M, EL-MOWAFI A, et al. Effet de la complémentation en stachyose,raffinose et saponine de soja sur la digestibilité des nutriments, les enzymes digestifs, la morphologie intestinale et les performances de croissance du saumon atlantique (Salmo salar L.) [J]. Aquaculture, 2011,314(1/2/3/4) :145-152.
[39] [traduction] KROGDAHL a.l’effet de la farine de soja (SBM) et de ses quatre facteurs chimiques sur les performances de croissance et la morphologie in testinal de la carpe argentique allogynogénétique jovenile (Carassius auratus gibelio) ♀ × Cyprinus carpio ) [C]// programme & Résumé du Symposium international sur la Nutrition et l’alimentation des poissons 2010.
[40] [traduction] CAI C F,WANG W J,YE Y T,et al. Effet de la farine de soja, du raffinose et du stachyose sur la croissance, la composition corporelle, la morphologie intestinale et la microflore intestinale de la carpe argentée allogynon génétique juvénile (Carassius auratus gibelio) ♀ × Cyprinus carpio) [J]. Aquaculture Research, 2012, 43 (1) : 128 — 138.
[41] Wang Wenjuan, Ye Yuantu, Cai Chunfang, et al. Effet de la farine de soja et de ses facteurs anti-nutritionnels sur la biochimie sérique et les indicateurs immunitaires non spécifiques de la carpe argentée hétérotrophique [J]. China Feed, 2010(18): 30-33, 41.
[42] Ji Guiju, Huang He, Li Xin. L’invention concerne un aliment fonctionnel pour prévenir et contrôler la maladie de la peau rouge chez la carpe graminée et un procédé de préparation de celui-ci. Chine, CN: 104187171B[P]. Le 2017-01-04.
[43] HU H B,ZHANG Y J,MAI K S,et al. [J].Journal of Ocean University of China,2015,14(5) :905-912.
[44] [traduction] YANG P,HU H B,LIU Y et al. Le stachyose alimentaire a modifié le profil du microbiote intestinal et amélioré la fonction de barrière muqueuse intestinale du turbot juvéniles, Scophthalmus maximus L. [J]. Aquaculture, 2018, 486 :98-106.
[45] Chen Chuanjie, Zhang Yaping, Gu Yinyu et autres. L’effet de l’ajout de fructooligosaccharides au régime alimentaire sur le taux de vie des pupes et cocons de vers à soie [J]. Chinese Sericulture, 2007, 28 (2): 30-32.
[46] Li Haifang. Détermination des bactéries intestinales chez des primates non humains en captivité et l’effet de l’inuline sur la flore intestinale [D]. Maître ' S thèse. Fujian: université d’agriculture et de foresterie de Fujian, 2015.
[47] LI T,LU X S,YANG X b.les α-galacto-oligosaccharides enrichis en stachyose régulent le microbiote intestinal et réactivent la constipation chez les souris [J].Journal of Agricultural and Food Chemistry,2013,61(48) :11825-11831.
[48] Wei Yan, Zeng Xiaoqun, Pan Daodong et autres. Effet des synbiotiques Fructo-oligosaccharide-Lactobacillus plantarum sur la fonction immunitaire chez la souris [J]. Chinese Journal of Food Science, 2014, 14(1): 14-19.
[49] [traduction] LIU G,BEI J,LIANG L,et al.Stachyose améliore l’inflammation en modulant le microbiote de l’intestin de l’alimentation riche en graisses/diabète de type 2 induit par streptozotocine-chez le rat [J].Molecular Nutrition & Food Research,2018, 62(6) :e1700954.
[50] Dou Jiangli, Tan Chengyu, Bai Xuefang et al. Effets du raffinose et du stachyose sur la fonction des neutrophiles dans le sang périphérique du lapin [J]. Fine and Specialty Chemicals, 2008, 16(3/4): 26-27.
-
Précédent précédent
Comment préparer le Stachyose?
-
Suivant:
Quelle est l’utilisation du Stachyose dans les boissons?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



