Comment préparer le Stachyose?
L’intestinhumain est un écosystème microbien complexe....... Il existe plus de 1000 espèces de bactéries, et l’équilibre écologique entre les bactéries bénéfiques et nuisibles affecte directement la santé de l’hôte [1-2]. Le Consensus scientifique sur les probiotiques (édition 2020)[3] affirme que les probiotiques peuvent améliorer la santé intestinale humaine en régulant le rapport de la flore dans l’intestin.
Le "food" Des probiotiques est appelé prébiotiques, qui est un nutriment largement reconnu avec la fonction de favoriser la croissance de bactéries intestinales bénéfiques pour former une structure de colonie favorable [4-6], et le concept de prébiotiques a été proposé pour la première fois par Giboson et Robefroid en 1995 [7], et le concept de probiotiques a été proposé pour la première fois par Giboson et Robefroid en 1995 [8]. Le concept de prébiotiques a été proposé pour la première fois par Giboson et Robefroid en 1995 [7], et les prébiotiques courants comprennent l’oligofructose, l’oligosaccharide de soja, les oligosaccharides, les oligosaccharides, l’oligoisomaltose, l’oligogalactose et les fructooligosaccharides [8]. Comparé aux prébiotiques communs, le fructose peut favoriser plus efficacement la prolifération de bactéries bénéfiques telles que Bifidobacterium intestinalis [9], qui est connu sous le nom de "super bifidogenic factor", et c’est une matière première populaire pour les aliments fonctionnels intestinaux ces dernières années [10].
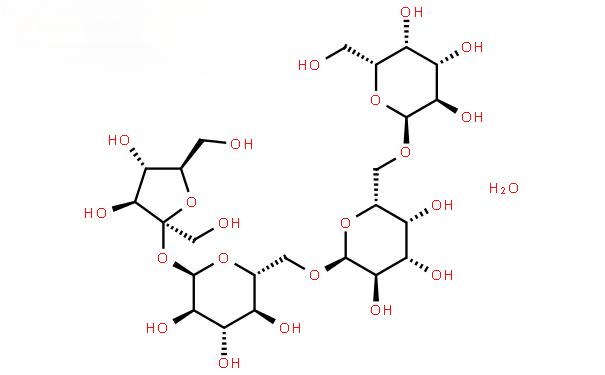
StachyoseEst un tétrasaccharide naturel, appartenant à la classe galactoside des glycosides de graines de coton, un oligosaccharide fonctionnel non réducteur [11-12], qui est une poudre blanche sous forme pure, légèrement sucrée, avec une douceur de 22% de celle du saccharose [13]. La formule moléculaire du fructose est C24H42O21, et la structure moléculaire est galactose-galactose-glucose-fructose (comme le montre la Figure 1), qui est un membre typique de la famille des oligosaccharides de graines de coton [14-15] (comme le montre la Figure 2), et il existe principalement dans les plantes du genre Fructus de la famille Labiatae. Ces dernières années, les fonctions physiologiques du fructose ont été continuellement explorées, et les fonctions rapportées jusqu’à présent incluent: l’immunomodulation, l’amélioration de la défécation, la prévention des lésions chimiques du foie, la synthèse des vitamines B, la promotion de l’absorption intestinale des oligo-éléments, la prévention du diabète sucré, etc. [16-21]. Le saccharose est largement utilisé dans les produits pharmaceutiques, les aliments, les cosmétiques et d’autres domaines [22].
La demande croissante des marchés nationaux et étrangers a une large perspective d’application, mais le manque de méthodes de production efficaces a conduit au coût élevé de la thréonine de haute pureté, limitant le développement de son application, par conséquent, il est de grande importance d’explorer une méthode rapide, efficace et peu coûteuse pour produire la thréonine de haute pureté.
La préparation dePoudre de Stachyose Est principalement divisé en deux étapes: l’extraction et la purification. Basé sur le développement actuel du processus de préparation du fructose, cet article passe en revue les progrès de la recherche sur l’extraction et la purification du fructose, et discute les avantages et les inconvénients des différents procédés de préparation, en vue de fournir des références pour les travaux de recherche liés à la production industrielle de fructose.
1 aperçu de la préparation du stachyose
Ces dernières années, il existe plus d’un millier de résultats de recherche sur le processus de préparation du fructose, qui impliquent différentes matières premières, méthodes et effets d’extraction. À l’heure actuelle, parmi les plus de 10 types d’oligosaccharides sur le marché international, à l’exception des oligosaccharides de soja et des sucres de graines de coton, le reste des oligosaccharides sont principalement préparés enzymatiquement [23], parce que le coût de la préparation enzymatique du fructose est plus élevé, et le rendement est plus faible [24], de sorte que l’extraction du fructose à partir de plantes naturelles est le principal de la préparation du fructose, qui est plus adapté à la production industrialisée. Les matières premières végétales qui peuvent être utilisées pour l’extraction du fructose comprennent: Dioscorea, Salvia miltiorrhiza, Ginkgo biloba (également connu sous le nom de ver de grasse herbacée), Zeran, soja, etc. [25-27]. La Figure 3 montre le déroulement du processus de préparation traditionnelle du fructose.
Comme le montre la Figure 3, le processus traditionnel de préparation consiste à extraire les matières végétales par macération, décoloration, dessalement, séchage et autres opérations pour obtenir l’extrait de fructose, sur la base de laquelle, les chercheurs ont combiné avec des technologies biologiques, physiques, chimiques et autres pour optimiser davantage les conditions expérimentales, afin d’améliorer la pureté du fructose. Les procédés d’extraction courants du fructose sont divisés en trois types principaux: l’extraction par solution, la fermentation microbienne et l’extraction enzymatique, et les méthodes courantes de purification comprennent la séparation sur membrane, la purification par chromatographie sur colonne et la cristallisation.
Récemment, Gerliani et al. [28] ont constaté que dans l’extraction des protéines, des hydrates de carbone solubles et des minéraux de la farine de soja en utilisant l’électroactivation en combinaison avec des solutions phytochimiques, une certaine quantité de fructose et de sucres de marshmallow étaient présents dans les échantillons d’analyte et de catalyseur obtenus, et leur contenu augmentait avec la tension de l’anode dans une certaine plage de tension, jusqu’à 222,49 mg/g et 34,29 mg/g, respectivement. Les résultats de cette expérience pourraient fournir une nouvelle orientation technique pour l’extraction du fructose.
2 avancement du procédé d’extraction de la poudre de stachyose
2.1 méthode d’extraction des solutions
Solvent extraction is the most traditional method of extraction and is commonly used to extract active ingredients from natural plants. Based on the principle of similarity and solubility, the solvent with the highest solubility for the extract is chosen to extract it from the solvent with the lowest solubility. The solvents commonly used for the extraction of fructose are water and ethanol. Depending on the purpose of the study, the appropriate extracting solution, raw material, and extraction process should be selected.
2.1.1 méthode d’extraction unique
Lorsque l’eau est utilisée comme solvant d’extraction, le coût d’extraction est faible et la pénétration de l’eau dans les cellules végétales est forte. Zhang Min et al. [29] ont utilisé de l’eau désionisée comme solvant pour extraire le fructose de Radix et Rhizoma Dioscoreae, et les meilleures conditions d’extraction ont été analysées par des essais univoques et orthogonaux, et les meilleures conditions d’extraction ont été obtenues à une température d’extraction de 50 °C, avec un rapport matière/liquide de 1:12 (kg/L) et une durée d’extraction de 60 minutes, ce qui donne un taux d’extraction de 58,84 % du fructose. Plus de chercheurs ont choisi d’utiliser la sauterelle comme matière première, en raison de la teneur élevée en fructose dans la sauterelle [30], et sa texture cassante, la teneur élevée en eau des caractéristiques de la texture, Yao Hong et al. [31] ont utilisé la méthode d’homogénéisation des produits frais, l’utilisation de cisaillement mécanique et hydraulique sera sauterelle fraîche broyant dans la pulpe, de sorte que la substance active sortent, et est plus propice à l’extraction du fructose, Le taux final d’extraction du fructose a atteint 91,62 %. Après une purification en plusieurs étapes,96.10% purity of fructose powder was obtained. The study of high purity and low cost of fructose extraction is expected to provide a reference for the industrial preparation of high-purity fructose, but when water is used as the extracting solution, the water is prone to mildew and deterioration, and it is not easy to be preserved.
Lorsque l’éthanol est utilisé comme extractif, il présente les avantages d’une forte perméabilité et d’une plus longue période de conservation par rapport à l’extrait à l’eau, mais différentes concentrations d’éthanol ont un plus grand impact sur les composants extraits. Zhong et al. [32] ont utilisé la méthode de la surface de réponse pour étudier l’influence de différents facteurs sur l’extraction du fructose dans les barres d’argent, et les résultats finaux ont montré que l’influence de la taille du rapport matier-liquide > Ratio de volume d’éthanol > Température d’extraction > Le temps d’extraction, de sorte que la clé pour utiliser l’éthanol comme extractif est d’explorer et de contrôler la concentration optimale d’extraction d’éthanol. Les résultats finaux ont montré que l’influence du rapport matériel-liquide > Ratio de volume d’éthanol > Température d’extraction > Le temps d’extraction, de sorte que la clé pour utiliser l’éthanol comme solution d’extraction est d’explorer et de contrôler la concentration optimale d’extraction d’éthanol.

2.1.2 méthodes auxiliaires d’extraction
La seule méthode d’extraction à l’eau ou à l’alcool n’est pas efficace et a beaucoup d’impuretés, il faut donc généralement la combiner avec certaines techniques auxiliaires. L’extraction assistée se réfère à la méthode d’extraction de la solution par des techniques physiques ou biologiques, telles que les ultrasons, les micro-ondes, l’ultra-haute pression et d’autres techniques assistées. Les techniques assistées sont basées sur une seule méthode d’extraction, assistée par la lixiviation des extraits, suivie par la centrifugation, l’élimination des impuretés par surnageant et les étapes d’affinage, semblables au procédé représenté sur la figure 3, et l’opération spécifique est basée sur la nature des impuretés effectivement produites. L’utilisation de techniques d’extraction assistée peut augmenter de manière significative l’efflux d’ingrédients actifs de la plante [33-35].
L’extraction assistée par ultrasons est en fait l’utilisation d’ultrasons avec effet de cavitation, effet mécanique et effet thermique, accélérer la vitesse du mouvement moléculaire et augmenter la pénétration du milieu, pour accélérer la dissolution des ingrédients actifs [36]. Wang Qi-Wei et al. [37] ont utilisé la méthode d’extraction assistée par ultrasons à l’eau pour extraire le fructose dans le ver de grès d’herbe, les résultats montrent que l’effet sur le taux d’extraction dans l’ordre décroissant est le temps d’extraction > Puissance ultrasonique > La température d’extraction; Hu Binjie et al. [38] ont constaté que, dans la technologie assistée par ultrasons, le temps d’extraction de la méthode d’extraction à l’eau peut être réduit de 3/4 et le taux d’extraction des polysaccharides augmenter de 30,00%. Cependant, la technologie ultrasonique doit contrôler le temps ultrasonique, trop long détruira la structure des polysaccharides, de sorte que la chaîne de sucre se brise, ce qui entraîne une réduction du taux d’extraction.
Le principe de l’extraction assistée par micro-ondes est d’utiliser les substances polaires à l’intérieur de la cellule pour absorber et convertir l’énergie des micro-ondes en énergie thermique, de sorte que la température intracellulaire augmente rapidement, l’eau se vaporise et la pression intracellulaire augmente, rompant ainsi la membrane cellulaire et la paroi cellulaire pour former des fissures ou des pores, puis accélérant l’entrée de l’agent extrayant de l’extérieur de la cellule pour dissoudre les substances efficaces et ensuite s’écouler hors de la cellule. Chen Chuanyun et al. [39] ont inventé une méthode d’extraction au micro-ondes pour le fructose et ont obtenu 15 kg de fructose à partir de 50 kg de Bombyx mori frais, d’une pureté de 90,02%, qui se caractérise par un temps d’extraction court et une grande efficacité. Cette méthode se caractérise par un temps d’extraction court et un rendement élevé. La prémisse de la méthode assistée par micro-ondes est que le matériau traité devrait avoir une bonne absorption d’eau et le produit devrait avoir une bonne stabilité thermique.
UHP-assisted extraction of bioactive components from natural plantsEst une technologie émergente. Cette technique peut effectivement accélérer le taux de transfert de masse, rompre les cellules végétales pour augmenter le taux d’extraction, raccourcir le temps de traitement et réduire la consommation de solvant. Wu et al. [40] ont utilisé une extraction à haute pression pour extraire des polysaccharides et des β-glucans du mycélium d’aspergillus mycelium, et l’extrait traité à haute pression présentait une teneur plus élevée en polysaccharides et une activité plus forte que l’extrait conventionnel imbibé de boues.
La méthode assistée par explosion de vapeur est l’utilisation de la haute température et haute pression - méthode instantanée de décharge de pression, de sorte que l’énergie interne des molécules de vapeur a pénétré dans le tissu végétal en énergie mécanique, détruisant les couches cellulaires des tissus de biomasse, accélérant ainsi la sortie du contenu cellulaire [41]. Tout comme la méthode assistée par micro-ondes, les deux méthodes utilisent le changement de pression physique pour favoriser la dissolution des extraits, en évitant la contamination secondaire causée par le traitement chimique, et sont caractérisées par un faible coût et la non-pollution.
Hong Feng et al [41] ont utilisé la technologie d’explosion à la vapeur pour extraire des xylooligosaccharides du maïs, l’essai a montré que les sucres dans le liquide d’explosion à la vapeur sont principalement des oligosaccharides et certains polysaccharides solubles, dans la pression de vapeur de 1,60 MPa et 2,00 MPa sous la pression dimensional pendant 5 min, le rendement final des oligosaccharides de 36,00% à 59,00%. Cette méthode n’est pas actuellement utilisée dans la préparation du fructose, mais la structure et la fonction des xylooligosaccharides et du fructose sont similaires, comparables, et le fructose est thermiquement stable, la méthode d’explosion à la vapeur peut devenir une nouvelle façon d’aider l’extraction du fructose.
2.2 fermentation microbienne
La fermentation microbienne est actuellement la méthode la plus économique pour purifier le fructose, et ces dernières années, des études sur la préparation du fructose par fermentation microbienne ont continué à émerger. La fermentation microbienne utilise des microorganismes pour consommer sélectivement certains sucres comme source de reproduction métabolique, qui se caractérise par la consommation préférentielle deOligosaccharides non fonctionnels, améliorant ainsi la pureté des oligosaccharides fonctionnels de l’ingrédient cible. La clé de la fermentation microbienne est de contrôler les facteurs qui influent sur la croissance et le métabolisme des microorganismes [42], comme le type et le nombre de microorganismes (purs ou mélangés), l’activité enzymatique et l’environnement de fermentation (température, oxygène, pH, etc.).
2.2.1 Types et nombres de microorganismes
L’étude et l’analyse des caractéristiques de fermentation de certains microorganismes et de leur utilisation rationnelle peuvent améliorer efficacement la pureté des produits cibles [43]. Wang Zhirong [44] a étudié l’effet de la fermentation de Lactobacillus, trois types de levures, Aspergillus oryzae et Fusarium. Les résultats ont montré que Aspergillus oryzae et Saccharomyces cerevisiae étaient appropriés pour la fermentation et la purification du fructose, et Saccharomyces cerevisiae avait le meilleur effet: le taux de rétention du fructose par Saccharomyces cerevisiae après 48 h de fermentation était de 93,31%, ce qui représente 87,04% de la teneur totale en sucre. Shu Danyang et al. [45] ont enregistré la dégradation des mono- et disaccharides et du fructose chez Aspergillus Niger, Aspergillus oryzae, Lactobacillus casei, Lactobacillus swissii et Lactobacillus rhamnosus par cinq souches afin de fournir une référence pour la sélection de microorganismes dans le domaine de la fermentation microbien pour la préparation du fructose.
Dans l’industrie des aliments fermentés et des enzymes, l’effet de la fermentation mixte est meilleur que la fermentation pure [46]. La fermentation mixte présente les avantages de la symbiose multibactérienne, de la complémentation enzymatique et du renforcement mutuel, et peut surmonter le problème de la grande concentration de produits intermédiaires de fermentation purs. L’application de la technologie de fermentation mixte à la purification du fructose peut effectivement améliorer l’efficacité de la purification du fructose.
Wang Xue et al. [47] ont utilisé Aspergillus japonicus et lactobacillus mixte bactéries fermentation pour purifier le fructose à partir de barres d’argent. Les résultats ont montré qu’après la fermentation mixte bactéries, les composants de saccharose et monosaccharides dans l’extrait ont été réduits par rapport à la fermentation pure, la quantité totale de saccharose et monosaccharides a été réduite à 3,00%, et le taux de rétention du fructose était supérieur à 95,00%, ce qui représente 90,00% de la teneur totale en sucre, Qui a été combiné à la chromatographie industrielle pour purifier davantage le fructose, et finalement obtenu la pureté du fructose. Combiné avec la technique de séparation chromatographique industrielle, la pureté du fructose était 90.00%~95.00% (du sucre total), et cette méthode a été appliquée par de nombreuses entreprises célèbres en Chine.
2.2.2 activité enzymatique
Les Enzymes sont l’un des facteurs importants affectant la fermentation microbienne, et des inhibiteurs d’enzymes qui favorisent la consommation de mono- et disaccharide ou inhibent la dégradation du fructose peuvent être ajoutés pour améliorer rapidement la pureté du fructose et raccourcisser le temps d’extraction. Zhou et al. [48] ont étudié les effets de deux inhibiteurs de la sucrase, le sel disodique de l’acide éthylènediamine-tétraacétique (EDTA-2Na) et l’acide ascorbique/vitamine C (VC), sur la purification du fructose lors de la fermentation d’aspergillus Niger avec l’utilisation du ver à soie Pseudomonas sylvestris comme matière première. L’effet de deux inhibiteurs de sucrase, à savoir la fermentation d’aspergillus Niger et l’acide ascorbique/vitamine C, sur la purification du fructose. Les résultats ont montré que l’addition d’une quantité appropriée d’inhibiteurs de la sucrase pouvait effectivement réduire la probabilité de dégradation de la sucrase d’a. Niger au cours du processus de fermentation, et donc augmenter la teneur en A. Niger. La quantité optimale d’edta-2na était de 0,01% de la masse du liquide extrait, et la pureté du fructose était de 80,43% dans les conditions optimales d’essai.
2.2.3 environnement de Fermentation
Pendant la croissance et le métabolisme des microorganismes, les nutriments et l’énergie fournis par l’environnement de fermentation affectent directement l’efficacité de la biosynthèse et la qualité des produits cibles, il est donc nécessaire d’étudier les conditions de culture optimales pour les souches sélectionnées.
Dans l’étude de Xie Jin[49], les conditions affectant la fermentation microbienne ont été étudiées de façon plus approfondie. Dans cette étude, 0,01% d’aspergillus Niger et 0,01% de Lactobacillus casei ont été utilisés comme combinaison optimale de fermentation et de fermentation.
Les résultats ont montré que le taux de rétention du fructose dans le groupe de fermentation synchronisée était 10,12% plus élevé que celui du groupe de fermentation retardée après 36 h de fermentation, ce qui est dû à un effet synergique entre les micro-organismes, et la fermentation synchronisée est plus bénéfique pour l’amélioration de la pureté du fructose dans l’extrait que la fermentation retardée. Le pH du bouillon de fermentation variait de 5,5 à 7,0, ce qui était favorable pour ralentir la dégradation du sassafras sans affecter la consommation de saccharose par les microorganismes.
Therefore, it is known that microbial fermentation for the purification of fructose is characterized by low production cost and simple process, but the composition of the product is more complex, and the quality of the product is affected by a variety of factors.
2.3 extraction enzymatique
L’extraction enzymatique est une méthode qui utilise des enzymes pour catalyser la décomposition des composants de la paroi cellulaire des cellules végétales, entraînant la rupture de la paroi cellulaire et la lixiviation de substances intracellulaires, atteignant ainsi le but de l’extraction. Les enzymes couramment utilisées pour l’extraction du fructose comprennent la pectinase et la cellulase, ainsi que des enzymes complexes.
Zhong Xianfeng et al [50] ont obtenu le brevet d’invention autorisé " une méthode d’extraction de fructose de haute pureté à partir de bars" d’argent; En 2019, qui a utilisé des enzymes composites de papaïne et de plantes combinées à l’extraction de l’alcool, et a obtenu du fructose avec une pureté de 95,00%-99,90% après une série d’élimination des impuretés et de processus de raffinage, ce qui montre que la méthode d’extraction enzymatique présente les avantages d’un faible coût des matériaux, d’un processus et d’une technologie, et de la capacité d’extraire du fructose.
On peut constater que la méthode d’extraction enzymatique présente les avantages d’un faible coût du matériau, d’un processus simple, de conditions de réaction légères et d’un taux d’extraction élevé. Cependant, il a également certaines limites, principalement en raison de plus de facteurs affectant l’activité enzymatique, tels que la température et la valeur du pH, etc. Si l’activité enzymatique doit atteindre le plus haut, les conditions optimales de réaction se situent dans une très petite plage, qui doit être contrôlée avec précision, sinon l’activité enzymatique sera considérablement réduite, ce qui affecte l’effet d’extraction. La comparaison des différentes méthodes d’extraction est présentée au tableau 1.
3 progrès dans le processus de purification du fructose
3.1 séparation par Membrane
After crude extraction, there are many impurities in the extract, mainly proteins, Les pigments, salts, amino acids, etc. Membrane separation requires the selection of filter membranes with good impurity removal and recovery according to the nature of the impurities.
Le principe de la séparation de membrane est d’utiliser la perméabilité sélective des membranes pour séparer et purifier différentes substances. Les membranes de séparation courantes utilisées dans la recherche incluent la membrane d’ultrafiltration, la membrane d’osmose inverse, la membrane de nanofiltration, la membrane d’électrodialyse et ainsi de suite. La membrane d’ultrafiltration, la membrane de nanofiltration et la membrane d’osmose inverse sont toutes des membranes de filtration. La membrane d’ultrafiltration a une taille de pores de 1 nm-300 nm, qui peut être employée pour retenir certaines biomacromolécules et substances colloïdiennes; La membrane de nanofiltration peut retenir des substances avec des poids moléculaires relatifs de 300 à 1 000; La membrane d’osmose inverse est basée sur le principe qu’en appliquant une certaine quantité de pression à l’extrémité haute concentration de la membrane, une différence de pression est formée entre les deux côtés de la membrane, ce qui fait transférer des molécules de solvant de l’extrémité haute concentration à l’extrémité basse concentration de la membrane.
Le principe de la membrane d’osmose inverse est qu’en appliquant une certaine pression à l’extrémité de concentration élevée, une différence de pression est formée des deux côtés de la membrane, faisant transfert de molécules de solvant de la concentration élevée à l’extrémité de concentration basse. Min Zhang et al. [29] ont utilisé de l’eau désionisée comme solvant pour extraire le fructose de Radix et Rhizoma Dioscoreae, et l’ont purifié en combinant des membranes de nanofiltration et d’osmose inverse. Les membranes de nanofiltration et d’osmose inverse utilisées dans l’expérience ont pu être réutilisées après le nettoyage, et leurs taux de récupération de perméabilité de la membrane étaient respectivement de 95,52% et 97,22%.

Une membrane d’électrodialyse est essentiellement une membrane chargée d’échange d’ions [51]. La membrane est située entre la cathode et l’anode du champ électrique de solution. Lorsque le champ électrique fonctionne, les anions et les cations de la solution se déplacent de manière directionnelle et passent à travers la membrane d’électrodialyse sélective d’ions, éliminant ainsi certains ions chargés.
L’efficacité élevée de dessalement des membranes d’électrodialyse a conduit à leur utilisation dans des applications industrielles de dessalement comme le dessalement de l’eau de mer [52] et le traitement des eaux usées [53]. Dans l’industrie alimentaire, il peut être utilisé pour éliminer les sels inorganiques et les protéines, etc. Duan Shuran et al. [54] ont utilisé l’électrodialyse pour purifier l’extrait de sucre de coton. Dans cette étude, ils ont étudié les effets des changements dans la tension de fonctionnement et le débit de circulation sur l’effet de purification et la consommation d’énergie. Dans cette étude, ils ont étudié les effets des modifications de la tension de fonctionnement et du débit de circulation sur l’effet de purification et la consommation d’énergie. Les résultats finaux ont montré que le taux de dessalement pouvait atteindre 91,20 % et la récupération du sucre de coton atteignait 94,50 %.
3.2 purification par chromatographie sur colonne
La chromatographie sur colonne, également connue sous le nom de chromatographie ou chromatographie, est une méthode classique de séparation de mélanges multicomposants dans des expériences scientifiques, et peut être utilisée pour des opérations qualitatives, quantitatives et de purification. Les colonnes chromatographiques consistent habituellement en une phase stationnaire et une phase mobile, et peuvent être classées en plusieurs catégories selon les différents agents de charge dans la colonne, comme la chromatographie carbone-calcium [55], la chromatographie à échangeur d’anions à haute performance (HPAC) [56], et la chromatographie liquide à haute performance en phase stationnaire chirale convoyée de n-phénylphénylamino - β-cyclodextrine (HPLC) [57], etc.
Ils travaillent tous sur le même principe. Leurs principes de fonctionnement sont les mêmes, après que l’échantillon entre dans la colonne, selon les différents coefficients de partage entre la phase mobile et la phase stationnaire, et la capacité d’adsorption différente de la phase stationnaire, les composants se déplacent vers le bas à différentes vitesses, puis s’écoulent et sont recueillis dans un certain ordre, afin d’atteindre le but de la séparation et de la purification.
Lorsque la chromatographie sur colonne est utilisée pour la détermination des oligosaccharides, elle est souvent associée à la spectrométrie de masse, et la chromatographie liquide à haute performance (CLHP) est une méthode plus précise pour la détermination des oligosaccharides [58], qui présente les avantages d’un temps d’analyse plus court, d’une sélectivité élevée et d’une sensibilité élevée. Wang et al. [59] ont mis au point une méthode pour la détermination simultanée des glycosides et des oligosaccharides de l’éther allylique cyclique (saccharose, disaccharide de miel, sucre de graines de coton, mannose et tréhalose) chez Dixiandra chinensis. Dans cette étude, une séparation rapide de sept analytes a été effectuée par chromatographie liquide à interaction hydrophile, et les analytes ont finalement été détectés par spectrométrie de masse en tandem triple quadrupolaire (TQ-MS/MS) avec sensibilité et sélectivité, ce qui a montré que les coefficients de corrélation des analytes étaient supérieurs à 0,99, avec une bonne linéarité, et l’écart de précision était inférieur à 5,00%, et les récupérations étaient dans la gamme de 93,80% ~ 105,50%.
Lorsque la chromatographie sur colonne est utilisée pour la purification du fructose, les remplisseurs en phase stationnaire couramment utilisés sont les résines, le charbon actif, etc. Les résines sont divisées en résines échangeuses d’ions, résines d’adsorption macroporeuses et résines de type gel. Les résines sont divisées en résines échangeuses d’ions, résines d’adsorption macroporeuses et résines de type gel, dont le principe est d’utiliser l’effet d’adsorption de la résine pour retenir des composants spécifiques, puis les éluer pour atteindre le but de séparer les composants de l’échantillon, qui présente les avantages d’un taux élevé de dessalement, un bon effet de décoloration, d’automatisation et de recyclage répété, et ainsi de suite. Les résines échangeuses d’ions et les résines d’adsorption macroporeuses sont couramment utilisées pour éliminer les sels, les pigments, les protéines, les acides aminés et d’autres impuretés de l’extrait de fructose.
Dans l’étude de Xie Jin [49], lors de l’extraction du fructose du ver à soie heracé séché, le taux d’élution des protéines était de 93,70 %, le taux d’élution des cendres était de 97,81 %, et le taux de décoloration était aussi élevé que 99,50 % en utilisant le type D001 de résine macroporeuse fortement acide d’échange de cations et le type D301 de résine macroporeuse faiblement alcaline d’échange d’anions avec un débit de 3,77 BV/h et une température à 35 °C. (1) le taux d’élution des protéines et des cendres était de 97,81 % et le taux de décoloration de 99,50 %; Et (2) le taux d’élution des protéines et des cendres était de 99,50 %. Cong Liu et al. [60] ont utilisé le gel HW-40C comme phase stationnaire pour éliminer les protéines et purifier le sucre de graines de coton. Dans des conditions optimales, la pureté du sucre de graines de coton était de 89,10 % et le rendement de 64,80 %. La résine de gel présente les avantages d’une efficacité élevée de séparation et d’une opération facile, mais il convient de noter que l’espace interstitiel de la résine de gel est petit, donc si l’extrait contient plus de pigments, ils doivent être retirés d’abord, sinon la résine de gel sera facilement bouché par les molécules de pigment, ce qui entraîne le phénomène de " empoisonnement " De la résine.
Le charbon actif est un milieu poreux avec une grande capacité d’adsorption des matières organiques hydrophobes et est souvent utilisé pour la décoloration. Le principe est d’utiliser la force électrostatique pour adsorber physiquement de petites molécules organiques ou des molécules hydrophobes dans les micropores du charbon actif pour éliminer les impuretés de la phase mobile. Bao et al. [61] ont utilisé du charbon actif pour adsorber et séparer le sucre de graines de coton et le sacchararose, et par le cycle d’adsorption-désorption, la pureté du sucre de graines de coton était supérieure à 90,00%, avec un taux de récupération de 79,20%. Bernal et al. [62] ont utilisé du charbon actif en poudre Norit (NPAC) à une concentration de 5 g/L, avec une pression transmembrane de 100 kPa et une pression d’ultrafiltration de 100 kPa. Bernal et al.[62] ont décoloré la mélasse de betterave à une concentration de 5 g/L de charbon actif en poudre norit (NPAC), une pression transmembranaire de 100 kPa, un débit d’alimentation de 4,24 L/h et un pH de 3. La couleur de la mélasse de betterave a été réduite de plus de 96,50 % et le charbon actif a été reconstitué avec du NaOH, et la perte de sa capacité d’élimination de la couleur a été inférieure à 10,00 %.
3.3 cristallisation
Le principe de cristallisation est que, selon les différentes conditions de cristallisation de différentes substances, les substances extraites sont précipitées hors de la solution saturée et cristallisées, tandis que d’autres impuretés restent dans la solution, afin d’atteindre le but de la purification. Dans le domaine de la préparation du fructose, Zhang Jinze et al[63] ont purifié le fructose en utilisant la recristallisation et l’adsorption au charbon actif. La recristallisation se réfère à la cristallisation secondaire des cristaux, c’est-à-dire le processus de cristallisation des cristaux de solution ou de fusion après dissolution ou fusion, et la recristallisation peut purifier la substance à un degré élevé, et la pureté des cristaux de fructose obtenus par cette méthode est supérieure à 99,00%, ce qui a été autorisé par un brevet du brevet d’invention chinois en 2016.
Cette méthode a été autorisée par le brevet d’invention chinois en 2016. Song Jianmin et al[64] ont inventé " une méthode pour la préparation de fructose de haute pureté ", dans laquelle des cristaux de fructose d’une pureté supérieure à 99,00% ont été obtenus à partir de la matière première de Fagus sylvatica par de multiples méthodes d’extraction telles que l’extraction aqueuse, la fermentation microbienne, l’extraction d’alcool, etc., et combinés avec la précipitations alcaline, la filtration, la décoloration au charbon actif, et les méthodes de purification de refroidissement et de cristallisation. La purification du fructose par la méthode de cristallisation est caractérisée par une grande pureté, un solvant respectueux de l’environnement et un processus simple, et peut être utilisé pour la préparation de produits standard commerciaux de fructose, mais la période de refroidissement naturel et de cristallisation est longue et l’efficacité est faible. La comparaison des trois méthodes d’épuration est présentée au tableau 2.

4 résumé et perspectives
Compared with other oligosaccharides, fructose can more effectively promote the growth and reproduction of intestinal probiotics, and has a broad application prospect. The production and preparation of fructose is a popular research direction at present, and this paper summarizes the current status of the technology of fructose preparation in terms of the extraction process and purification process. In terms of economic benefits, microbial fermentation is currently the most economical method for the purification of fructose, and it is more suitable for industrial production, in which the mixed-bacteria fermentation is better than the single-bacteria fermentation, and the simultaneous multibacteria fermentation is better than the lagging fermentation, the pH value of the fermentation environment depends on the fermentation bacteria, and the pH value of 5.5-7.0 is usually suitable, the shaking fermentation is better than the static fermentation, and the slag fermentation is better than the filtration fermentation. In addition, the purification rate can be adjusted by adding some enzyme inhibitors to realize low-cost and high-efficiency mass production of fructose.
Cependant, la méthode de fermentation microbienne présente l’inconvénient de nombreuses impuretés dans le produit, qui doivent être éliminées en plusieurs étapes dans le processus de raffinage ultérieur. Bien que la pureté de certains procédés de purification du fructose ait atteint les normes internationales et puisse être utilisée pour produire des normes d’essai de haute pureté, il existe certaines limites.
Par exemple, la méthode de séparation par membrane et la méthode de purification par chromatographie sur colonne ont des problèmes de coût élevé des consommables et de faible capacité de traitement; Le coût de temps de la méthode de cristallisation est directement proportionnel à la capacité de production et inversement proportionnel à la zone d’évaporation, qui ne sont pas appropriés pour la purification à grande échelle du fructose. Par conséquent, la mise en place d’une méthode efficace et peu coûteuse pour la purification du fructose, qui peut être appliquée à la production de masse industrialisée, est une direction qui doit être étudiée plus en profondeur dans le domaine du traitement et de l’application du fructose à l’avenir.
Références:
[1] TOSCANO M, DE GRANDI R, PASTORELLI L, et al. Un consommateur ' S guide pour les probiotiques: 10 règles d’or pour un usage correct [J]. Digestive and Liver Disease, 2017, 49(11): 1177-1184.
[2] branche microécologie de l’association chinoise de médecine préventive. Consensus sur l’application clinique des régulateurs microécologiques du tube digestif en Chine (édition 2016)[J]. Chinese Journal of Microeco-logy, 2016, 28(6): 621-631.
[3] Probiotics Society of the Chinese Institute of Food Science and Technology. Consensus scientifique sur les probiotiques (2020)[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20 (5): 303-307.
[4] SCOTT K P, GRIMALDI R, CUNNINGHAM M, et al. Développements dans la compréhension et l’application des prébiotiques dans la recherche et la pratique - un document de conférence ISAPP [J]. Journal de microbiologie appliquée, 2020, 128(4): 934-949.
[5] HUNGIN A P S, MITCHELL C R, WHORWELL P, et al. Revue systématique: les probiotiques dans la gestion des symptômes gastro-intestinaux inférieurs — une mise à jour des preuves revue systématique: les probiotiques dans la gestion des symptômes gastro-intestinaux inférieurs — une mise à jour du consensus international fondé sur des preuves [J]. Pharmacologie alimentaire & Therapeutics, 2018, 47(8): 1054-1070.
[6] BAJURY D M, NASHRI S M, KING JIE HUNG P, et al. Evaluation of potential prebiotics: a review[J]. Food Reviews International, 2018, 34(7): 639-664.
[7] GIBSON G R, ROBERFROID M B. modulation alimentaire du microbiote du côlon humain: introduction du concept des prébiotiques [J]. The Journal of Nutrition, 1995, 125(6): 1401-1412.
[8] LI C N, WANG X, LEI L, et al. La berbérine combinée au stachyose induit un meilleur glycomabolisme que la berbérine seule en modulant le microbiote intestinal et la métabolomique fécale chez les souris diabétiques [J]. Phytotherapy Research, 2020, 34(5): 1166-1174.
[9] ZARTL B, SILBERBAUER K, LOEPPERT R, et al. Fermentation des oligosaccharides et des galactomanes non digestibles de la famille des raffinose par des probiotiques [J]. Nourriture &; Function, 2018, 9(3): 1638-1646.
[10] LIU Y Y, LI T, ALIM A, et al. Effets régulateurs du stachyose sur l’inflammation du côlon et du foie, la dysbiose intestinale du microbiote et l’anomalie de la distribution des lymphocytes T CD4(+) du foie chez les souris riches en graisses nourris par l’alimentation [J]. Journal de chimie agricole et alimentaire, 2019, 67(42).
N ° 11665-11674.
[11] ZHONG X F, ZHANG Y B, HUANG G D, et al. Analyse protéomique de la contribution du stachyose à la croissance de Lactobacillus acidophilus CICC22162[J]. Nourriture &; Fonction, 2018, 9(5): 2979-2988.
[12] BHATIA L, SHARMA A, BACHHETI R K, et al. Oligosaccharides fonctionnels de Lignocellulose: production, propriétés et avantages pour la santé [J]. Biochimie préparatoire & Biotechnology, 2019, 49(8): 744-758.
[13] LIANG Lixin. Stachyose oligosaccharide-fonctionnel [J]. China Food Additives, 2004(4): 51-54.
[14] FRENCH D. la famille raffinose des oligosaccharides[J]. Advances in glucides Chemistry, 1954, 9: 149-184.
[15] VAN DEN ENDE W. fructans multifonctionnels et oligosaccharides de la famille raffinose [J]. Frontiers in Plant Science, 2013, 4: 247.
[16] HAN Shiwen, GAO Jiatao, SANG Ruojie, et autres. La fonction et le mécanisme du stachyose sur le tractus intestinal [J]. Food Science and technology, 2019, 44(4): 281-284.
[17] MA Xuan. Etude du procédé d’extraction et d’épuration du stachyose à Stachys sieboldii Miq[D]. Shenyang: université de technologie de Che- mical de Shenyang, 2019.
[18] LI T, LU X S, YANG X B. Evaluation de la sécurité clinique et des effets bénéfiques des α -galacto -oligosaccharides enrichies par stachyose sur le microbiote intestinal et la fonction intestinale chez l’homme [J]. Nourriture &; Function, 2017, 8(1): 262-269.
[19] CHEN X F, LIAO D Q, QIN Z X et al. Interactions synergiques du catalpol et du stachyose chez des souris diabétiques induites par le STZ-HFD: synergie dans la régulation de la glycémie, des lipides et des fonctions hépatiques et rénales [J]. Chinese Herbal Medicines, 2019, 11(1): 70-77.
[20] HE L W, ZHANG F, JIAN Z Y, et al. Le Stachyose module le microbiote intestinal et soulage la colite aiguë induite par le sulfate de dextran chez la souris [J]. Journal saoudien de Gastroenterology: Journal officiel de l’association saoudienne de gastroenterologie,2020,26(3):153-159.
[21] KENNEDY P J, MURPHY A B, CRYAN J F, et al. Microbiome in brain function and mental health[J]. Tendances en sciences de l’alimentation & Te- chnology, 2016, 57: 289-301.
[22] GIACOBBO A, BERNARDES A M, DE PINHO M N. opérations séquentielles sur membrane à pression pour récupérer et fractionner les polyphénols et les polysaccharides à partir DE lies DE vin DE deuxième soudage [J]. Séparation et Purification Technology, 2017, 173: 49-54.
[23] LI Bingxue, NIU Fei, ZHANG Ning. Synthèse enzymatique d’oligosaccharides fonctionnels [J]. Journal of Microbiology, 2017, 37(1): 1-6.
[24] NAKATA H, SAKURAI H, NAGURA T, et al. Production de Raffinose à l’aide de la α-galactosidase de Paraphaeosphaeria sp[J]. Mycoscience, 2013, 54(4): 247-251.
[25] WANG Donghui, LIAO Na, SUN Peng et al. Changements de la teneur en sucre de transport dans différents organes de Rehmannia glutinosa[J]. China Journal of Chinese Materia Medica, 2018, 43(8): 1563-1570.
[26] ZHENG Yunfeng, CHENG Jianming, DING Ning, et al. Procédé de préparation du stachyose par extraction à l’eau, précipitation d’alcool de Salvia miltiorrhiza: CN102229627A[P]. 2011-11-02.
[27] CHEN Yan, ZHONG Xianfeng, HUANG Guidong, et al. Conditions d’extraction du stachyose à partir de Stachys floridana shuttlw. Ex Benth.[J]. Natural Product Research and Development, 2011, 23(1): 123-130.
[28] GERLIANI N, HAMMAMI R, AIDER M. Extraction des protéines et des hydrates de carbone de la farine de soja à l’aide de solutions acides et alcalines produites par électro-activation [J]. Sciences de l’alimentation & Nutrition,2020,8
(2):1125-1138.
[29] ZHANG Min, SHI Baoli. Application de la technique de séparation membranaire à l’extraction du stachyose[J]. The Food Industry, 2019, 40(10): 102-106.
[30] YIN J F, YANG G L, WANG S M, et al. Purification et détermination de l’artichaut chinois stachyosein (Stachyssieboldii Miq.) par chromatographie liquide à haute performance avec détection par dispersion de la lumière par évaporation [J]. Talanta, 2006, 70(1): 208-212.
[31] YAO Hong. Stduy sur la technologie de préparation du stachyose de Stachys sieboldii Miq[D]. Wuxi: université de Jiangnan, 2010.
[32] ZHONG X F, HUANG G D, CHEN Y et al. Optimisation de l’extraction de stachyose à partir de Stachys floridana shuttlw. Ex Benth. Par la méthode de surface de réponse [J]. Journal of Food Science and Technology, 2013, 50(5): 942-949.
[33] CHEMAT F, ROMBAUT N, SICAIRE A G, et al. Extraction assistée par ultrasons de produits alimentaires et naturels. Mécanismes, techniques, combinaisons, protocoles et applications. Protocoles et applications. A review[J]. Ultra- sonics Sonochemistry, 2017, 34: 540-560.
[34] XI J, SHEN D J, LI Y et al. Extraction ultrahaute pression comme outil pour améliorer les activités antioxydantes des extraits de thé vert [J]. Food research International, 2011, 44(9): 2783-2787.
[35] MITTAL R, TAVANANDI H A, MANTRI VA, et al. Méthodes assistées par ultrasons pour une extraction améliorée des phycobiliprotéines de macro-algues marines. Gelidiumpusillum (Rhodophyta)[J]. Ultrason- ics Sonochemistry, 2017, 38: 92-103.
[36] BHANGU SK, GUPTAS, ASHOKKUMARM. Amélioration ultrasonique de la transestérification catalysée par la lipase pour la synthèse du biodiesel [J]. Ul - trasonics Sonochemistry, 2017, 34: 305-309.
[37] WANG Qiwei, REN Jianlin. Extraction ultrasonique de stachyose à partir de Stachys sieboldii Miq[J]. Application de l’industrie pétrochimique, 2014, 33(6): 97-99.
[38] HU Binjie, CHEN Jinfeng, WANG Gongnan. Etude Comparative sur l’extraction des polysaccharides de Ganoderma lucidum par la méthode ultrasonique et étude Comparative traditionnelle sur l’extraction des polysaccharides de Ganoderma lucidum par la méthode ultrasonique et la méthode traditionnelle à l’eau chaude [J]. Science and Technology of Food Industry, 2007, 28(2): 190-192.
[39] CHEN CHUANYUN, LIANG YUANZHENG, LI SHENGMING. Procédé d’extraction par Membrane de stachyose dans Stachys sieboldii: CN106543238A[P]. Le 29 mars 2017.
[40] WU S J, CHEN Y W, WANG C Y, et al. Propriétés anti-inflammatoires des extraits de Grifolafrondosa à haute pression dans les macrophages crus 264.7 activés par lipopo- lysaccharide [J]. Sciences de l’alimentation & Technology,2017,52(3):671-678.
[41] HONG Feng, SHAN Gu, SUN Weidong, et autres. Etude primaire sur la production de xylo-oligosaccharides avec explosion de vapeur [J]. Journal of Chemical Industry of Forest Products, 1999, 33(6): 3-6.
[42] ZHANG Bailiang. Technologie et ingénierie de la bioénergie [M]. Beijing: Science Press, 2009: 84-103.
[43] LIN T J, LEE Y C. production de fructooligosaccharides à haute teneur en utilisant deux microorganismes immobilisés dans un bioréacteur de transport aérien à boucle interne [J].. Journal of the Chinese Institute of Chemical Engineers, 2008, 39(3): 211-217.
[44] WANG Zhirong. Etude sur la production de stachyose de grande pureté à partir de Stachys sieboldii Miq[D]. Guangzhou: université de technologie du sud de la Chine, 2017.
[45] SHU Danyang, XIE Jin, CUI Chun. Etude sur la préparation de stachyose de haute pureté par fermentation microbienne [J]. Condiment de Chine, 2019, 44(5): 1-4.
[46] SHI C Y, ZHANG Y, LU Z Q, et al. Fermentation à l’état solide de farine de maïs et de soja mélangé avec Bacillus subtilis et Enterococ- cus faecium pour dégrader les facteurs antinutritionnels et améliorer la valeur nutritionnelle [J]. Journal des sciences animales et de la biotechnologie, 2017, 8: 50.
[47] WANG Xue, ZHANG Jinze, DUAN Sufang et al. Etude sur l’épuration du stachyose par fermentation[J]. Food and Fermentation Indus - tries, 2010, 36(10): 94-97.
[48] ZHOU Wensi, XIONG Jian, XIE Jin et al. Etude sur l’extraction et la purification du stachyose de Stachys seiboibi par fermentation [J]. Condiment de Chine, 2018, 43(7): 21-25, 32.
[49] XIE Jin. Etude sur l’amélioration de la pureté du stachyose au moyen de la méthode de fermentation par microorgane [D]. Guangzhou: université de technologie du sud de la Chine, 2018.
[50] ZHONG XIANFENG, HUANG GUIDONG, BAI YONGLIANG et al. Méthode d’extraction du stachyose de grande pureté de Stachys flori- dana shuttlw. Ex Benth. CN106496287A[P]. Le 15 mars 2017.
[51] ATUNGULU G, KOIDE S, SASAKI S et coll. Électrodialyse par membrane d’échange d’ions du bouillon de pétoncle: Ion, profils d’acides aminés libres et de métaux lourds [J]. Journal of Food Engineering, 2007, 78(4): 1285-1290.
[52] GALAMA A H, SAAKES M, brüning H, et al. Prédessalement de l’eau de mer avec électrodialyse [J]. Desalination, 2014, 342: 61-69.
[53] LV Y, YAN H Y, YANG B J, et al. Électrodialyse à membrane bipolaire pour le recyclage des eaux usées de chlorure d’ammonium: sélection de la membrane et optimisation du procédé [J]. Recherche et conception en génie chimique, 2018, 138: 105-115.
[54] DUAN Shuran, BAO Zongbi, WEN Guangdong et autres. Dessalement électrodialytique dans la purification raffinose [J]. Food Science, 2016, 37(1): 28-32.
[55] YAMAMORI A, TAKATA Y, FUKUSHI E, et al. Analyse structurelle d’un nouvel oligosaccharide isolé d’une boisson fermentée d’extraits de plantes [J]. Journal of Applied Glycoscience, 2017, 64(4): 123-127.
[56] MENGY, YIL, CHEN L et al. Purification, caractérisation de la structure et activité antioxydante des polysaccharides de Saposhnikovia di - varicata [J]. Chinese Journal of Natural Medicines, 2019, 17(10): 792- 800.
[57] LI L, CHENG B P, ZHOU R D et al. Préparation et évaluation d’une nouvelle phase stationnaire chirale liée au N -benzyl -phénéthylamino -β -cyclodextrine pour HPLC[J]. Talanta, 2017, 174: 179-191.
[58] ZHOU Yang, LIU Li, GUO Lengqiu et autres. Détermination de la teneur en stachyose dans des pièces Radix-rehmanniae par HPLC-ELSD[J]. Asia — Pacific Traditional Medicine, 2019, 15(5): 53-56.
[59] WANG X, WU C T, XU M, et al. Optimisation pour la détection simultanée des glycosides iridoïdes et des oligosaccharides dans Radix Rehmannia par extraction assisté par micro-ondes et HILIC-UHPLC - TQ-MS/MS[J]. Phytochemical Analysis, 2020, 31(3): 340-348.
[60] LIU Cong, BAO Zongbi, XING Huabin et autres. Séparation et purification du raffinose et des protéines par chromatographie par perméation de gel [J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28 (3): 503-509.
[61] BAO Z B, DUAN S R, ZHANG Z G, et al. Adsorption séparation du raffinose du saccharose par charbon actif: équilibre, cinétique et percée dynamique [J]. Séparation Science and Technology, 2016, 51(10): 1636-1644.
[62] BERNAL M, RUIZ M O, GEANTA R M, et al. Coloration de la mélasse de betterave par ultrafiltration au charbon actif [J]. Chemical Engineering Journal, 2016, 283: 313-322.
[63] ZHANG Jinze, LIN Jing, ZHOU Zhijiao et autres. Procédé de préparation du cristal de stachyose: CN103265583A[P]. 28 août 2013.
[64] SONG Jianmin, WANG Dehai, WAN Rongsheng et al. Méthode de préparation du stachyose de haute pureté: CN110759956A[P]. 2020-02-07.
-
Précédent précédent
Green Spring Technology Provides One-Stop Solutions for Vanillin Powder
-
Suivant:
Le Stachyose peut-il être utilisé dans l’alimentation animale?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



