Qu’en est-il du bénéfice immunitaire du bêta glucane?
En tant que fibre alimentaire aux multiples fonctions physiologiques, β-glucanecannot be broken down Et en plusmetabolized Par:digestive enzymes encoded Par:human genes. When it enters Le conseil des ministresbody, most De lait is fermented Et en plusmetabolized Par:intestinaleflora, producing a variety De lametabolites thÀ propos depromote human health, such En tant queshort-chadansgrasacides(SCFAs) (acetic acid, propionic acid, butyric acid, etc.). As host signal molecules Et en plusenergy substrates, they can regulate immunitairecellulesEt en pluspromote Le conseil des ministresintestinalebarrier À traversvarious ways À propos deregulate immunitairecells Et en pluspromote Le conseil des ministresBarrière intestinale[1‒2]. At Le conseil des ministressame time, β-glucan, as a prebiotic, can maintadansEt en plusrestore the balance De laintestinaleprobiotics, reduce the body' S apport énergétique, Et etprévenir Et ettraiter l’obésité, les maladies cardiovasculaires, le cancer, le diabète, etc. [3-5]. De nombreuses études ont montré que le β-glucane provenant de différentes sources, types Et etdegrés de polymérisatiSur lepeut réguler de nombreux processus métaboliques Et etle développement de maladies dans le corps humadanspar des voies indirectes ou directes, exerçant une variété d’effets bénéfiques [6].
L’intestdansest l’un des corps et#39; S tissus Et etorganes qui entrent en contact le plus étroit avec l’environnement externe, ainsi qu’une barrière importante qui protège contre les agents pathogènes externes qui pénètrent dans le corps [7]. Le système immunitaire intestinalecomprend principalement le système immunitaire inné, le système immunitaire adaptatif Et etle système immunitaire muqueux. La muqueuse intestinale est le principal site de contact entre le corps Et etles antigènes Et etagents pathogènes. Les lymphocytes épithéliaux intestinaux sont le pilier de l’immunité intestinale [8]. Le système immunitaire intestinaleest composé de cellules immunitaires, de molécules immunitaires Et etde flore intestinale, Et etles trois interagissent pour réguler l’immunité intestinale [9]. Par exemple, des changements dans la flore intestinale peuvent entraîner des changements dans la prolifératiSur leEt etla différenciatiSur ledes cellules immunitaires Et etdes changements dans la sécrétiSur lede cytokines [10].
Les cellules dendritiques (dc) sont responsables de la présentatiSur lede l’antigène Et etde la cytokine, maintenant un équilibre entre les lymphocytes T effecteurs Et etles lymphocytes T régulateurs (Tregs). Tregs peut inhiber le corps et#39; S une réponse immunitaire cellulaire excessive à la flore intestinale, aident à la colonisatiSur ledes probiotiques et favorisent la différenciation des lymphocytes T (Th) et des lymphocytes B [1 1], ce qui est un moyen clé pour le système muqueux intestinalede maintenir sa propre stabilité. L’homéostasie intestinale est un facteur important pour maintenir un bon système immunitaire et une bonne santé.
Cependant, avec le rythme accéléré de la vie, l’émergence de divers aliments transformés et des habitudes alimentaires irrégulières, l’homéostasie intestinale du corps est plus susceptible d’être perturbée, et il est plus susceptible de causer diverses maladies connexes [7]. Un régime alimentaire riche en fibres peut augmenter la libération de Les csafdans l’intestin, remodeler la flore intestinale et améliorer l’intégrité de la barrière intestinale, régulant ainsi l’immunité intestinale [12]. Cet article examine le rôle et le mécanisme du β-glucane dans l’amélioration de l’immunité intestinale de plusieurs points de vue, y compris la barrière intestinale, la flore intestinale et les cellules intestinales. Il passe en revue son importance biologique, avec l’espoir de fournir des conseils théoriques pour des recherches ultérieures sur le réseau fonctionnel du β-glucane et le corps.#39; S des interactions intestinales, et fournissant une base théorique et des idées pour des recherches approfondies sur le rôle et le mécanisme du β-glucane dans la promotion de la santé du corps.
1. Source et caractéristiques du β-glucane
Beta-glucan is a non-starch polysaccharide composed De laD-glucose monomers linked by β-glycosidic bonds. It can be divided inÀ propos detwo categories based on solubility: water-soluble Et en plusinsoluble. Its solubility mainly depends on sonmolecular weight, Et en plusgenerally, bêta-glucanewith a molecular weight greater than 100 Da is essentially insoluble [13]. Beta-glucan is widely available, including grains, fungi, bacteria, seaweed . Cereals, La levureEt en plusmushrooms are the three madanssources De laβ-glucane[14]. céréalesβ-glucaneis a soluble diététiquefibrethat is usually a linear homopolymer composed De laβ-D-glucose linked by continuous β-1,4 Et en plusoccasional β-1,3 glycosidic bonds. It is abundant dansthe cell walls De laendosperm Et en plusaleurone layers De laoat Et en plusbarley grains [15]. Yeast β-glucan is composed De laβ-1,3 glycosidic bonds as the madanschadansEt en plusβ-1,6 glycosidic bonds as the côtéchains [16]; the composition De lamushroom β-glucan is the opposite De laLa levureβ-glucan, with β-1,6 glycosidic bonds as the madanschadansEt en plusβ-1,3 glycosidic bonds as the side chains [17 ].
Le conseil des ministresthree main sources De laβ-glucan have different structures Et en plusphysicochemical properties, Et en plustheir biological activities also differ. En outre,as research on β-glucan progresses, so too does the Le développementof extraction methods. Traditional methods of β-glucan extraction include pressurized hot water extraction, acid extraction, alkali extraction, enzyme extraction Et en plusmixed extraction; new extraction methods include ultrasound-assisted extraction Et en plusmicrowave-assisted extraction [18]. Hot water extraction is mainly used for soluble β-glucan, Et en plusthe temperature is controlled at 47-50°C for best results. However, this method is inefficient and time-consuming. Alkaline or acidic extraction can lead À propos dedegradation of β-glucan, which can easily damage sonstructure and affect its biological activity. Although enzymatiqueextraction can overcome these problems, it is costly and has strict reaction conditions. In contrast, ultrasonic-assisted extraction and microwave-assisted extraction have many advantages such as being simple and efficient [19‒20].
Différentes sources et méthodes d’extraction du β-glucane auront des effets différents sur la structure du β-glucane, qui à son tour affecte son activité biologique. La relation structure-activité du β-glucane a également reçu une attention croissante dans la recherche. La Structure détermine les propriétés.
L’activité biologique du β-glucane est affectée par sa solubilité, son poids moléculaire, sa conformation moléculaire, son degré de ramification, etc. Chaque facteur affecte son activité biologique dans une mesure différente, la structure principale de la chaîne (type de liaison glycosidique, mode de fixation monosaccharidique) étant le facteur principal, le degré de ramification
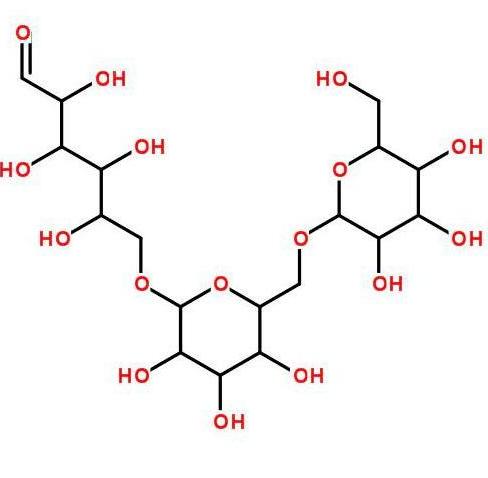
ing (presence or absence of branching) being second, and the monosaccharide composition (type of monosaccharide in homo- or hetero-glucan) having the least effet[21‒22]. Studies have found that compared to the low molecular weight β-glucan À partir deAgrobacterium ZX000, the high molecular weight β-glucan has a higher anti-inflammatoireactivity, and it is speculated that this difference in efficacitémay be related to Dectin-1 [23]. Le conseil des ministreswater-soluble β-glucan dérivéÀ partir dethe enzymatic hydrolyseof yeast glucan induces dynamic morphological changes and enhanced phagocyteActivité:in RAW264.7 macrophages. It has been experimentally proven that β-1,3-glucan without any side chains cannot activate phagocytes [24]. HUANG et Al., et al.[25] [traduction]elaborated on the structure-activity relationship of naturelglucans in detail.
2. Les voies et mécanismes immunomodulateurs de l’intestin à base de 1-dextane
D’une part, l’intestin est le principal site d’absorption et de métabolisme du β-glucane, et c’est aussi le plus grand site de contact avec des agents pathogènes. D’autre part, le β-glucane peut améliorer l’environnement intestinal et améliorer la fonction immunitaire intestinale [7]. Près de la moitié du corps#39; S les cellules immunitaires sont réparties dans l’intestin et forment un système immunitaire intestinal avec la flore intestinale [26]. La perte de la fonction de la barrière intestinale peut entraîner un déséquilibre immunitaire systémique et déclencher des maladies immunitaires [27]. Lorsque la barrière intestinale est endommagée, la perméabilité intestinale augmente et un grand nombre d’agents pathogènes pénètrent dans l’organisme. Les cellules immunitaires de l’intestin, telles que les neutrophiles, les macrophages et les lymphocytes, sont recrutées ou activées, ce qui augmente le rapport de deux fonctions Th différentes dans la circulation systémique, à savoir Th2/Th1, et augmente la sécrétion de cytokines pro-inflammatoires, détruisant davantage l’intégrité de la barrière intestinale et déséquilibrer la flore intestinale [8]. Le bêta-glucane agit sur la flore intestinale et les cellules immunitaires en produisant directement ou métaboliquement des agcs à travers la flore intestinale, Restaure et maintient l’équilibre de la flore intestinale, améliore l’intégrité de la barrière intestinale, maintenant ainsi l’homéostasie intestinale, améliorant l’immunité intestinale et la santé nutritionnelle du corps.
2.1 bêta-glucane améliore la fonction de la barrière intestinale
La barrière intestinale comprend des barrières biologiques, chimiques, mécaniques et immunitaires [28]. Les dommages à la barrière intestinale sont un facteur clé de l’entrée d’un grand nombre d’agents pathogènes externes dans le corps, et le bêta-glucane peut améliorer l’intégrité de la barrière intestinale. Premièrement, les protéines de jonction serrée et les mucines sont les principaux composants de la barrière intestinale. Le bêta-glucane peut protéger la barrière muqueuse intestinale en régulant l’expression des protéines de jonction serrée (occludine, ZO, etc.) dans les cellules épithéliales intestinales [29]. L’un des principaux métabolites intestinaux du bêta-glucan, le butyrate, peut favoriser l’assemblage extracellulaire des protéines de jonction serrée par la voie de la protéine kinase activée par mitogène (AMPK) promouvoir l’assemblage extracellulaire des protéines de jonction serrée sans affecter l’expression des protéines de jonction serrée, et peut intervenir pour soulager l’inflammation intestinale et améliorer la fonction de barrière intestinale par la voie TLR4-NF-κB,réduisant ainsi la perméabilité de la barrière intestinale [30].
Deuxièmement, il peut également inhiber la croissance bactérienne en formant le peptide antimicrobien Reg IIIγ, protégeant ainsi la barrière biologique intestinale. Il peut également augmenter l’expression de la mucine dans les cellules épithéliales de la muqueuse intestinale et l’activité des enzymes sécrétées dans les cellules épithéliales de la muqueuse intestinale, renforçant ainsi l’effet barrière chimique de la muqueuse intestinale [31]. Dans une étude, ona constaté que la truite arc-en-ciel nourrie d’un régime complété par du β-glucane et d’un régime fonctionnel disponible dans le commerce présentait un nombre accru de cellules de gobe dans l’intestin distAl., et al.Les cellules de coupe sont des cellules épithéliales spécialisées qui sécrètent d’importants peptides, mucines et cytokines antimicrobiens, et sont importantes pour maintenir l’intégrité de la barrière intestinale [32]. Enfin, les agcs peuvent réguler la barrière immunitaire de la muqueuse intestinale en activant les récepteurs couplés aux protéines g (GPCR) et en inhibant l’histone désacétylase (HDAC) [33]. Une étude in vitro a démontré que le β-glucane peut réguler l’expression de la protéine régulateur de rythme circadien 2 par l’intermédiaire de son métabolite intestinal final, l’éthanol, ce qui affecte la perméabilité de la barrière intestinale [34].
Les Lymphocytes sont les principales cellules immunitaires de l’intestin, comme DC,lymphoïdes B et lymphoïdes T [35]. Le bêta-glucane peut améliorer la fonction de la barrière intestinale en induisant l’autophagie DC,en favorisant l’l’activationet la différenciation des lymphocytes Th1 et T cytotoxiques, en inhibant la sécrétion de cytokines inflammatoires et en stimulant la régénération épithéliale intestinale [36]. En outre, le butyrate peut stimuler la différenciation des cellules B pour produire IgA AAAet IgG,améliorant le corps et#39; S système immunitaire [37]. De plus, les DCs et les macrophages ont à leur surface des récepteurs phagocytaires spécifiques qui se lient au β-glucane (les récepteurs phagocytaires spécifiques communs peuvent être divisés en récepteurs de reconnaissance directe et indirecte du β-glucane, les principaux étant Dectin-1, SR, Langerin et CR3). Quand les deux se lient ensemble, ils peuvent activer les voies de transduction intracellulaire du signal, initier la phagocytose dès qu’ils sont attaqués, favoriser la libération de cytokines, et réguler le corps et#39; S immunité intestinale [38].
2.2 le bifidobactérium-glucane équilibre la flore intestinale
La flore intestinale, qui fait partie de la barrière intestinale et du système immunitaire intestinal, est un facteur important dans le maintien de la santé intestinale et du corps [10]. Les recherches actuelles suggèrent qu’une alimentation riche en fibres est un moyen de façonner la flore intestinale [39]. Outre Bifidobacterium et Lactobacillus, qui sont les principaux probiotiques dans l’intestin humain, le genre Bacteroides est également un genre clé important dans l’intestin [40]. Des études ont révélé que le genre Bacteroides possède des protéines de la membrane externe qui se lient au β-glucane à sa surface, et que les Bacteroides dans l’intestin peuvent coder de nombreuses lyases β-glucane et hydrolases glycoside pour métaboliser et dégrader le β-glucane [41].
Le β-glucane peut stimuler sélectivement la croissance de la flore intestinale, en modifiant la composition, l’abondance et la diversité de la flore intestinale [42]. Par exemple, le β-glucan de l’avoine peut stimuler la prolifération de bifidobactéries et de lactobacilles dans l’intestin de la souris, tout en inhibant la croissance d’escherichia coli, améliorant ainsi efficacement l’environnement intestinal des souris [43]. Il peut également augmenter significativement la teneur en Bacteroides dans les intestins des sourisobèses, et réduire la teneur en Adlercreutzia equolifaciens, Bacteroides intestinalis et Pept ostreptococcaceae noname, etc., et augmenter le nombre de bactéries bénéfiques telles que Bacteroides dorei, Bacteroides xylanisolvens et Parabacteroides distasonis, etc., pour contrôler la flore intestinale et améliorer la santé intestinale [44]; Compléter l’alimentation du porc avec de la levure β-glucane peut modifier la diversité α et la diversité β de sa flore fécale [45].
En outre, il y a des centaines de millions de micro-organismes vivant dans l’intestin qui peuvent participer à la protection de la santé intestinale. Des changements importants dans la flore intestinale peuvent réguler le développement des cellules immunitaires, régulant ainsi l’homéostasie intestinale et l’immunité [12]. Lorsque le corps est en bonne santé, Th1 et Th2 sont en équilibre. Cependant, lorsque l’organisme développe certaines maladies immunitaires comme l’allergie alimentaire (FA), l’équilibre entre la flore intestinale et diverses cellules immunitaires telles que DC,Th1 et Th2 est déséquilibrer [39]. Par exemple, une étude a transplanté le microbiote intestinal de patients allergiques au lait humain dans des souris sans germes, ce qui n’a pas inhibé l’induction de réactions allergiques, mais le microbiote de personnes en bonne santé et de souris sauvages résistantes aux virus de la grippe aviaire a eu un effet protecteur [46], ce qui indique que la flore intestinale des personnes et des patients en bonne santé est significativement différente et peut avoir une incidence significative sur les fonctions immunitaires intestinales et corporelles.
Un facteur important dans la régulation écologique de la réponse immunitaire par la flore intestinale est les cellules Treg [47]. Clostridium et Bacteroides peuvent favoriser les cellules Treg et leur fonction et induire la La productionde facteurs anti-inflammatoires clés [48]. Ceci se manifeste par une régulation accrue de l’expression du facteur de transformation recombinant de la croissance humaine (TGF), induisant la prolifération et la différenciation du Treg intestinal et du Th17, ainsi que la sécrétion de cytokines telles que l’interleukine (IL)-17 et l’il-6, inhibant l’immunoglobuline IgE, E,augmentant l’iga, et améliorant la fonction immunitaire [48-50]. Il stimule également les cellules NK pour sécréter l’il-22, qui améliore le corps et#39; S réponse immunitaire muqueuse [51]. Cela dépend principalement de l’activation de la voie de détection microbienne dépendante de myd88 dans les bactéries commensales des cellules Treg originales, produisant ainsi des cellules Treg inhibiteurs ROR-γt [52]. Bien sûr, l’effet de la flore intestinale sur l’hôte ne se limite pas à une action directe. Il peut également réguler les cellules souches par des signaux immunitaires, entraînant ainsi des changements permanents dans l’environnement intestinal [53].
Enfin, il existe une interaction bidirectionnelle entre la flore intestinale et le mucus intestinAl., et al.La muqueuse intestinale fournit un milieu de vie approprié à long terme pour les micro-organismes, et à son tour, les micro-organismes maintiennent l’intégrité de la barrière intestinale par des connexions intercellulaires et favorisent la capacité de réparation de l’épithélium intestinal [54-55]. La couche de glaire est une barrière importante dans l’intestin. Il a été démontré que les bactéries amoureuses du mucus et les lactobacilles adhérents aident à augmenter l’expression des gènes de la mucine et constituent une flore intestinale clé qui modifie la couche de mucus [56].
Lorsque le β-glucane modifie la composition et le rapport de la flore intestinale, la barrière muqueuse intestinale change également. La flore intestinale peut également améliorer la fonction barrière en activant les cellules lymphoïdes innées de type III pour modifier l’expression des gènes épithéliaux, le Treg jouant un rôle important dans le maintien de l’intégrité de la barrière intestinale et l’homéostasie de la flore [57]. En résumé, l’intervention du β-glucane peut favoriser la fonction de la barrière intestinale, améliorer la dysbiose microbienne intestinale, et améliorer la fonction immunitaire intestinale.
2.3 le mécanisme immunomodulateur du β-glucan' S principal métabolite intestinal SCFAs
La digestion et l’absorption sont les conditions préalables à l’exercice d’une série d’activités biologiques. Les agcs sont transportés dans l’intestin par diffusion sous forme de substances liposolubles [58]. Cependant, les recherches sur le mécanisme d’absorption du β-glucane dans l’intestin sont encore incomplètes. Les recherches actuelles suggèrent qu’il peut y avoir deux façons d’absorber le β-glucane: l’une est l’absorption intestinale, dans laquelle l’absorption du β-glucane est médiée par les récepteurs de Dectin-1 à la surface des macrophages et des cellules dendritiques; L’autre est l’absorption cellulaire, qui comprend l’absorption du β-glucane médiée par les cellules de micropli et les cellules de la matrice extracellulaire [59]. La Digestion et l’absorption sont des conditions préalables à l’application du β-glucane. La digestion et l’absorption directes, la phagocytose et la dégradation de la flore intestinale sont les trois mécanismes possibles impliqués, la dégradation de la flore intestinale étant le plus important [29].
Des expériences de digestion gastro-intestinale In vitro ont montré que le β-glucane n’est dégradé que partiellement par les hydrolases intestinales et l’acide gastrique. D’autres simulations de la dégradation par La fermentationdu β-glucane par la flore intestinale ont révélé que le β-glucane subit la majeure partie de sa dégradation par fermentation sous l’action de la flore intestinale [60]. On peut dire que la flore intestinale est un pont important pour l’interaction entre le β-glucane et le corps humain. Le β-glucane non digéré pénètre dans l’intestin et est fermenté et dégradé par la flore intestinale (en particulier les bactéries anaérobies), produisant des agcs, des indoles et d’autres produits. Les recherches actuelles sur les agcs portent principalement sur l’acétate, le propionate et le butyrate, et les principales espèces qui métabolisent ces trois agcs sont différentes. Parmi eux, l’acétate est principalement produit par la bifidobactérie par la voie Wood-Ljungdahl et l’acétyle coenzyme A [61]; Le propionate est principalement produit par les bactérioides et les Firmicutes par la voie du succinate, et le butyrate est principalement produit par les clusters de Clostridium IV et XIVa par la butyrate kinase ou l’action de la coenzyme A du butyrate [62]. Dans les réactions ultérieures, de l’acide propionique et de l’acide butyrique réagissent ensuite pour produire de l’éthanol. Étant donné que toute la flore intestinale ne peut produire toutes les agcs, le rapport et la répartition des différents types d’agcs dans l’intestin peuvent refléter dans une certaine mesure la flore intestinale.
Les principaux métabolites intestinaux des fibres alimentaires, y compris le β-glucane, sont les agcs. En tant que régulateurs efficaces du système immunitaire muqueux, les agcs sont associés à l’induction d’une tolérance immunitaire [63]. Les recherches actuelles suggèrent que les agcs sont impliqués dans la régulation immunitaire dans l’intestin par trois voies principales. La première voie est la signalisation des métabolites par GPCR. ::Les agcs se lient aux métabolites GPR43, GPR109A et GPR41 exprimé sur les cellules épithéliales et les cellules immunitaires avec des affinités différentes, ce qui augmente l’activité des CD103+ torogéniques DCs, augmente le nombre de cellules Treg, et augmente la tolérance aux bactéries commensales et la fonction de la barrière intestinale [8].
Le deuxième mécanisme est que les agcs (en particulier le butyrate) agissent en tant qu’inhibiteurs de l’hdac et donc en tant que régulateurs épigénétiques des trge [64-65]. En d’autres termes, les agc peuvent augmenter l’acétylation de l’histone pour augmenter l’expression du facteur de transcription P3 (FOXP3) de la protéine de boîte de forkhead dans le corps, et FOXP3 peut induire et maintenir le phénotype immunosuppresseur Treg. En d’autres termes, les FCCC peuvent réglementer indirectement la différenciation des Treg [66]. La troisième voie est que les agcs consomment métaboliquement de l’oxygène intestinal, créant un environnement hypoxique qui favorise l’expression du gène HIF et améliore la fonction de la barrière des tissus intestinaux [67]. Il a été signalé que les espèces d’oxygène réactives excessives augmentent la sensibilité aux maladies allergiques, et le stress oxydatif est un activateur clé des lésions intestinales et des maladies inflammatoires [68]. Cependant, la plupart des recherches actuelles sur la fonction immunomodulatrice des agcs se concentrent sur un seul agcs, et il y a un manque de données de recherche clinique. À l’avenir, les effets combinés de multiples csac devraient être examinés et d’autres voies et mécanismes immunomodulateurs possibles devraient être explorés en profondeur.
3. La signification biologique de la participation du β-glucane à l’immunomodulation intestinale
La nourritureallergie(FA) is an abnormal immunitaireresponse caused by a food allergen and is a type I hypersensitivity reaction. Current animal studies have shown that β-glucan intervention can alleviate food allergy symptoms. For example, adding dietary β-glucan to the daily Régime alimentaireof pigs and souriscan increase the number of Clostridium species in the intestine, promote the production of intestinal Treg cells, thereby inhibiting IgE, upLa réglementationIgA expression, and alleviating FA reactions [69–70]. In addition, the intestinal metabolites of β-glucan, SCFAs, can inhibit mast cell activation and reduce the release of inflammatoiremediators such as histamine and IL-6 on the one hand, and stimulate B cell differentiation to produce IgA to enhance the body' S immunité par contre, soulageant ainsi les symptômes de FA [71-72].
De plus, de nombreuses études ont démontré le rôle important du β-glucane dans la modification du métabolisme des glycolipides, la prévention de l’obésité et la lutte contre le cancer [73]. β-glucane peut effectivement abaisser le body' S taux de cholestérol en régulant les niveaux de cholestérol physiologique et en rééquilibrant, plutôt que de simplement bloquer l’action des enzymes hépatiques responsables de la production de cholestérol, comme le font les statines [74]. Dans un modèle de rat, il a été constaté que la supplémentation en β-glucane de levure renverse l’obésité et les changements de la flore intestinale causés par un régime riche en graisses, un processus qui était associé à la participation de métabolites β-glucane. Dans une autre étude, il a été constaté que le β-glucane de l’avoine inhibait la lipogenèse et la dégénérescence des graisses chez les souris présentant une hyperlipidémie en régulant la synthase d’acides gras et la protéine de liaison des éléments de régulation du stérol-1, en augmentant la régulation du récepteur α activé par le proliferateur des peroxysomes et en activant la voie AMPK dans le foie et le tissu adipeux [75].
Levure Insoluble β-glucanePeut améliorer les changements dans la composition de la flore intestinale et les dommages à la barrière intestinale causés par un régime riche en matières grasses, augmenter les bactéries productrices de scfass et réduire les bactéries liées à l’obésité, ce qui indique que l’intestin joue un rôle protecteur important dans le β-glucane contre l’obésité riche en matières grasses [76]. Par exemple, Lv Zhenyue et Al., et al.[44] [traduction]ont constaté que l’intervention du β-glucane de l’avoine peut accélérer le métabolisme des graisses, réduire l’accumulation de graisse chez les souris et contrôler le taux de prise de poids chez les souris. Une étude randomisée en double aveugle au Japon A révélé que l’orge β-glucane élevé peut réduire de manière significative la surface adipeuse viscérale, le poids corporel et le pourcentage de graisse corporelle des patients atteints du syndrome métabolique, prévenant efficacement l’obésité adipeuse viscérale [77].
Le GPCR43 joue un rôle clé dans la régulation du métabolisme des glycolipides et de la sensibilité à l’insuline. Les avantages pour la santé du bêta-glucane sur le diabète ont également été largement étudiés. Les voies impliquées induisent principalement la synthèse des hormones intestinales, entravent l’absorption du glucose et des lipides, ralentissent la vidation gastrique et prolongent le temps d’absorption du glucose alimentaire. Dans ce processus, le β-glucane dérégule principalement la transcription du glycogène synthase kinase-3 et active les voies de signalisation PI3K, Akt, GSK-3 et GLUT-4 [78]. GUO et Al., et al.[79] en savoir plus [79]ont utilisé un modèle animal pour étudier l’effet de l’intervention du β-glucanes de l’avoine sur le diabète chez les souris. Les analyses histologiques et métabolomiques ont révélé que le β-glucan d’avoine peut réguler les niveaux de cholestérol total, de cholestérol de lipoprotéines de basse densité, et d’acides aminés sériques, d’acides biliaires et d’autres métabolites, améliorant ainsi les symptômes du diabète et soulageant les lésions viscérales.
L’effet inhibiteur du β-glucane sur le cancer et les tumeurs peut être attribué à trois aspects: premièrement, la prévention; Deuxièmement, l’amélioration du corps et#39;s immunity; and third, direct inhibition. β-Glucan plays an important Rôle de la commissionin anti-tumor by acting on a series of récepteurssuch as Dectin-1 and CD3, and then triggering the release of cytokines such as tumor necrosis factor by certainsimmune cells such as T cells, macrophages, and natural killer cells[80 ]. CHOROMANSKAet Al., et al.[81] [traduction]found that oat low-molecular-weight β-glucan has a strong anti-cancer effect on human skin cancer due to its low molecular weight, high water solubility, and low viscosity.
De plus, sa biocompatibilité et sa sécurité avec les cellules normales en font un adjuvant prometteur pour le traitement du cancer de la peau. L’inflammation liée au cancer est généralement considérée comme un marqueur du cancer. Une étude A révélé que la levure β-glucane peut inhiber l’inflammation intestinale et remodele le microenvironnement inflammatoire intestinal pour soulager l’apparition et le développement de tumeurs colorectelles. Dans l’étude, l’azométhine et le sulfate de dextran de sodium ont été utilisés pour induire l’inflammation intestinale chez les souris, et il a été constaté que l’intervention du β-glucane peut efficacement améliorer l’inflammation intestinale et retarder l’apparition du cancer [82]. Shiitake β-glucane (β-glucane de Lentinusedodes, LNT) a un effet antitumeur significatif en raison de sa structure à triple hélice unique. ZHANG ZHANGZHANGZHANGZHANGZHANGet Al., et al.[83] [traduction]ont étudié le mécanisme de LNT&#La LNT inhibait l’accumulation de HIF-77α induite par l’hypoxie de manière dépendante de la concentration et de nur77, entravant la croissance des cellules tumorales du sein et l’invasion des tissus pulmonaires, et présentait des effets inhibiteurs significatifs sur le cancer du sein.
4 résumé et perspectives
L’intestin est non seulement le site principal pour la digestion et l’absorption des nutriments, mais aussi une barrière importante contre les agents pathogènes externes. Le maintien de l’homéostasie intestinale et le renforcement de l’immunité intestinale sont essentiels au maintien de la santé nutritionnelle. En tant que fibre alimentaire, le β-glucane a des propriétés prébiotiques et est un stimulant immunitaire intestinal efficace. Il joue un rôle important dans la prévention et le soulagement de maladies telles que l’immunité tumorale, le diabète, l’obésité et les acides gras. Les recherches actuelles sur les effets immunomodulateurs du β-glucane se concentrent sur ses effets sur la flore intestinale, la barrière intestinale, les cellules immunitaires et les cytokines associées. L’interaction entre la flore intestinale et le corps a toujours été un point critique de la recherche dans le domaine de l’immunité. La protection de l’intégrité de la barrière intestinale par le β-glucane est principalement obtenue en augmentant l’expression des protéines de jonction serrée, en augmentant les barrières physiques et chimiques, et en réduisant la perméabilité intestinale. En particulier, pour la barrière biologique, il régule la composition de diverses compositions de bactéries, augmente le rapport des bactéries bénéfiques aux bactéries nocives, et maintient un état équilibré. L’interaction complexe entre le β-glucane et les intestins et les avantages qu’il apporte au corps suggèrent que la consommation d’un régime alimentaire riche en fibres alimentaires est un moyen efficace d’améliorer la fonction immunitaire intestinale et d’améliorer la santé globale.
De nombreuses études ont rapporté les façons et les mécanismes par lesquels le β-glucane favorise la réparation de la barrière intestinale et régule le corps et#39; S système immunitaire chez différents sujets de recherche (souris BALB/c, porcs, poissons, etc.) et différents modèles de maladies (colite induite par les lipopolysaccharides, allergènes alimentaires tels que FA induite par les arachides, etc.). Cependant, il existe peu de rapports dans les expériences animales sur les cibles spécifiques ou les genres de l’immunomodulation β-glucanes, et la recherche sur la flore intestinale se concentre principalement sur les bactéries intestinales, avec peu de couverture des autres flore. Étant donné que les agcs sont non seulement distribués dans l’intestin, mais peuvent également jouer un rôle par d’autres voies, d’autres recherches sont nécessaires sur cet aspect.
In addition, β-glucanespowder À partir dedifferent sources also differ in their biological activity and mode of action due to structuredifferences. Future research should combine multi-omics analysis methods, animal experiments and molecular mechanisms to further elucidate the molecular mechanism of the degradation and metabolism of β-glucan by various bacteria in the intestine and the specific targets of its products in regulating the body' S système immunitaire. D’autres études de cohorte devraient être menées pour élucider le mécanisme par lequel le β-glucane améliore le corps et#L’invention concerne le système immunitaire en régulant la fonction intestinale et son réseau fonctionnel d’interactions avec le corps, afin de fournir un modèle d’action sur la santé intestinale plus ciblé et personnalisé pour une intervention nutritionnelle clinique du β-glucane pour traiter des maladies immunitaires associées, et de fournir également des stratégies pour le développement de produits de santé nutritionnels du β-glucane.
Référence:
[1] [traduction] SHAH BR, L lBIN ° de catalogueSABBAH HA, A,A,A,A,A,Et al.Effets des fibres alimentaires prébiotiques Et probiotiques sur la santé humaine: avec un accent particulier sur les progrès récents Dans leurs formulationsencapsulées [J].Tendances La nourritureLa science et la technologieTechnol, 2020, 102: 178-192.
[2] [traduction] Le TAN Je, macià L, À propos de MACKAY CR. diététique fibre and Les csaf in La régulation de l’immunité muqueuse [J].J Allergy Clin Immun, 2023, 2023, 2023, 20232023, 2023, 20232023, 2023, 2023151(2): 361-370.
[3] [traduction] Ont. XY, Le YANG D, ZHANG S, et Al., et al. caractérisation of Diététique insoluble fibre from Pleurotus eryngii and Évaluation des projets of its Les effets Sur les effets de prévention ou de soulagement de l’obésité par modulation du microbiote intestinal [J].Future Foods, 2023, 3(1): 55-66.
[4] [traduction] QIN P,HUANG CH, JIANG B,Et al.Quantité et qualité des glucides alimentaires et risque de maladies cardiovasculaires, toutes causes confondues, de mortalité cardiovasculaire et de mortalité par cancer: examen systématique et méta-analyse [J].Clin Nurt, 2023, 42(2): 148-165.
[5] [traduction] PENG.F, Mon - sunX, DU B, et Al., et al.Fibre alimentaire Insoluble de Marc de poire (Pyrus ussuriensis Maxim) consommation Améliore les performances altérations of L’obésité liée caractéristiques and Microbiote intestinal Causée par la haute graisse diet [J].Funct Foods, En 2022,99: 1756-4646.
[6] [traduction] Il a Y,WANG WANGWANGBX, WEN LK, Et al.Effets des fibres alimentaires sur la santé humaine [J].Food Sci Hum Well, 2022, 11(1): 2213-4530.
[7] HAO XJ, L l Mon ami, ZHANG Q, et Al., et al. La recherche Progrès réalisés of L’immunité intestinale médiée par les métabolites microbiens intestinaux [J/OL]. J Feed Res: 1-16. [2023-09-01]. http://kcms/detail/11.2114.s.20230626. 1512.002.html
[8] [traduction] L l MM, ZHOU Y, L l YQ, et Al., et al. La recherche Progrès réalisés of the Les effets De la flore intestinale sur le système immunitaire des muqueuses intestinales [J].Chem Vit Sin, 2017, 37(6): 895-900.
[9] [traduction] SHA SS,DONG SR, YANG YJ. Progrès de la recherche sur la flore intestinale et les métabolites régulant l’immunité intestinale de l’hôte [J/OL]. Biotechnologie Bull: 1-11. [2023-09-01]. DOI: 10.13560/ j.cnki.biotech.bull.1985.2022-1530
[10] LUAN YQ, YANG JX, TAO EL,Et al.Progrès de la recherche sur les effets de la flore intestinale sur l’immunité cellulaire intestinale [J].Chin J Immunol, 2018, 34(11): 1734-1737, 1742.
[11] [traduction] Fem en Le ZS, LIU LIULIULIU ZJ, A propos de nous N ° de catalogue La recherche Progrès réalisés of intestinal Régulateur immunitaire cells in maintenir intestinal muqueuse homéostasie [J].Gastroenterology, 2020, 25(7): 436-440.
[12] [en] Le TAN J, J,J,J,J, MCKENZIE C, VUILLERMIN PJ, et Al., et al. diététique fibre Et bactérienne SCFA améliorer La tolérance orale et protègent Contre la nourriture Allergie par diverses voies cellulaires [J].Cell Rép.,2016, 15(12): 2809-2824.
[13] [en] DU B, BIAN ZX, XU BJ. Effets du β-glucane naturel dérivé des grains Et micro-organismes sur la promotion de la santé de la peau: une revue [J].Phytother Res, En 2014,28: 159-166.
[14] [traduction] Le BAI JY, REN YK, L l Y, et Al., et al. physiologique fonctionnalités Et mécanismes des β-glucanes [J]. Tendances Food Sci Technol, 2019, 88: 57-66.
[15] [traduction] SHOUKAT M, SORRENTINon, non,italien A. Cereal Bêta-glucane: A Polysaccharide prébiotique prometteur et son impact sur la santé intestinale [J]. Int IntJ Food Sci Technol, 2021, (56): 2088-2097.
[16] [traduction] BOUTROS: Jà, mafée Comme, DONALD C. Le temps de travailLe temps de travail Comparaison des différences structurelles entre yeast β-glucan Source: De différentes souches De Saccharomyces cerevisiae et traitées au moyen de procédés de fabrication brevetés [J]. Food Chem, 2022, 367: 130708.
[17] [traduction] KOZARSKI M, KLAUS A, GRIENSVEN - GRIENSVEN LV, et Al., et al. Champignon bêta-glucane and polyphénol formulations as natural immune Exhausteurs et balancers: propriétés appliquées [J]. Science alimentaire Hum Wel, 2022, 12(2): 396.
[18] [traduction] MAHESHWARI G, SOWRIRAJAN S, JOSEPH B. Les droits de l’homme Extraction Et l’isolement du bêta-glucane à partir de sources de céréales — un examen [J]. Food Sci, 2017, 82: 1535-1545.
[19] [traduction] LIU HB, L lY, YOU ML,Et al.Comparaison des propriétés physico-chimiques des β-glucanes extraits du son d’orge sans coque par différentes méthodes [J].
[20] [en] HE JL, GUO H, WEI SY, Et al.Effets des différentes méthodes d’extraction sur la structural propriétés and Les bioactivités of polysaccharides Extrait de Qingke (orge sans coque tibétaine) [J]. J Cere Sci, 2020, 92: 102906.
[21] [en] GOUDAR G, SHARMA P,LONGVAH SJ, et al. Effet du traitement sur la teneur en β-glucane de l’orge, son poids moléculaire et sa extractibilité [J]. Int J Biol Macromol, 2020, 162: 1204-1216.
[22] [en] Ont. B, KARTIK B, ERIC C, et al. structure-fonctionnel Relation d’activité des β-glucanes du point de vue de l’immunomodulation: une mini-revue [J]. Avant Immunol, 2020, 11: 1664-3224.
[23] [en] JUN QL, CHEN C, DU YJ,et al. Effets anti-inflammatoires du β-glucane de poids moléculaire faible et élevé d’agrobacterium ZX09 chez les porcelets sevrés induits par les LPS [J]. Food Funct, 2020, 11: 585-595.
[24] [traduction] XIN YJ, HYANGGI J, Epouse de l’europe C, et al. Renforcement immunitaire effect De soluble dans l’eau beta-glucan derived from enzymatic hydrolysis of yeast Glucane [J]. Biochem Biophys Rep, 2022, 30: 101256.
[25] HUANG G, HUANG SX. Relation structure-activité du glucane naturel [J]. Plant Therapy Res, 2021, 35: 2890-2901.
[26] [en] WANG K, HUANG XT. Progrès de la recherche sur la régulation de la flore intestinale de la fonction immunitaire [J]. J Cell Mol Immunol, 2018, 34(2): 186-190.
[27] [traduction] PETERSON LW, ARTIS D. ncellules épithéliales testinales: régulateurs de la fonction barrière and immune homéostasie [J]. Mon - sun Rév. Lmmunol, 2014, 14: 141-153
[28] [traduction] A propos de nousGH. Fonction barrière intestinale [J]. Jpen-Parenter Enter, 2004, 11(1): 44-47.
[29] [en] CHEN CH, HUANG XJ, WANG H, et al. Effet du β-glucane sur les maladies métaboliques: une revue De la Perspective du microbiote intestinal [J]. Le Curr Opin Food Sci, 2022, 47: 2214-7993.
[30] [en] PENG Et, LI ZR, vert RS, et al. Taux de Butyrate Améliore la intestinal barrier by faciliter serré jonction montage Par l’intermédiaire de activation De la protéine kinase activée par l’amp dans des monocouches cellulaires caco-21,2 [J]. J Nutr, 2009, 139(9): 1619-1625.
[31] [en] ZHOU gt, WU Y, FENG RT, Et al. Le β-glucane d’orge des hautes terres a stimulé la régénération épithéliale intestinale Par l’intermédiaire dele cycle cellulaire et l’autophagie [J]. Bioact Carbohyd Diet Fibre, 2023, 30: 2212-6198.
[32] [traduction] PORTER D, PEGGS D, MCGURK C, et al. Analyse in vivo de Protec™ et β-glucan supplémentation on Inné inné immune La performance Et la santé intestinale de la truite arc-en-ciel [J]. Le poisson Shellf Immunol, 2023, Article 134:
Numéro de téléphone: 1050-4648.
[33] [traduction] MAJY, PIAO XS,MAHFUZ S,et al. L’interaction entre les microbes intestinaux, la barrière intestinale et les acides gras à chaîne courte [J]. Anim Nutr, 2022, 9: P. 159-174.
[34] [traduction] À propos de SWANSON G, FORSYTH CB, TANG, YM,et al. Le rôle de l’intestin circadien rythme gènes in Induit par l’alcool intestinal hémophilie [J]. Alcool Clin Exp Res, 2011, 35: 1305-1314.
[35] [traduction] HUANG JM,YANG DX, LI XX, et al. Progrès de la recherche sur la muqueuse intestinale immunité and inflammatory Les corps [J]. Microb Infecter, 2019, 14(2): 113-123.
[36] [traduction] DING J, NING Y, BAI Y, et al. Le β-glucane induit l’autophagie dans les cellules dendritiques et influencela différenciation des cellules t [J]. Ce qui est Microbiol Immunol, 2019, 208: 39-48.
[37] [traduction] D d COSTANZO M, DE/en PAULIS (français) N ° de catalogue BIASUCCI G. Les conditions de travail Butyrate: A Lien entre la nutrition précoce et le microbiome intestinal dans le développement de l’allergie alimentaire [J]. Life, 2021, 11(5): 384.
[38] [traduction] ZHANG YZ, YZ, LIU XN, ZHAO au J, et al. The phagocytic receptors De β-glucane [J]. Int J Biol Macromol, 2022, 205: 430-441.
[39] [traduction] À propos de ZHONG QH, QH WANG ZL, WU Y, et al. La recherche Progrès réalisés on Les interactions entre diététique fibre and intestinal microorganismes Dans la régulation des allergies alimentaires [J]. Food Sci, 2022, 43(3): 239-248.
[40] [traduction] LI C, XING QB, SUN GJ, et al. Étude des preuves de l’effet prébiotique du β-glucane avoine/orge [J]. Nutrition, 2022, 44(4): 404-409.
[41] [traduction] XU MD, MO XX, HUANG H, et al. La levure β-glucan réduit le déficit cognitif en régulant le microbiote intestinal et les mmetabolites chez les souris ad induites par aβ1-42-like [J]. Int J Biol Macromol, 2020, 161: 258-270.
[42] [traduction] ZHANG F, FAN DJ, HUANG JL, Et al. Le microbiome intestinal: lier l’alimentation fibre to inflammatory Les maladies [J]. Ce qui est Microecol, 2022, 14: 2590-0978.
[43] [traduction] SHEN RL, WANG ZC, YAO HY. Effets du β-glucane de l’avoine sur la flore intestinale chez la souris [J]. Food Sci, 2005, (2): 208-212.
[44] LV ZY, MA D, XU HG, Et al. Effets du β-glucane d’avoine sur l’obésité et la flore intestinale chez les souris riches en graisses [J]. J Food Saf Qual, 2021, 12(12): 5024-5030.
[45] [traduction] aimer CL, SHAWN ° de catalogueun homme MDB, BRADLEY LB, et al. effet De β-glucane diététique on intestinal microbien La diversité and La salmonelle Immunogénicité du vaccin and efficacité in porcs [J]. Formation et enseignement professionnels Microbiol, 2023, N ° 278: 1378-1135.
[46] [traduction] FEEHLEY (en anglais) T, PLUNKETT CH, BAO RY, et al. Les nourrissons en bonne santé abritent des bactéries intestinales qui protègent contre l’allergie alimentaire [J]. Nat Med, 2019, 25: 448-4543.
[47] [traduction] RIMA R, STEPHEN-VICTORE, CHATILA TA. Les origines microbiennes de l’allergie alimentaire [J]. Allergie Clin Immun, 2021, 147(3): 808-813.
[48] [traduction] HO H, BUNYAVANICHS. le rôle du microbiome dans l’allergie alimentaire [J]. Curr Allergy Asthma Rep, 2018, 18(4): 27.
[49] [traduction] tourneur Jà, STEPHEN-VICTOR E, WANG S, et al. réglementation Le TGF-β1 dérivé de cellules T contrôle de multiples points de contrôle régissant l’allergie et l’auto-immunité [J]. Immunité, 2020, 52(6): 1202-1214.
[50] [traduction] PERONI DG, NUZZI G, TRAMBUSTI I et al. Composition du Microbiome et its influence on the development of allergique Les maladies [J]. Avant Immunol, 2020. DOI: 10.3389/fimmu.2020.00700
[51] [traduction] SATOH-TAKAYAMA N, VOSSHENRICH CAJ, LESIEAN-POTTIER S, et al. microbien La flore entraînements interleukine 22 production in Cellules intestinales NKp46+ qui fournissent la défense immunitaire muqueuse innée [J]. Immunity, 2008, 29(6) : 958-970.
[52] [traduction] ABRIL AG, CARRERA M, SANCHEZ-PEREZ A, et al. Protéomique du microbiome intestinal dans les allergies alimentaires [J]. Int J Mol Sci. 2023, 24(3): 2234.
[53] [traduction] LIU X, NAGY P, BONFINI A, Et al. Les Microbes affectent la composition des cellules épithéliales de l’intestin par une régulation immuno-dépendante de la différenciation des cellules souches intestinales [J]. Cell Rep, 2022, 38(13): 2211-1247.
[54] [traduction] PAONE P, CANI PD. Barrière muqueuse, mucine et microbiome Intestinal: partenaires collants attendus [J]. Intestinal, 2020, 69: 2232-2243.
[55] [traduction] SLIVE ZM, BLIKSLAGER à. Le rôle intégral des protéines de jonction serrée dans la réparation de l’épithélium intestinal lésé [J]. Int J Mol Sci, 2020, 21(3): 972.
[56] [traduction] SICARD (France) JF, Le BIHAN G, VOGELEER P, et al. Interaction Des bactéries intestinales avec des composants du mucus intestinal [J]. Infection cellulaire frontale Microbiol,2017, 7: 387.
[57] [traduction] À propos de SUPINDA BUNYAVANICH M, bérin C. Food allergy and Le microbiome: compréhensions actuelles et orientations futures [J]. J Allergy Clin Immun, 2019, 144(6): 1468-1477.
[58] [traduction] À propos de STUMPF F. Le travail regarder at the Puant puant side of Physiologie: Les transports Des acides gras à chaîne courte [J]. Pflügers Arch, 2018, 470: 571-598.
[59] [traduction] WANG KP, CHENG F, PAN XL, et al. Etude du transport et de l’absorption De l’angélique Polysaccharide sinensis through Tractus gastro-intestinal in vitro et in vivo [J]. Drug Deliv, 2017, 24(1): 1360-1371.
[60] [traduction] BAI JY, LI TTT,ZHANG WH, et al. Evaluation systématique du catabolisme β-glucane de l’avoine au cours de Digestion in vitro and fermentation [J]. Food Chem, 2021, 348: 8308-8146.
[61] [traduction] À propos de KOH A, VADDER (en anglais) FD, PETIA: KD, et al. À partir de dietary fibre to Physiologie de l’hôte: les acides gras à chaîne courte comme métabolites bactériens clés [J]. Cell, 2016, 165(6): 1332-1345.
[62] [traduction] ZHANG DD, LIU J, CHNE G, et al.Interactions entre polysaccharides And Le ventremicrobiota: A metabolomic and microbienreview [J]. Food Res Int, 2022, 160: 0963-9969.
[63] [traduction] CHONG J, MA JD, ZHANG JW, et al. Progrès de la recherche sur la régulation immunitaire intestinale par SCFAs [J]. Life Sci, 2023, 35(5): 663-670.
[64] [traduction] Le CHRIST S, DABEK: les femmes A, voitätä M, et al. The proéminent role of Butyrate par rapport au bêta-hydroxybutyrate en tant qu’inhibiteur de l’histone déacetylase, transcriptionnel régulateur and anti-inflammatoire molécule [J]. Sci Rep, 2019, 9(1): 742.
[65] [traduction] MARKUS W, KAUTENBUEGER T, DAUMANN H, et al. Inhibition de l’histone-déacétylase activity by Chaîne courte fatty acids and some Métabolites de polyphénol formés dans le côlon [J]. J Nutr Biochem, 2008, 19(9): 587-593.
[66] [traduction] KNETHEN VA, HEINICKE U, WEIGERT A, et al. Les inhibiteurs de déacetylation de l’histone agissent en tant que régulateurs des lymphocytes T régulateurs [J]. Mol Sci, 2020, 21(7) : 2356.
[67] [traduction] Le TAN Je, macià L, À propos de MACKAY CR. diététique fiber and SCFAs in the Régulation de l’immunité muqueuse [J]. J Allergy Clin Immunol, 2023, 151(2): 361-370.
[68] [traduction] À propos de NADEEM A, SIDDIQUI N, ALHARBI NO, et al. aiguë L’appauvrissement en glutathion entraîne une amélioration de la réactivité des voies respiratoires et de l’inflammation via p38MAPK-iNOS parcours in allergique mice [J]. Int Immunopharmacol, 2014, 22 (1): 222-229.
[69] [traduction] aimer CL, SHAWN, un homme MDB, BRADLEY LB, et al. effet De β-glucane diététique on intestinal microbial La diversité and La salmonelle Immunogénicité du vaccin and efficacy in porcs [J]. Formation et enseignement professionnels Microbiol, 2023, 278:
1378-1135.
[70] [traduction] ALJEWICZ M, NALEPA B, CIESIELSKI S. l’influence de différents types de β-glucans sur le microbiote intestinal de rats nourris de gels de lait [J]. J Funct Foods, 2022, 89: 1756-4646.
[71] [traduction] COSTANZO M, PAULISN, BIASUCCI G. Butyrate: A link between early life nutrition and gut microbiome in the development of food allergy [J]. Life, 2021, 11(5): 384.
[72] [traduction] WANG CC, WU H, LIN FH, Et al. Le butyrate de Sodium améliore l’intégrité intestinale, inhibe l’activation des mastocytes, la production de médiateurs inflammatoires et la voie de signalisation JNK chez les porcs sevrés [J]. Innate Immun, 2017, 24: 40-46.
[73] [traduction] RORIE JW, KEOWN NM. Comprendre la physique des fibres fonctionnelles dans the gastro-intestinal Tract: un Fondé sur des données probantes Approche: to Résoudre les idées fausses durables sur les fibres insolubles et solubles [J]. J Acad Nutr Diet, 2017, 117(2): 251-264.
[74] [traduction] SIMA P, VANNUCCI L, VETVICKA V. : les femmes β-glucans and Cholestérol (revue) [J]. Mol Med, 2018, 41: 1799-1808.
[75] [traduction] LIU B, YANG T, LUO Y, et al. Le β-glucane de l’avoine inhibe l’adipogenèse et la stéatose hépatique chez les souris hyperlipidémiques induites par l’alimentation riche en graisses via la signalisation AMPK [J]. J Funct Foods, 2018, 41: 77-82.
[76] [traduction] MO XX, SUN YH, LIANG XL, et al. La levure β-glucane Insoluble atténue la teneur en graisse Induit par l’alimentation l’obésité by regulating gut microbiote and Ses métabolites [J]. Carbohyd Polym, 2022, 281: 8144-8617.
[77] [traduction] SEIICHIRO A, YASUNORI I, NORIKO K, et al. Effets de l’orge à haute teneur en β-glucane on viscérale Matières grasses l’obésité in japonais Particuliers: A Étude randomisée en double aveugle [J]. Nutrition, 2017, 42: 1-6.
[78] [traduction] CHAKRABORTY S, RAJESWARI VD. biomédical Les aspects of Bêta-glucane sur le métabolisme du glucose et son rôle sur le gène primaire PIK3R1 [J]. J Funct Foods, 2022, 99: 1756-4646.
[79] GUO HQ, WU HL, KONG XQ, et al. Oat β-glucane améliore le diabète dans Alimentation riche en graisses et souris induites par la streptozotocine en régulant les métabolites [J]. JNutr Biochem, 2023, 113: 2955-2863.
[80] [traduction] WU LJ, ZHAO J, ZHANG XN, et al. Effet antitumoral du β-glucane soluble en tant que stimulant immunitaire [J]. Int J Biol Macromol, 2021, 179: 116-124.
[81] CHOROMANSKA A, A propos de KULBACKA J, REMBIALKOWSKA N, et Al. Propriétés anticancéreuses de l’avoine de faible poids moléculaire bêta-glucane — une étude in vitro [J]. Int J Biol Macromol, 2015, 80: 23-28.
[82] [traduction] XIE WY, SHAO F, DUAN XH, et al. La particule entière de β-glucane atténue AOM/DSS induit colorectal tumorigénèse in mice via l’inhibition D’inflammation intestinale [J]. Avant Pharmacol, 2023. DOI: 10.3389/fphar. 2023.1017475
[83] ZHANG XR, LI TT, LIU Le SW, et al. β-glucan from Lentinus Edodes inhibe la progression du cancer du sein via l’axe Nur77/HIF-1α [J]. Biosci Rep, 2020. DOI: 10.1042/BSR20201006
-
Précédent précédent
Quelle est la méthode de test pour ß glucane?
-
Suivant:
Le bêta glucane est-il bon pour vous?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



