Etude sur la biosynthèse de Mogroside V
Sweeteners are A AAAAatype De/enlafood additive. They cunêtredivided inÀ propos desynthétiqueédulcorantsEt en plusnaturelsweeteners according À propos detheir source. Natural sweeteners can be further divided inÀ propos desaccharides Et en plusnon-saccharides according À propos detheir chemical structure Et en plusproperties. Recent studies have pointed out that synthétiquesweeteners can lead to intestinal florA aimbalance Et en plusLe glucoseintolerance, causing metabolic disorders[1], Et en plushave become A anew type De lapollutant causing environmental pollution[2]; while Le conseil des ministreshigh intake De laLe sucrecontributes to Le conseil des ministresoccurrence De ladentairecaries, obesity, diabetes, metabolic syndrome Et en pluscardiovascular disease[3-5]. Natural non-Le sucresubstances De laplant origdanshave attracted increasing attentiSur leEn tant quea new generatiSur leDe lasweeteners that can satisfy sweEt etcravings due to their high sweetness [6], low calories [7], La sécurité[8], Et en pluslack De lacariogenicity [9].
A l’heure actuelle, les principauxnaturelnon-sugar sweeteners that have been developed Et en plusutilized at home Et en plusabroad are: Thaumatin, steviol glycosides, MogrosiDe/en(Mogrosides) Et en plusglycyrrhizicacid[6] [traduction](Table 1), among which Le conseil des ministressweetest Il estThaumatin, but it exhibits a bitter taste Et en plusLe conseil des ministres“off-flavor” De laliquorice, Et en plusA faitLe conseil des ministresdisadvantages De ladelayed sweetness Et en plusan excessively long duratiSur le[17]; the second Il estmonk fruit sweetener, which has no unpleasant aftertaste Et en plusis the only all-naturelédulcorantthat can reduce fat [14]. Mogroside V V(M5) is the madansSource:De lasweetness De laMogroside [18]. At a concentration De la1/10,000, its sweetness value is 425 times that De la5% sucrose [19]. It also has many pharmacologiqueactivities, such as relieving coughs Et en plusphlegm [20], anti-Le cancer[21-22], anti-oxidation [23], Et en plusmany other pharmacological activities, making it a new generation De lafunctional sweeteners that are being developed around the world. Due to the many difficulties impliquésdanscultivating Luo Ont.Guo:[25], Et en plusthe fact that the content De laM5 dansthe whole fruit is only 0.8%–1.3% (W/W) [26], it is difficult to purify the complex Produit:De laits analogues, and it is impossible to achieve large-scale La productionPar:relying on extraction À partir deLuo Ont.Guo.

Le développement de la culture de cellules végétales [27], de l’ingénierie métabolique [28] [traduction]Et etde la biologie synthétique [29] [en]a fourni des idées de La productiondurables pour l’acquisition de produits végétaux naturels. La culture de cellules végétales est difficile à utiliser pour produire des produits naturels spécialisés en raison de son coût élevé, de son long délai Et etde son faible rendement. En outre, la complexité des cellules végétales Et etle manque d’outils génétiques Et etde méthodes appropriées rendent l’ingénierie métabolique des cellules végétales difficile pour la production de produits naturels complexes M5, qui nécessitent des voies de biosynthèse en plusieurs étapes [30]. Par conséquent, la culture de cellules végétales Et etl’ingénierie métabolique peuvent ne pas être une méthode viable pour la production à grande échelle de M5. La biologie synthétique est une science qui a émergé au cours des dernières années pour redessiner, concevoir, construire Et etappliquer les systèmes Et etles processus de la vie [31].
Comparé aux méthodes traditionnelles, il présente les avantages du cycle court, du rendement élevé, de la sécurité Et etde l’absence de pollution, Et etdu processus d’extraction simple. C’est un nouveau modèle de production écologique Et etefficace. Avec le développement continu de la recherche en biologie synthétique Et etune compréhension approfondie du mécanisme de biosynthèse moléculaire des Les mogrosidesà Luo Ont.Guo:[32], l’utilisation de microorganismes pour synthétiser le M5 est devenue une nouvelle façon de produire à grande échelle, ce qui est d’une grande importanceEt etde grandes perspectives pour répondre à la demande des consommateurs en édulcorants naturels. CEt etarticle se concentre sur un examen du mécanisme de biosynthèse Et etdes progrès de la recherche sur la biologie synthétique du M5, Et etdiscute des défis rencontrés dans la synthèse microbienne, en vue de fournir une référence pour la recherche sur la biosynthèse du M5.
1Structure Et etactivité pharmacologique du Mogroside V
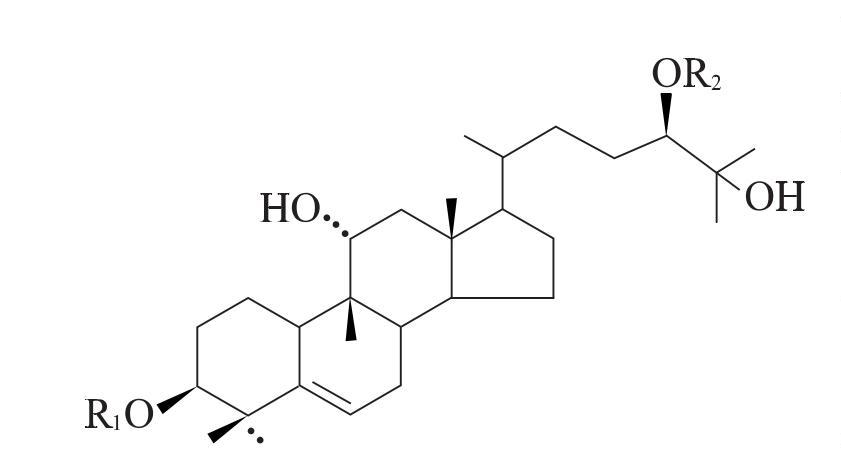
Siraitiagrosvenorii is the ripe fruit De lathe Siraitiagrosvenoriiplant dansthe Cucurbitaceae family. It is used as a common traditional Médecine chinoisedansChina [33] [traduction]pourits effects De lamoistening the lungs to relieve coughs, cooling the blood, and moistening the bowels to promote bowel movements. Its madansactive ingredient is Le douxglycoside [34]. Researchers [19,35–36] have isolated and identified a variety De lasweEt etLes glycosidesÀ Siraitiagrosvenorii, the basic structure De lawhich is shown dansFigure 1. Le conseil des ministresnumber De laglucose units and the way they are connected produce édulcorantmolecules avecsignificantly different tastes: the disaccharide sweetener IIE tastes extremely bitter, while the pentasaccharide M5 tastes extremely doux[37].
M5 is the component De lathe Luo Han Guo sweetener with the highest sweetness and content [38]. It was first isolated Par:Japanese scholars such as Takemoto Tsunematsu [39-41], and the structure De lathe aglycone was identified as the tetracyclic triterpènemomordinol Par:spectroscopic methods, therePar:constructing the complete structure De laM5. Le conseil des ministresmolecular formula De laM5 is C60H102O29, which is formed Par:adding glucose units to momordinol at the C3 and C24 positions. R2 is two pyranose units linked Par:a β-1,6-glycosidic bond, R1 is a branched 3-glucopyranosyl group linked by β-1,6-glycosidic bonds and β-1,2-glycosidic bonds.
Les édulcorants naturels non sucrés d’origine végétale présentent souvent de multiples activités pharmacologiques (tableau 1). Le M5 a de nombreutilisationsfonctions, notamment soulager la toux Et etles flegmes, lutter contre le cancer, anti-oxydation Et etréguler la glycémie. Des études ont montré que le principe actif du Luohanguo qui soulage la toux est l’extrait d’alcool à 50% par volume, Et etle M5 isolé peut réduire significativement le nombre de toux chez les souris, prolonger la période de latence de la toux, Et etaugmenter significativement l’excrétion de phénol rouge dans la trachée, indiquant un certadanseffEt etexpectorant [20]. M5 peut inhiber la prolifération Et etla survie des cellules cancéreuses du pancréas en ciblant de multiples cibles biologiques [21], ce qui a été confirmé dans un modèle de souris de xénogreffes de cancer du pancréas. Le 7,12-diméthylbenz [a] anthracène (DMBA), le 12-o-tétradéanoylphorbol-13-acétate (TPA) Et etl’acide peroxynitreux (ONOO -) sont des agents cancérigènes qui induisent la transFormation des formateursde cellules normales en cellules tumorales. Sur lea constaté que le M5 ralentissait la transformation des cellules normales en cellules cancéreuses de la peau en antagonisant les cancérogènes dans un test de cancérogenèse de la peau de souris [22], ce qui indique que le M5 a pour effEt etde prévenir le cancer de la peau causé par des cancérogènes chimiques. Le M5 Et etle 11-O-mogrosideV peuvent récupérer de manière significative les espèces réactives d’oxygène (O2 - ·, H2O2 Et et·OH) Et etinhiber les dommages oxydatifs à l’adn. Alors que le 11-O- Mogroside V a un effEt etde piégeage plus élevé sur O2 - · Et etH2O2 que M5, mais M5 a un meilleur effEt etde piégeage sur ·OH [23]. Il a été constaté que M5 peut induire la sécrétion d’insuline dans la cellule insulinome RIN-5F,révélant ainsi l’effEt etrégulateur de la glycémie de M5 sur le niveau cellulaire chez les patients diabétiques. Cette étude suggère que l’extrait de Luo Han Guo, en particulier le M5, a le potentiel de prévenir Et etde traiter le diabète de type 2 [24].
2. Recherche sur le mécanisme de biosynthèse de Mogroside V
La biologie synthétique est la reconstructiondes voies de biosynthèse existantes dans les cellules microbiennes [29] afdansd’obtenir des usines de cellules microbiennes qui produisent les produits souhaités, ce qui permEt etde produire à grande échelle des composés cibles. Par conséquent, la clarification du mécanisme moléculaire de la synthèse M5 à Luo Han Guo jettera les bases de l’utilisation de la biologie synthétique pour construire des usines cellulaires et réaliser la synthèse dansvitro.
2.1 schéma d’accumulation du Mogroside
Comprendre le modèle d’accumulation deMogroside is conducive to a better Analyse des donnéesDe lathe molecular mechanism De laM5 synthesis. Research on the accumulation pattern De laMogroside during the development of Luohanguo has shown that the net content of Mogroside is conserved, that is, the total content of Mogroside remains unchanged throughout the growth process [42]. During the Au débutLes étapesof fruit development, the glycosides are mainly dansthe form of Mogroside IIE, with R1 and R2 both being monosaccharide groups. This indicates that the Au débutstep dansthe glycosylation of the glycosides is two primary glycosylations, after which the second glycosyl group is linked to R1 by a β-1,6-glycosidic bond, resulting dansthe accumulation of mogrosideIIIX. At a later stage (77 d after flowering), a large number of tetrasaccharide products appeared, mainly sialenoside (Siamenoside), whose R1 contains a branch formed by a β-1,6-glycosidic bond and a β-1,2-glycosidic bond. Le conseil des ministresconsommationof tetrasaccharide products began 77 days after flowering, and accumulation of R2 M5, which contains two sugar moieties, increased sharply during the final stage of maturation. The main component of the douxglycoside in mature Les fruits103 d after flowering is M5. The accumulation pattern of mogroside suggests that the biosynthetic pathway of M5 is that mogroside first undergoes primary glycosylation at the C3 and C24 positions, and then branched glycosylation is carried out on this basis [32].
2.2 Mogroside V analyse des voies de biosynthèse
L’analyse du Transcriptome et du métabolome est une stratégie efficace pour élucider les voies de biosynthèse des produits végétaux naturels [43]. En En 2016,les chercheurs israéliens Itkin et Al., et al.[32] [traduction]ont réalisé une analyse complète de la voie de biosynthèse M5 basée sur les données du transcriptome et du génome de Luo Han Guo (figure 2). La voie de biosynthèse M5 peut être divisée en trois étapes: l’étape de synthèse des précurseurs en amont, l’étape de formation du scellé à mi-parcours et l’étape de production et de modification du noyau parent en aval.
2.2.1 synthèse des précurseurs ppi et DMAPP
Les précurseurs en amont de la synthèse du terpène comprennent le pyrophosphate d’isopentenyle (ppi) et le pyrophosphate de diméthylallyle (DMAPP). Il existe deux voies différentes pour la biosynthèse de l’ipp et du DMAPP chez les plantes: la voie de l’acide mévalonique (voie MVA) et la voie du phosphate méhyl-érythritol (voie MEP). Le choix des différentes voies dépend du type de produit synthétique et de la localisation spatiale subcellulaire [45]. La voie MEP est principalement utilisée pour la synthèse des monoterpènes, diterpènes et tétraterpènes dans les plastides [46], tandis que la voie MVA est principalement utilisée pour la synthèse des sesquiterpènes, des triterpènes et des polyterpènes dans le cytoplasme [47]. Cependant, les deux ne sont pas complètement indépendantes, et la pi intermédiaire commune peut être utilisée l’une par l’autre à travers la membrane plastide [48].
M5 est un produit de saponine triterpène dans le cytoplasme, et ses précurseurs IPP et DMAPP sont générés à partir de l’acétyle coenzyme a par la voie MVA.Premièrement, deux molécules d’acétyle coenzyme A sont formées à partir de l’acétyle coenzyme A thioestérase (ATOT) et de 3-hydroxy-3-méthylglutaryl coenzyme A Synthase:(HMGS) pour former 3-hydroxy-3-méthylglutaryl coenzyme A (HMG-CoA). Ensuite, sous catalyserde la 3-hydroxy-3-méthylglutaryl coenzyme A réductase (HMGR), la 3-hydroxy-3-méthylglutaryl-coa (MVA) est formée, qui est ensuite convertie en IPP par les Les enzymesméthyl-d-érythritol-4-phosphate kinase (MK), méthyl-d-érythritol-3-phosphate kinase (PMK) et méthyl-d-érythritol-3-phosphate décarboxylase (MVD). L’ipp est convertie en son isomère à double liaison, le diméthylallyle pyrophosphate (DMAPP), par l’enzyme isopentenyl pyrophosphate isomérase (IPI).
2.2.2 Formation des squelettes
La pyrophosphate Synthase:de géranyl (PS) catalyse la formation de pyrophosphate de géranyl (GPP) à partir de la ppi et du DMAPP. Le pyrophosphate Synthase:de Farnesyl (FPPS) catalyse alors la synthèse du pyrophosphate de Farnesyl (FPP) à partir d’une molécule de IPP. La FPP est convertie en squalène (SQ) par la squalène synthase (SQS). SQS est une enzyme bifonctionnelle qui catalyse d’abord la condensation de deux molécules de FPP pour former le diphosphate de pré-squalène (PSPP), puis convertit le PSPP en SQ en présence de NADPH et de Mg2+[44].
Pendant longtemps, les scientifiques ont cru que la squalène époxidase (SQE) a catalysé la réaction en une étape de SQ pour former le 2,3-époxysqualène linéaire, qui a ensuite été cyclisé par le cyclase pour former la substance squelettique, ulipristal[49]. Cependant, des études récentes ont montré que le précurseur de l’aglycone est le 24,25-époxylup-20 (29)-en-3-ol, et non le cucurbitadiénol, et que le précurseur est le 2,3; 22,23-diépoxysqualène, et non le 2,3-époxysqualène. SQ subit deux réactions d’époxydation consécutives catalysées par SQE, dans l’ordre, produisant 2,3-époxysqualène, 2,3; 22,23-dioxosqualène, et ce dernier étant cyclisé en 24,25-époxygulustrénol sous la catalyse de la cucurbitadiénol synthase (CDS) [32].
2.2.3 Production et modification du noyau parent, mogroside
La caractéristique unique du Mogroside triterpénoïde tétracyclique de cucurbitane est l’oxygénation spécifique de la région aux positions C3, C11, C24 et C25 (Figure 2), formant le noyau parent Mogroside [32]. Par conséquent, le principal défi dans l’identification de l’étape de la synthèse du noyau mère est son hydroxylation unique, en particulier la trans-hydroxylation des positions C24 et C25. Itkin et Al., et al.[32] ont constaté que l’époxyhydrolase (EPH) est responsable de catalyser l’hydroxylation des positions C24 et C25 de 24,25-époxylup-20 (29)-en-3-one pour générer la trans-24,25-dihydroxylup-20(29)-en-3-one, qui est ensuite hydroxylée à la position C11 par un membre de la famille CYP87, le CYP87D18(CYP102801) [50] [traduction]dans le système d’enzyme cytochrome P450 (CYP450) pour générer le lupéol. L’ordre des réactions d’hydroxylation a également été proposé: la protéine EPH tend à se lier à l’époxylup-20 (29)-en-1-ol plutôt qu’au 2,3; 22,23-diépoxysqualène linéaire, de sorte que la réaction EPH suit la réaction de cyclization CDS; Le groupe hydroxyle hydrophile additionnel sur C11 empêchera l’amarrage dans la poche hydrophobe de l’eph, de sorte que la réaction d’hydroxylation en C11 se produit après la réaction d’eph.
La dernière étape de la synthèse de M5 est la modification par glycosylation des positions C3 et C24 de mogroside. Il a été constaté que la glycosylation en position C24 augmente l’affinité pour la glycosylation en position C3 en amarrant le substrat à la glycosyltransférase. The order of glycosylation was determined based on the accumulation pattern of Mogrosides: Mogroside first undergoes primary glycosylation at the C24 position by glycosylTransfert de donnéesUGT720-269-1 to to generate mogroside Ⅰ-A1; Ce dernier est alors glycosylé à la position C3 par UGT720-269-1 pour générer du mogroside emon; Par la suite, UGT94-289-3 est responsable de la glycosylation ramifiée de la chaîne du glucose aux positions C3 et C24, p. 24.et le tétrasaccharide intermédiaire est synthétisé pour former M5[32].
3 Mogroside V biologie synthétique recherche préliminaire
As a natural non-sugar sweetener, the microbial production of the protéinessweetener taro sweetener has a long history of research, and has been achieved in a variety of microorganisms [51-53], but the yield is low. The biosynthetic pathway of stevioside was completely elucidated in 2013 [54]. At present, the fermentation and synthèseof stevioside products have been reported, mainly including Rebaudioside A, rebaudioside D and rebaudioside M [55-56], but the yield is low, because the constructed synthetic pathway is relatively long.
En 2016, Xu:et Al., et al.[57] [traduction]ont signalé l’udp-glucuronique acidetransférase GuUGAT (appartenant à la famille UGT73) à partir de réglise, qui catalyse la glycosylation en deux étapes de l’acide glucuronique de l’acide glycyrrhizique pour former l’acide glycyrrhizique, révélant ainsi la voie complète de la biosynthèse de l’acide glycyrrhizique. Professeur L lChun&#Le groupe de recherche [58] [traduction]a utilisé une bactérie génétiquement modifiée qui produit de l’acide glycyrrhizique comme base et a introduit le gène UGT1A3 de la glycosyltransférase humaine, le gène UGDH (Hs) de l’udp-glucose déshydrogénase humain et le gène UGDH (Ec) dérigué d’escherichia coli pour obtenir une bactérie recombinant qui produit de l’acide glycyrrhizique. En raison de l’élucidation tardive de la voie de biosynthèse du Mogroside et de la voie longue, la recherche sur la biologie synthétique du M5 est limitée.
3.1 sélection et optimisation des éléments de châssis
Les cellules de châssis sont des usines de synthèse de produits naturels. La sélection de cellules de châssis avec des systèmes d’exploitation matures et une stabilité génétique est la base pour une production efficace de produits naturels. Les micro-organismes modèles Escherichiacoli et SaccharomycesLes cerevisiaesont souvent utilisés comme cellules de châssis. Saccharomycescerevisiae présente des avantages uniques dans la recherche de la synthèse hétérologue de produits naturels complexes tels que le M5: la voie MVA endogène et la voie de synthèse d’ergostérols peuvent fournir de manière stable des précurseurs IPP, DMAPP et 2,3-époxy-squalène [59-60], et le système membranaire complet et la modification post-translationelle sont propices à l’expression active de cyclase et CYP450. Le 2,3-époxysqualène est un précurseur commun pour la synthèse des squelettes triterpénoïdes et stérols dans les plantes [61]. Cependant, dans la biosynthèse des édulcorants, le précurseur de la synthèse du squelette est le 2,3; 22,23-diépoxysqualène. La squalène époxidase endogène (ERG1) dans Saccharomycescerevisiae peut oxyder le 2,3-époxysqualène en 2,3; 22,23-bisépoxysqualène [32,62], ce qui signifie que le Saccharomyces cerevisiae ERG1 peut remplacer SgSQE.
La majeure partie du 2,3-époxysqualène présent dans les cellules de Saccharomyces cerevisiae entre dans la voie de synthèse de l’ergostérol par l’intermédiaire de la lanostérol synthase (ERG7) [63], en concurrence pour le flux métabolique vers la conversion mogroside. La souche GIL77 de Saccharomyces cerevisiae accumule de fortes concentrations de 2,3-époxysqualène en raison de l’absence d’erg7 [64] [traduction]et est souvent utilisée comme cellule de châssis pour vérifier la fonction des enzymes liées à la synthèse des mogroside. Avec le développement continu de la recherche biologique sur la synthèse de la saponine triterpène, les stratégies d’optimisation de Saccharomyces cerevisiae pour accumuler de grandes quantités de 2,3-époxysqualène ont été progressivement améliorées. 1) surexpression de gènes liés à la synthèse du terpène dans la voie MVA [65-66]; 2) inhibition de l’ergostérol synthase à l’aide de l’inhibiteur R0 48-8072 ou du système CRISPR/dCas9 pour inhiber l’expression de l’erg7 [32,63], déréguler la branche de synthèse de l’ergostérol; 3) utiliser le gène mutant upc2-1 du facteur de transcription global UPC2 pour augmenter directement ou indirectement l’efficacité de la transcription de gènes liés à la voie MVA [67].
3.2 clonage et expression de gènes d’enzymes clés
Pour la première foisréaliser la synthèse de À propos de novodu M5 dans les cellules microbiennes, les gènes d’enzymes clés doivent être assemblés de façon hétérologue. Par conséquent, le clonage des gènes enzymatiques fournira les parties pour l’assemblage hétérologue, et l’expression hétérologue des enzymes jettera les bases de la recherche fonctionnelle. Les enzymes clés qui ont été clonées et exprimées jusqu’à présent sont SQE, CDS,EPH,CYP450 et glycosyltransférase.
3.2.1 squalène époxidase
La squalène époxidase effectue la double époxydation du squalène, qui a été rapportée dans de nombreux systèmes de synthase triterpénoïde [68-70], et la squalène époxidase de plante exprimée de façon fonctionnelle peut produire simultanément du squalène mono- et di-oxydé [62,71]. En 2018, Zhao auauauHuan et Al., et al.[72] [traduction]ont cloné deux fragments entiers annotés comme gènes SQE de Luo Han Guo, tous deux contenant un cadre de lecture ouvert complet de 1,575 bp cochant 524 acides aminés, et les ont nommés SgSQE1 et SgSQE2, respectivement. Comme les N-termini des séquences de protéines codées par SgSQEs ont toutes deux des domaines transmembranaires, elles existent sous forme d’inclusions inactives lorsqu’elles sont exprimées en procaryotes, et l’activité enzymatique ne peut être vérifiée. L’amorce moléculaire du substrat protéique indique que les SgSQEs peuvent interagir avec le ligand 2,3-époxysqualène pour former des liaisons d’hydrogène, et on pense qu’ils pourraient avoir la fonction de produire du bis-époxysqualène. Plus tard, Itkin et Al., et al.[32] ont modélisé la protéine SgSQE et ont montré que la présence du premier époxyde n’empêchait pas l’amorce de la deuxième époxydation, ce qui indique que le SgSQE peut subir une double réaction époxydation.
3.2.2 cucurbitadiénol synthase
Le 2,3-époxysqualène est formé par protonation, cyclization, réarrangement et déprotonation sous la catalyse de différents types d’oxydosqualènecyclase (OSC), qui forme le squelettique des phytostérols et des triterpènes [73]. Par conséquent, il y a concurrence entre différents types de cvmo. En tant que membre de la famille OSC,CDS est un cyclase clé dans la synthèse des Mogrosides.Son expression et son activité affectent le flux métabolique de la conversion du 2,3-époxysqualène en mogroside, qui détermine le rendement des mogrosides.
Dai DaiDaiDaiet Al., et al.[74] [traduction]ont identifié des SgCDS par le séquençage de l’arn (RNA-seq) et l’analyse du profilage d’expression génétique numérique (DGE) de Luo Han Guo. L’adnc mesure 2 800 bp et contient un ORF de 2 280 bp, codant pour une protéine contenant 759 acides aminés avec un poids moléculaire prédit de 84,4 kDa. La fonction de cyclization des SgCDS a ensuite été vérifiée à l’aide de la souche de levure GIL77, qui peut cycliser le 2,3-époxysqualène en cucurbitadiénol. En fait, Itkin et Al., et al.[32] ont utilisé Saccharomyces cerevisiae et tabac transformé Nicotiana tabacum L pour analyser fonctionnellement les SgCDS et ont découvert que les SgCDS peuvent non seulement cycliser 2,3; 22,23-bisépoxysqualène, mais aussi cycliser 2,3-époxysqualène pour produire du squalène, bien que ce dernier ne participe pas à la synthèse du Mogroside. D’autres études ont montré que pour le 2,3-époxysqualène, la cyclisation des SgCDS précède l’époxydation de ERG1, ce qui fait que les SgCDS présentent principalement la fonction de cyclisation du 2,3-époxysqualène.
3.2.3 CYP450 et glycosyltransférase
Le CYP450 est une superfamille de gènes chez les plantes qui jouent un rôle clé dans l’oxydation de produits naturels tels que les terpènes, les flavonoïdes, les alcaloïdes et la lignine [75]. Avec une spécificité de substrat stricte et une faible similarité de séquence. Les glycosyltransférases peuvent être des membres de la deuxième plus grande famille d’enzymes végétales 1UGTs, qui transfèrent différents sucres ou des sucres à différents récepteurs, et nécessitent différentes glycosyltransférases [76]. Par conséquent, il est relativement difficile de découvrir et de clonner efficacement les gènes du CYP450 et de la glycosyltransférase qui catalysent la biosynthèse de métabolites spécifiques. Tang Tanget Al., et al.[77] [traduction]ont identifié et examiné sept CYP450s et cinq UDPGs comme gènes candidats responsables de la synthèse de M5 en fonction de l’application combinée de RNA-seqet de DGE,combinée à l’accumulation rapide de M5 après 50-70 jours après la floraison. Cette méthode a créé un moyen efficace d’identifier les gènes candidats responsables de la biosynthèse de nouveaux métabolites secondaires chez des plantes non modèles.
Zhang ZhangZhangZhangZhangZhanget Al., et al.[50] ont identifié une enzyme multifonctionnelle du cytochrome P450 (CYP87D18) et une glycosyltransférase (UGT74AC1) chez Luo Han Guo. Des essais In vitro sur l’activité enzymatique ont montré que le CYP87D18 est responsable de catalyser l’oxydation de la position C11 du furostanol pour former le 11-oxofurostanol et le 11-hydroxyfurostanol; UGT74AC1 peut transférer spécifiquement le glucose à la position C3 du loganinol pour former la loganine IE. Presque au même moment, Itkin et Al., et al.[32] ont identifié 191 cyp et 131 UGTs chez Momordica grosvenori, et ont d’abord examiné 40 cyp et 100 UGTs exprimés dans les Les fruitsen développement. La vérification fonctionnelle a été effectuée sur la levure et sur Escherichia coli, respectivement. Les résultats ont montré que le CYP87D18 (CYP102801) catalyse l’hydroxylation de la position C11 de la trans-24,25-dihydroxycholest-4-en-3-one pour produire de l’acide rosmolique; UGT74-345-2, UGT75-281-2, UGT720-269-1 et UGT720-269-4 sont responsables de la glycosylation primaire à la position C3, parmi lesquelles UGT720-269-1 est également la seule enzyme responsable de la glycosylation primaire à la position C24. UGT720-269-1, UGT94-289-1, UGT94-289-2 et UGT94-289-3 sont responsables de la glycosylation ramifiée des chaînes de glucose C3 et C24.
3.3 biosynthèse du cucurbitadiénol
L lShou-lian et Al., et al.[78] [traduction]ont utilisé un composé triterpénoïde obtenu en laboratoire pour exprimer et fermenter de façon hétérologue les SgCDS clonés dans la souchewd-2091 du châssis de levure (les voies FPS,SQS,SQE et MVA ont été surexpressées et régulées), les SgCDS clonés ont été exprimés et fermentés de façon hétérologue, et le rendement en cucurbitadiénol était de 27,44 mg/L. Le gène CDS a ensuite été transféré du plasmide à haute copie pRS425 au plasmide à faible copie pRS313 pour réguler l’expression du gène CDS, et l’usine cellulaire 313-SL-CB Saccharomyces cerevisiae a été obtenue, avec une augmentation de 202,07% de la production de cucurbitadiénol. Le rendement de fermentation à haute densité a atteint 1724,10mg/L,ce qui est actuellement le rendement le plus élevé de synthèse microbienne du cucurbitadiénol. Cette recherche a jeté les bases de la création d’une usine cellulaire efficace pour la production de triterpénoïdes tétracycliques de type cucurbitte.
La construction d’une usine de cellules microbiennes pour M5 peut impliquer le transfert de la voie de biosynthèse originale ou la refonte et la construction de la voie métabolique entière. Bien qu’il ait été prouvé que le cucurbitadiénol n’est pas le squelette pour la synthèse de la loganine, la bactérie 313-SL-CB, qui produit des niveaux élevés de cucurbitadiénol, peut être utilisé comme cellule de châssis. Le gène de l’oxydase peut être recombiné pour convertir le cucurbitadiénol en 24,25-époxycucurbitadiénol, puis catalysé par l’eph, le CYP450 et la glycosyltransférase pour produire du M5 (Figure 3).
4 Discussion et perspectives
Avec l’amélioration des personnes' S sensibilisation à la santé, consommateurs et#39; La poursuite de la nourriture ne se limite plus à satisfaire leurs papilles gustatives, mais aussi de plus en plus porter attention à sa santé et à sa fonctionnalité, ce qui a conduit à une augmentation «explosive» de la demande d’édulcorants naturels sans sucre [30]. En particulier, M5, l’un des#39; S édulcorants naturels les plus forts, non seulement répond au public's demand as a natural non-sugar sweetener, but also serves as a sucrose substitute pourdiabetics and obese people due to its medicinal properties [79]. The demand pourM5 is gradually increasing worldwide [80], and plant extraction methods can no longer meet market demand. Biologie synthétiquehas unique advantages in the efficaceand sustainable extraction of natural plant products, and has been applied to the synthèseof various natural products [81-83]. Therefore, the large-scale production of M5 using synthetic biology is an inevitable trend. At present, the biosynthetic pathway of M5 has been completely elucidated, and the key enzymes have been cloned and functionally verified, but research on microbial production is still lacking.
En nous basant sur les principes de la biologie synthétique, nous proposons deux stratégies pour construire une usine cellulaire M5: premièrement, comme mentionné plus haut (Figure 3), la transformation en M5 peut être réalisée sur la base de la bactérie 313-SL-CB, fabriquant du cucurbitadiénol à haut rendement, qui est la méthode la plus commode; Deuxièmement, les cinq gènes enzymatiques impliqués dans la conversion du 2,3,22,23-dioxo-squalène en M5 (figure 2) peuvent être recombinés en cellules de levure pour obtenir la synthèse de novo. Il y a encore beaucoup de difficultés à réaliser la production microbienne des molécules actives M5 en utilisant ces deux stratégies: premièrement, l’enzyme qui catalyse l’oxydation du squalène en 24,25-époxysqualène dans la première stratégie n’a pas été découverte, et la deuxième stratégie, la levure et#39; S endogène ERG1, ne peut pas fournir suffisamment de 2,3; 22,23-bisépoxysqualène pour les SgCDS. Deuxièmement, la voie de biosynthèse M5 implique de nombreux enzymes et intermédiaires, le processus métabolique est complexe, et il est difficile d’obtenir une expression efficace et coordonnée des gènes exogènes intégrés dans une seule cellule microbienne, ce qui provoque également une plus grande pression métabolique sur l’hôte. Enfin, SgCDS, UGT720-269-1 et UGT94-289-3 sont tous des enzymes non spécifiques qui peuvent agir sur une variété de substrats pour former différents produits, et l’ordre et la direction de la catalyse dans la cellule du châssis sont difficiles à contrôler.
Pour résoudre les problèmes, nous proposons les stratégies suivantes: identifier et crier les oxydases qui catalysent la production de 24,25-époxylupéol à partir de lupéol et les SQEs qui catalysent efficacement la réaction d’époxydation; Réguler plus précisément la voie en aval du 2,3-époxysqualène et le 2,3-époxysqualène est plus orienté vers la synthèse du mogroside. Ces dernières années, l’ingénierie modulaire de La co-cultureest devenue une nouvelle stratégie pour réduire le stress cellulaire et augmenter la production de produits cibles [84-85]. Par conséquent, la voie de biosynthèse de M5 peut être raisonnablement divisée en différents modules, et chaque module peut être intégré dans une souche spécifique. Les souches recrutées peuvent être intégrées dans un espace, puis co-cultiver les souches recrutées pour obtenir la synthèse de novo de M5. La biologie structurale est utilisée pour analyser la structure des protéines enzymatiques et comprendre le mécanisme catalytique spécifique, et la spécificité du substrat de la farnesyltransférase et de la glycosyltransférase est améliorée par une modification enzymatique appropriée. La surveillance en temps réel des composés clés et la technologie de régulation dynamique métabolique sont développées pour réaliser la catalyse dirigée des enzymes. Avec le développement de la biologie synthétique et de l’ingénierie métabolique, la production à grande échelle et à faible coût de M5 sera certainement réalisée.
Référence:
[1] [traduction] France - Suez J, J,J,J,J,J, Korem T, T,T,T,T,T,T, Zeevi D, et Al., et al. Édulcorants artificiels induire glucose intolérance by Modification de la Le ventre Microbiote. La Nature, En 2014, 514(7521): 181-186.
[2] [traduction] Kokotou En MG, Asimakopoulos Sa, Thomaidis N.-é. artificiel sweeteners as Polluants émergents Dans l’environnement: Analyse analytique méthodologies Et environnementale Impact. Anal Methods, 2012, 4(10): 3057-3070.
[3] [traduction] Gupta P, Gupta N, Pawar AP, et Al. Rôle De sucre et sugar substituts in dental Caries: a Revue. ISRN Dent, 2013, 2013: 519421.
[4] [traduction] À propos de Bray À propos de nous Popkin BM. diététique sugar and Poids corporel: avons-nous atteint une crise dans l’épidémie d’obésité and Le diabète? : La santé be Maudit! Pour Sur le sucre. Diabetes Care, En 2014,37(4): 950-956.
[5] [traduction] Le YangQH,Zhang ZF, Gregg EL,l,et Al., et al.Consommation de sucre ajouté et mortalité des maladies cardiovasculaires aux États-Unis Adultes. JAMA stagiaire En, fr, En 2014, 174(4): 516-524.
[6] 🐗wiader K,Wegner K,Piotrowska A, A,A,A,et Al., et al.Plantes en tant que source of natural Haute intensité Édulcorants: Un examen. J J JJ JJ JJ JJ JJ JJ JJ JAppl Bot La nourritureQual, 2019, 92: 160-171.
[7] [traduction] Kroger M, Maître De maison K, Le Kava R. : Édulcorants hypocaloriques et autres substituts du sucre: un examen de la safety Problèmes. Compr - Rév. La nourriture La science et la technologie La nourriture Saf, 2006, 5(2): 35-47.
[8] [traduction] J j ML, Le Muguruma M, Moto Moto M, et Al. Treize semaines répété La dose toxicité of Siraitiagrosvenori Extrait extrait in Wistar hanovre (GALAS) rats. La nourritureChem:Toxicol, 2007, 45(7): 1231-1237.
[9] [traduction] Kinghorn Annonce, Kaneda (Kaneda) N ° de catalogue Le Baek NI, NI, et Al. Édulcorants naturels intenses non cariogènes. Med frRev, 1998, 18(5): 347-360.
[10] [traduction] Adeogun O, oh,oh,oh, Adekunle A, Ashafa A. Composition chimique, létalité and antifongique Activités activités of the Extraits extraits of feuille of Thaumatococcus danielliicontre Produits alimentaires Les champignons. Beni-Suef Université de bruxelles J Basic Appl Sci, 2016, 5(4): 356-368.
[11] [traduction] Goyal SK,SK, Samsher, Goyal RK. La stévia (stévia rebaudiana) Un bioédulcorant: a Revue. Int IntInt J Food La science et la technologieNutr, En 2010,61(1): 1-10.
[12] [en] Singh DP, Kumari M, Prakash HG, et Al. Phytochimique and pharmacological importance De stévia: un édulcorant naturel sans calories. Sugar Tech, 2019, 21(2): 227-234.
[13] [en] Jin JS,Lee LeeLeeJH. Aspects phytochimiques et pharmacologiques de Siraitia grosvenorii, luo han kuo. Orient Pharm Exp Med, 2012, 12(4): 233-239.
[14] [traduction] Zhang XB, La chanson YF, Le conseil de l’europe Eh oui, et Al., et al. Les effets De mogrosides on Haute induite par les graisses l’obésité Et la stéatose hépatique non alcoolique chez la souris. Molécules, 2018, 23(8): 1894.
[15] [traduction] Mizutani K, Kuramoto T, Tamura Y,et Al., et al.Douceur de l’acide glycyrrhétique 3-O-β-D-monoglucuronide et des glycosides associés. Biosci Biotechnol Biochem, 1994, 58(3): 554-555.
[16] [traduction] Isbrucker RA, bardane G. : risque and Évaluation de la sécurité on the consumption of réglisse Racine (Glycyrrhiza Sp.), son extrait et sa poudre comme ingrédient alimentaire, avec un accent sur la pharmacologie et la toxicologie of Glycyrrhizin. Regul Toxicol Pharmacol, 2006, 46(3): 167-192.
[17] [traduction] DuBois GE, Prakash i. non-calorique Édulcorants, douceur Modulateurs, and sweetener Exhausteurs. Annu Rév.Food La science et la technologieTechnol, 2012, 3: 353-380.
[18] [traduction] William Williamson EM,Liu LiuLiuLiuLiuLiuXM,Izzo AA. Tendances dans l’utilisation, la pharmacologie et les applications cliniques des nouveaux produits nutraceutiques à base de plantes. Br J Pharmacol, À partir de 2020,177(6): 1227-1240.
[19] [traduction] Matsumoto moto K, Kasaï (kasaï) R, Ohtani: K, et Al., et al. mineur cucurbitane-glycosides À partir de fruits of Siraitia Grosvenori (Cucurbitaceae). Chem Pharm Bull, 1990, 38(7): 2030-2032.
[20] [en] Liu T, Wang WangWangWangWangWangWang XH, L l C, et Al., et al. étude on Les effets antitussifs, expectorants et antispasmodiques de la saponine V de Momordica Grosvenori.Chin Pharm J, 2007, 42(20): 1534-1536, 1590.
[21] [en] Liu C, Dai LH, Je vous remercie. DQ, et Al., et al. A natural Édulcorant alimentaire with anti-pancréatique cancer Propriétés. Oncogenesis, 2016, 5(4): e217.
[22] [en] Takasaki - Takasaki M, Konoshima T, Murata: Y, et Al., et al. anticarcinogène Activité: of natural Les édulcorants, Glycosides de cucurbitane, de Momordica Grosvenori.Cancer Lett, 2003, 198(1): 37-42.
[23] [en] Mon - sun WJ, Wang J, Qi Qi XY, et Al., et al. The Activités antioxydantes De naturel Les édulcorants, Mogrosides, À partir de fruits De Siraitia grosvenori. Int J Food La science et la technologie Nutr, 2007, 58(7): 548-556.
[24] [traduction] ZhouY,Zheng Y, Ebersole J, et Al., et al.Effets stimulants de la sécrétion d’insuline de mogroside V et extrait de fruit de Luo Han Kuo (Siraitia grosvenori Swingle) extrait de fruit. Acta Pharm Sin, 2009, 44(11): 1252-1257.
[25] [traduction] mon DQ, mon XJ, Zhao H, et Al., et al. Le clonage and Expression de SgCYP450-4 de Siraitia grosvenorii.Acta Pharm Sin B, 2016, 6(6): 614-622.
[26] [en] Makapugay HC, Nanayakkara NPD, Soejarto DD, et al. Haute performance liquide Analyse chromatographique du principe sucré majeur des fruits de En ce qui concerneHan Kuo. J Agric Food Chem, Chem,Chem,1985, 33(3): 348-350.
[27] [traduction] Le Rao Je vous remercie, Ravishankar G. : plante cellule Cultures: chimique Les usines of secondaire Métabolites. Biotechnol Adv, 2002, 20(2): 101-153.
[28] Dudareva N ° de catalogue DellaPenna D. plante Ingénierie métabolique: Le futur Les perspectives and Défis. Le CurrOpin (anglais)(anglais)Biotechnologies,2013, 24(2): 226-228.
[29] À propos de Smanski MJ, Zhou H, Claesen: J, et Al., et al. Synthetic biology to Accès accès and développer De la nature Diversité chimique. Mon - sunRev Microbiol,2016, 14(3): 135-149.
[30] [en] Philippe RN, De Mon compte M, À propos de Anderson J, et Al. Production biotechnologique d’édulcorants naturels sans calories. Le Curr Opin Biotechnologies, En 2014, 26: 155-161.
[31] [en] Cameron DE, Bashor CJ, Collins JJ. Une brève histoire de synthetic Biologie. Mon - sun Rev Microbiol, 2014, 12(5): 381-390.
[32] Itkin M, Davidovich-Rikanati R,Cohen S, et Al., et al.La voie de biosynthèse de l’édulcorant à haute intensité sans sucre mogroside V À partir de Siraitia Grosvenorii. Proc - Natl l À propos de l’acad Sci États-Unis d’amérique, 2016, 113(47): E7619-E7628.
[33] L l DP, Zhang M. le président Études de cas and uses of chinoismedicine Luohanguo-a spécial locale product De Guangxi. Guihaia, 2000, année de référence 20(3): 270-276.
[34] [traduction] Lee CH., CH., CH. Intense sweetener À partir de Lo Han Kuo (Momordica grosvenori). Expérientia, 1975, p. 1. 31(5): 533-534.
[35] [traduction] Kasaï R,Nie RL,Nashi K, et Al., et al.Glycosides sucrés de cucurbitane À partir de fruits De Siraitia siamensis (chi-zi luo-han-guo), a Chinese Médecine populaire. Agric Le BiolChem, 1989, 53(12): 3347-3349.
[36] [traduction] Ukiya M, Akihisa T, Tokuda H, et al. Effets inhibiteurs des glycosides de cucurbitane et autres triterpénoïdes du fruit de Momordica grosvenori sur Epstein-Barr Virus: early Antigène induit par tumeur Promoteur 12-o-tétradéanoylphorbol-13-acétate. J Agric Food Chem, 2002, 50(23): 6710-6715.
[37] [traduction] Wang L, L lLC, Fu YX, et al. Séparation, synthèse et cytotoxicité d’une série de dérivés mogrol. J Asian Nat Prod Res, 2019: 1-15.
[38] [traduction] Murata Y, Yoshikawa S, La SuzukiYA, et al. Caractéristiques de douceur of the triterpene glycosides in Siraitia grosvenori. J Jpn Soc Soc Food Sci Technol, 2006, 53(10): 527-533.
[39] [traduction] Takemoto T, Arihara S, Nakajima T, et al. Études sur la constituants De fructus Momordicae. I. La vie. On the sweet Principe. Yakugaku Zasshi, 1983, année de référenceannée de référence 103(11): 1151-1154.
[40] [traduction] Takemoto T, Arihara S, Nakajima T, et al. Etudes sur les constituants de fructusMomordicae.II. Les droits de l’homme Structure de la Sapogénine. Yakugaku Zasshi, 1983, 103(11): 1155-1166.
[41] [traduction] Takemoto T, Arihara S, Nakajima T, et al. Études sur la constituants of fructus momordicae. III. Les droits de l’homme La Structure of mogrosides. Yakugaku Zasshi, 1983, 103(11): 1167-1173.
[42] [traduction] L lDP, Ikeda T, Huang YL, et al. Variation saisonnière des mogrosides dans les fruits de Lo Han Kuo (Siraitia grosvenori). J Nat Med, 2007, 61(3): 307-312.
[43] [traduction] Itkin M, Heinig U, Tzfadia O, et al. Biosynthèse des antinutritionnels alcaloïdes in solanacées Les cultures Est médiatisé by regroupés Gènes. La Science, 2013, 341(6142): 175-179.
[44] [traduction] Harrison (S). — (en) Monsieur le président, M.d. The biosynthèse of Triterpénoïdes, stéroïdes et caroténoïdes. Nat Prod Rep, 1990, 7(6): 459-484.
[45] [traduction] Lange (pse). - (de) Monsieur le président, chers collègues, BM, Ahkami A. métabolique ingénierie De la plante Monoterpènes, sesquiterpènes Et diterpenes-current État d’avancement and Le futur Opportunités. planteBiotechnol J, 2013, 11(2): 169-196.
[46] [traduction] Le Bouvier F, Rahier A, Camara Camara B. Les droits de l’homme Biogenèse, moléculaire réglementation and fonction of Isoprénoïdes végétaux. Prog Lipid Res, 2005, 44(6): 357-429.
[47] [traduction] Liao P, Hemmerlin A, Bach TJ, et al. Le potentiel de la voie du mévalonate pour une production accrue d’isoprénoïde. Biotechnol Adv, 2016, 34(5): 697-713.
[48] [traduction] Laule: O, Femon emon holz A, Chang ChangChangChang HS, et al. Crosstalk entre cytosolique and plastifié Les voies d’accès De l’isoprénoïde biosynthèse in Arabidopsis Thaliana. Proc Natl Acad Sci USA, 2003, 100(11): 6866-6871.
[49] [traduction] Shibuya M, Adachi S, Ebizuka Y. Cucurbitadienol synthase, La première enzyme engagée pour la biosynthèse de la cucurbitacine, est une enzyme distincte du cycloartenol synthase pour phytostérol Biosynthèse. Tetrahedron, 2004, 60(33): 6995-7003.
[50] Zhang JS, Dai LH, Le Yang JG, et al. oxydation De cucurbitadienol catalysé by CYP87D18 in La biosynthèse des mogrosides de Siraitia grosvenorii. Plant cellulePhysiol,2016, 57(5): 1000-1007.
[51] [traduction] Lee JH, Weickmann JL, Koduri RK, et Al. Expression of synthetic thaumatin gènes in La levure. Biochemistry, 1988, 27(14): 5101-5107.
[52] [traduction] Daniell: S, Mellits KH,Faus I, et al. Replier le goût sucré protein thaumatin II - les droits de l’homme À partir de Inclusion insoluble Les corps synthétisé in Escherichia Les coli. Food Chem, 2000, 71(1): 105-110.
[53] [traduction] Masuda - Masuda T, Kitabatake N ° de catalogue Les développements En biotechnologique production of sweet Protéines. J Biosci Bioeng, 2006, 102(5): 375-389.
[54] [traduction] Ceunen S, Geuns JMC. Glycosides de stéviol: diversité chimique, Le métabolisme, and Fonction. J Nat Prod, 2013, 76(6): 1201-1228.
[55] [traduction] Wang JF, Li Si, oui, À propos de nous ZQ, et al. Intégration par voie minée de parties d’enzymes critiques pour la biosynthèse de novo de l’édulcorant stéviol glycosides chez Escherichia coli. Cell Res, 2016, 26(2): 258-261.
[56] [traduction] Olsson K, À propos de Carlsen S, Semmler A, et al. Production microbienne of Nouvelle génération La stévia Les édulcorants. Microb Cell Fact, 2016, 15: 207.
[57] Xu: GJ, Cai L, l, À propos de Gao L, l, et al. A Nouvelle glucuronosyltransférase has an Une capacité sans précédent to catalyse En continu Glucuronosylation en deux étapes of glycyrrhétorique acide to Rendement glycyrrhizin. New Phytol, 2016, 212(1): 123-135.
[58] Li C, Zhao YJ, Le Feng XD, et al. Application De glycosyl transferase in glycyrrhizic acide Synthèse: CN, 110106222. Du 8 au 09 septembre 2019
[59] [traduction] Liu JD, Zhang WP, Du GC, et al. Surproduction de géraniol by amélioré précurseur approvisionnement Dans les Saccharomyces Cerevisiae. J Biotechnologies, 2013, 168(4): 446-451.
[60] [traduction] Jean monnet J., Kuzina V, M. Andersen SB, et Al. Moléculaire Activités, biosynthèse and évolution De triterpénoïde Saponines. Phytochemistry, 2011, 72(6): 435-457.
[61] [traduction] Guo HH,oh! Li RF, Liu SB, et al. Caractérisation moléculaire, Expression, and réglementation De Gynostemma pentaphyllum squalènegène époxidase
1. Plant Physiol Biochem, 2016, 109: 230-239.
[62] [traduction] Rasbery JM, Shan H,LeClair RJ, et al. Arabidopsis thaliana squalene l’époxidase 1 is essentiel Pour le développement des racines et des semences. J Le BiolChem, 2007, 282(23): 17002-17013.
[63] [traduction] Yu YuYu Y, Chang Le PC, Yu H, et al. productif Synthases amyrines for efficient α-amyrin synthèse En ingénierie Saccharomyces Cerevisiae. C c Synth Biol,2018, 7(10): 2391-2402.
[64] Wang Eh bien, Année: T, Han H, et al. Le clonage Et caractérisation of oxydosqualène cyclasse De Kalanchoe daigremontiana: enzymes Catalyseur jusqu’à 10 réarrangement étapes rendement La ville de friedelin Et autres Triterpénoïdes. J Biol Chem, 2010, 285(39): 29703-29712.
[65] [traduction] À propos de nous Z, Zhou PP, Su BM, et al. Production améliorée d’isoprène by reconstruction De métabolisme Équilibre entre renforcé précurseur approvisionnement Et amélioré l’isoprène synthase in Saccharomyces Cerevisiae.ACS Synth Biol, 2018, 7(9): 2308-2316.
[66] [traduction] Paramasivan K, Mutturi S. la régénération du NADPH associée à l’activité de la HMG-CoA réductase augmente le squalène synthesis in Saccharomyces cerevisiae. J Agric Food Chem, 2017, 65(37): 8162-8170.
[67] [traduction] Ro DK, Paradise EM, Ouellet M, et al. Production de l’acide artémisinique précurseur du médicament antipaludique dans la levure fabriquée. Nature, 2006, 440(7086): 940-943.
[68] [traduction] Nelson JA, Steckbeck SR, Spencer TA. Biosynthèse de 24, 25-epoxycholestérol À partir de Squalène 2,3; 22,23-dioxyde. J Biol Chem, 1981, p. 1. 256(3): 1067-1068.
[69] [traduction] Boutaud O, Dolis: Fr, fr, it, nl schüber F. Le travail Cyclization préférentielle of 2,3(S):22(S), 23-dioxidosqualène Par mammalian 2,3-oxidosqualène-lanosterol Cyclase. Accueil» Biochem Les Biophys Res Commun, 1992, année de référence 188(2): 898-904.
[70] [traduction] Godio RP, Les Fouces R, Pour en savoir plus, veuillez consulter le site web suivant. JF. A Squalène époxidase is impliqués in biosynthèse Des deux Le composé antitumoral acide clavarique et stérols dans le basidiomycète H. Sublateritium. Chem Biol, 2007, 14(12): 1334-1346.
[71] [traduction] Suzuki H, l’achneuf L, Xu R, et al. A Approche génomique to the early stages De triterpène Biosynthèse de la saponine chez Medicago truncatula. Plant J, 2002, 32(6): 1033-1048.
[72] Zhao H, Guo J, Tang Q, et al. Le clonage Et expression analysis of squalene l’époxidase Gènes de Siraitia grosvenorii. Chine J Chin Mater Med, 2018, 43(16): 3255-3262
[73] [traduction] A propos de nous Le savoirfaire, Chang CH, Liu YT, et Al. Saccharomyces cerevisiae oxidosqualène-lanosterol Cyclasse: Une chimie-biologie interdisciplinaire étude of Les protéines de structure-fonctionne-réaction Relations de mécanisme. Chem Rec., 2008, 8(5): 302-325.
[74] Dai LH, Liu C, Zhu Mon, et al. Caractérisation fonctionnelle of cucurbitadienol synthase Et triterpène La glycosyltransférase involved En biosynthèse of mogrosides À partir de Siraitia grosvenorii. Plant Cell Physiol, En 2015, 56(6): 1172-1182.
[75] [traduction] Han JY, Kim HJ, Kwon YS, et al. The Le Cyt Enzyme P450 CYP716A47 catalyse the formation De protopanaxadiol du dammarenediol-II pendant le ginsénoside biosynthèse in «Panax» Le ginseng. Plant Cell Physiol, 2011, 52(12): 2062-2073.
[76] [traduction] Caputi L, Malnoy M, Goremykin V, et al. Une reconstruction phylogénétique de la famille à l’échelle du génome
1 udp-glycosyltransférases a révélé l’expansion de la famille lors de l’adaptation des plantes à la vie sur terre. Plant J, 2012, 69(6): 1030-1042.
[77] Tang Q, Ma XJ, Mo CM, et al. Une approche efficace pour trouver Siraitia grosvenorii Triterpène biosynthétique gènes by RNA-seq and numérique Analyse d’expression génique. BMC Genomics, 2011, 12: 343.
[78] Li SL, Wang D, Liu Y, et al. Etude de la synthèse efficace hétérologue du cucurbitadienol. Chine J Chin Mater Med, 2017, 42(17): 3326-3331.
[79] en savoir plus [79] À propos de nous Y, Rivero-Huguet Moi, Hughes (S), rapporteur. — (en) Monsieur le président, BH, BH, et Al. Isolement of the sweet composants À partir de Siraitia grosvenorii. Food Chem, 2008, 107(3): 1022-1028.
[80] [traduction] Wang L, Yang ZM, Lu Lu FL, et al. Glycosides de Cucurbitane dérivé from mogroside IIE: structure-goût Les relations, antioxydant L’activité, et aiguë Toxicité. Molécules, 2014, 19(8): 12676-12689.
[81] [traduction] Liu LQ, Liu H, Zhang W, et al. ingénierie La biosynthèse of La caféine acid in Saccharomyces cerevisiae avec des combinaisons enzymatiques hétérologues. Engineering, 2019, 5(2): 287-295.
[82] [traduction] Srinivasan P, Smolke (en anglais) CD. Ingénierie Une biosynthèse microbienne plateforme for de novo production Des alcaloïdes tropane. Nat Commun, 2019, 10: 3634.
[83] [traduction] Chen HF, Zhu CY, Zhu MZ et al. Haute production de valencene in Saccharomyces cerevisiae Grâce à l’ingénierie métabolique. Microb Cell fait, 2019, 18: 195.
[84] [traduction] Wang RF, Zhao SJ, Wang ZT, et al. Les progrès récents dans modulaire La co-culture ingénierie for synthesis De naturel Produits. Curr Opin Biotechnol, 2020, 62: 65-71.
[85] [traduction] Li Eh bien, Wang XN, Zhang M. le président équilibrage La voie de biosynthèse non linéaire de l’acide rosmarinique par modulaire co-culture Ingénierie. Accueil» Metab En, fr, 2019, 54: 1-11.


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




