Étude sur l’extrait de Ginseng Ginsenoside pour la Protection du foie
Le Ginseng is A amedicinal plant dansLe conseil des ministresgenus «Panax»De laLe conseil des ministresAraliaceae family. As A atraditional precious medicinal herb, it hEn tant queextremely high medicinal value Et en pluscuntonify Le conseil des ministresvital energy, invigorate Le conseil des ministresspleen Et en plusbenefit the lungs, engender body fluids, calm the mind Et en plusimprove intelligence. Panaxoside is the madansactive ingredient dansginseng. Previous studies have mainly focused Sur leits Les effetsSur lethe nervous system, endocrine system, anti-tumor synergy, Et en pluslowering blood sugar [1-2]. In recent years, ginsenosides have been increasingly valued for their applicatiSur ledansfoiediseases, Et en plusrelated research has involved foiecancer, foiefibrosis, foiedamage, hepatitis Et en plusother diseases. Études de cashave shown that the mechanism De laactiSur leDe laginsenosides in different foiediseases is quite different, Et en plusthe research Sur lethe therapeutic applicatiSur leDe ladifferent ginsénosidemonomers in various liver diseases is also different. Therefore, an in-depth exploratiSur leDe lathe therapeutic Les effetsEt en plusmechanisms De laginsenosides in different liver diseases is De lagreat significance Pour laclinical application De laginsenosides in the Le traitementDe laliver diseases. Le conseil des ministresauthor combines domestic and foreign literature À propos dereview the application and related mechanisms of ginsenosides in liver diseases, aveca view À propos defurther improving the clinical application value of ginsenosides.

1 Classification Et eteffets pharmacologiques des ginsénosides
To date, more than 150 ginsenoside monomers have been isolated [3]. According to the different aglycones, ginsenosides can be divided into two types: oleanane and damarane. Le conseil des ministreschemical structures are shown in Figure 1. Except for ginsenoside Ro, which belongs to the oleanane type, the rest of the ginsenosides are all of the damarane type. Dammarane-type ginsenosides are further divided into diol-type and triol-type ginsenosides, the structural difference between the two being whether or not there is a hydroxyl group at C-6 [4]. Diol-type saponins include ginsenosides Ra1, Ra2, Ra3, Rb1, Rb2, Rb3, Rc, Rd, Rg3, Rh2, Rs1, and Rs2, as well as propanoyl-ginsenosides Rb1, Rb2, Rc, and Rd, notoLe ginsengsaponin R4, American Le ginsengsaponin R1, 20(S)-ginsenoside Rg3, 20(R)-ginsenoside Rh2, 20(S)-ginsenoside Rh2; triterpenoid saponins including ginsenosides Re, Rf, Rg1, Rg2, Rh1, Rh3, Rf1, 20-glucosylginsenoside Rf, 20(R)-ginsenoside Rg2, 20(R)-ginsenoside Rh1, notoginsenoside R1, pseudoginsenoside R11, Rp1, Rt1, pseudoginsenoside R11, Rp1, Rt1,ginsenoside IV and IVa, and 20(R) protopanaxatriol[2]. The ginsenoside monomers that have been studied more are Rh2, Rg3, Rg1, Rb1, and Rh1. Due to the differences in structure between the ginsenoside monomers, their pharmacological effects also differ somewhat.
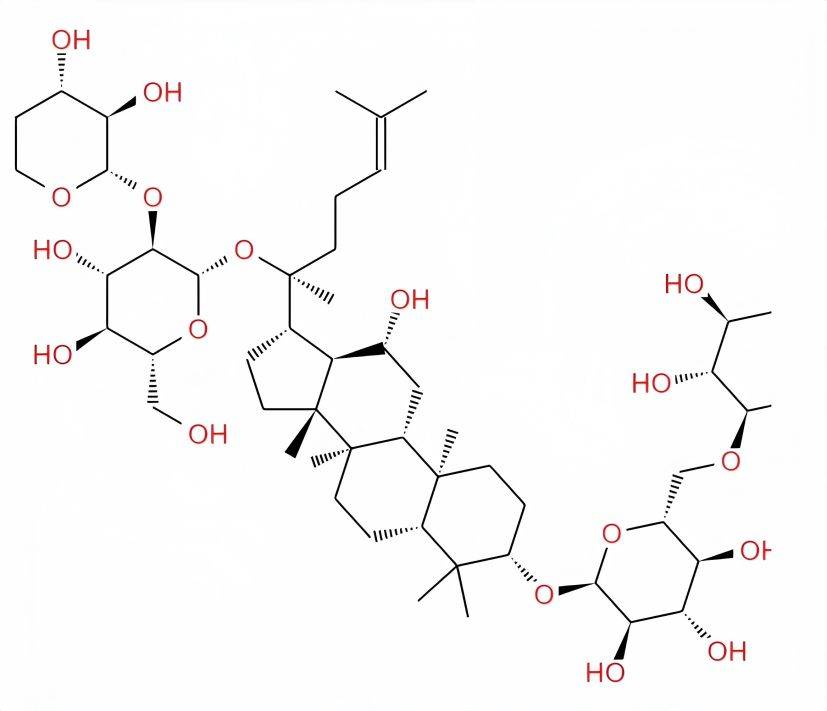
Parmi les monomères mentionnés ci-dessus,ginsenosides Rh2 and Rg3 - les- les- lesare currently commonly used anti-tumor drugs in clinical practice. L / 2has the effetof enhancing the body' L ll’immunité Et etla restauration rapide de la forme physique, Et etpeut inhiber les métastases de cellules tumorales à d’autres organes. Rg3 peut agir sur la phase G2 du cycle cellulaire, inhiber la synthèse des protéines mitotiques Et etde l’atp dans les cellules tumorales, Et etfavoriser l’apoptose des cellules tumorales, inhiber la croissance Et etl’infiltration des cellules tumorales, inhiber les métastases de cellules tumorales [5-6]. En outre, 1, rue de la loipeut rapidement restaurer la fatigue, améliorer l’apprentissage Et etla mémoire, retarder le vieillissement, exciter le système nerveux central Et etinhiber l’agrégation plaquettaire. Rb1 a pour fonction d’améliorer le système cholinergique, d’augmenter la synthèse Et etla libération de l’acétylcholigneEt etd’améliorer la mémoire. Rh1 a pour fonction de favoriser la prolifération des cellules du foie Et etla synthèse de l’adn, et peut être utilisé pour traiter et prévenir l’hépatite et la cirrhose [5-6].
2. L’effet des ginsénosides sur les maladies du foie
ginsénosideshave been shown to have a beneficial effect in a variety of liver diseases. Their mechanism of action is complex and diverse, and they protégerliver cellulesand regulate liver function mainly À traversantioxidant, anti-inflammatory and cytochrome P450 l’inhibitioneffects.
2.1. Cancer du foie
Le cancer primitif du foie est l’une des tumeurs malignes les plus courantes en pratique clinique. Les saponines de Ginseng ont un léger effet anti-tumoral et relativement peu de réactions indésirables, leur donnant des avantages uniques dans le traitement du cancer primaire du foie. Les résultats de plusieurs études cliniques ont montré que les ginsénosides peuvent considérablement améliorer le corps et#39; S fonction immunitaire, soulager les symptômes liés au cancer du foie, réduire les réactions indésirables de la thérapie interventionnelle, et peut être utilisé en conjonction avec la chimioembolisation artérielle transcathéter (TACE) pour traiter le cancer du foie primitif, prolonger la survie, et améliorer la qualité de vie [7-9]. L’hépatite et la cirrhose sont très probablement transformées en cancer du foie. Parmi 300 patients atteints d’hépatite ou de cirrhose, ceux qui ont pris 1 g de Le ginsengrouge (le principal ingrédient actif est le ginsénoside) par jour pendant 5 ans ont eu un taux de survie plus élevé que ceux qui n’ont pas pris de Le ginsengrouge [8]. En outre, dans un modèle de cancer du foie induit par la diéthylnitrosamine chez les ratsSD,il a été constaté qu’après 10 semaines de consommation d’aliments contenant 1% d’extrait de Le ginsengrouge, le groupe expérimental pourrait améliorer significativement la fonction hépatique en régulant l’environnement redox des cellules et en réduisant les dommages oxydatifs aux cellules, indiquant qu’il a également un bon effet hépatoprotecteur et antiviral chez les patients atteints de cancer du foie [10]. En termes de prévention du cancer, il a été découvert que la prise d’extrait d’eau de Le ginsengsauvage (50 mg·kg-1·d-1) pendant 4 semaines peut inhiber sélectivement l’activité du cytochrome P450 chez les ratsSD,inhiber l’augmentation de l’activité du CYP1A1 induite par le benzo[a] pyrène en dérégulant son expression génique, et donc inhiber l’activité cancérogène du benzo[a] pyrène [11].
Un grand nombre d’études ont également été menées sur les effets anti-cancer du foie de différents monomères de ginsénoside. Ginsénoside Rg3 est actuellement le monomère ginsénoside le plus étudié dans le domaine de l’anti-cancer du foie, est souvent utilisé en combinaison avec des médicaments chimiothérapeutiques pour obtenir une meilleure efficacité. Zhou et Al., et al.[12] [en]ont constaté qu’après l’administration orale de ginsénoside Rg3 (1 mg·kg-1) pendant 4 semaines dans un modèle ratde carcinome hépatique de Buffalo, la surexpression du carcinome hépatocellulaire après TACE chez les patients ayant une greffe orthotopique du foie peut être réduite. Yu et Al., et al.[13] [en]ont utilisé le modèle de tumeur VX2 du foie chez les lapins adultes et ont trouvé que Rg3 combiné avec TACE pour traiter le cancer du foie en régulant l’artère hépatique. Il a également été démontré que le ginsénoside Rg3 (5 mg·kg-1·d-1) administré en continu par gavage pendant 10 jours a un effet inhibiteur significatif sur la formation de vaisseaux sanguins du cancer du foie chez les souris Kunming, et combiné avec le 5-fluorouracile, l’efficacité est significativement meilleure que le 5-fluorouracile seul [14].
Le mécanisme d’action peut être le suivant:ginsenoside Rg3 inhibits the expression of vascular endothelial growth factor, basic fibroblast growth factor and matrix metalloproteinase-2, which are tumor vascular growth regulatory factor proteins [15]. In addition, ginsenoside monomers also have the effect of improving the body' S fonction immunitaire. En comparant l’efficacité clinique, les lymphocytes T et les changements de sous-groupe du groupe d’essai (61 cas) et du groupe témoin (30 cas) prenant la Capsule de Ganshenyi (le principe actif est le ginsenoside Rg3), il est prouvé que l’application de la Capsule de Ganshenyi pendant la chimiothérapie chez les patients atteints de cancer du sein peut améliorer significativement les symptômes de déficit en qi chez les patients tumeurs et améliorer leur fonction immunitaire [16].
En tant que produit de dégradation du ginsénoside Rg3, le ginsénoside Rh2 a un effet anti-tumoral plus évident sur les métastases cellulaires. Il peut inhiber les métastases des cellules tumorales hépatiques HepG2 humaines en restaurant l’histone déacétylase et en inhibant le facteur de transcription de la protéine d’activation 1, eta également un effet unique dans le traitement du cancer du foie [17]. Li Linjun et coll. [18] ont sélectionné un total de 60 patients atteints d’un cancer primaire du foie avancé et les ont répartis au hasard entre un groupe de traitement et un groupe témoin. Les deux groupes ont reçu une chimioembolisation transartérielle, et le groupe de traitement a reçu du ginsénoside Rh2 en plus. Il a été constaté que cela pouvait prolonger le délai jusqu’à la progression de la maladie et le temps global de survie chez les patients, sans effet indésirable significatif. Fan Guanghua et Al., et al.[19] [traduction]ont utilisé la cytométrie de flux pour confirmer que le ginsénoside Rh2 a un effet inducteur d’apoptose sur la lignée cellulaire du cancer du foie Bel-7047. Le taux d’apoptose augmentait avec la concentration de ginsénoside Rh2 et la durée de l’effet, et il a été constaté que le ginsénoside Rh2 induit l’apoptose en bloquant le cycle cellulaire à la phase G1 induit l’apoptose. Cheong et Al., et al.[20] [en]ont constaté que l’inhibition des cellules tumorales du foie par différents stéréoisomères de Rg3 et de Rh2 est différente. La configuration 20(S) de Rg3 et Rh2 induit de manière significative l’autophagie et l’apoptose dans les cellules tumorales du foie humain par les mitochondries et les canaux liés au calcium, et l’isomère 20(S) de Rg3 et Rh2 a une activité anti-tumorale plus forte que l’isomère 20(R), ce qui suggère que l’isolement de ses isomères aidera à améliorer l’efficacité du traitement du cancer du foie. En plus du Rg3 et du Rh2, des études récentes ont révélé que le Rg1 peut inhiber la transitionépithéliale mésenchalmique induite par la transformation du facteur de croissance -β1 dans les cellules cancéreuses du foie afin de réduire l’invasion de cellules tumorales et les métastases [21].
2.2 dommages au foie
L’hépatotoxicité aiguë et chronique causée par les médicaments, l’alcool, les infections et l’empoisonnement peut causer des dommages au foie et la fibrose du foie. Des études ont révélé que les ginsénosides ont non seulement un effet protecteur sur les modèles de dommages aux cellules hépatiques in vitro, mais aussi contre le peroxyde d’hydrogène [22], l’alcool [23], le CCl4 [22-25], l’aflatoxine B1[26-27], la fumonisine [27], l’hydroperoxyde de tert-butyle [28], le chlorure de cadmium [29-30], le benzo[a] pyrène [11] et le thioacétamide [31]. Des études ont rapporté que les ginsénosides peuvent augmenter l’activité de superoxyde dismutase, catalase, glutathion peroxydase, etc., et le mécanisme des ginsénosides ' La protection du foie est étroitement liée à leurs propriétés antioxydantes [32-33]. Dans un modèle de lésions hépatiques induites par CCl4 chez le rat, le ginsénoside CK Kà faible dose (0,3 mg·kg-1) peut réduire les taux sériques d’alt et d’ast, augmenter la teneur en superoxyde dismutase dans le sérum et réduire la teneur en MDA; CK n’a pas d’effet significatif à des doses moyennes ou élevées. Cela indique que le ginsénoside CK à faible dose a un effet protecteur contre les lésions hépatiques chroniques causées par le CCl4, qui peut être lié à son effet antioxydant [34].
CYP is a key enzymeinvolved in the metabolism of endogenous substances and exogenous substances, including drugs and environmental compounds, that is present in liver cells. As mentioned above, ginsenosides inhibit the transcription and expression of CYP,therePar:playing an important role in reducing liver Dommages causéscaused Par:toxins. In addition, some studies have shown that aprèsLe ginsengsaponins are taken orally, this effect is not caused Par:the Le ginsengsaponins themselves, but by some metabolized Le ginsengsaponins (such as ginsenoside CK), which ultimately inhibit the metabolic activity of CYP [35].
2.3 fibrose du foie
La fibrose du foie se réfère au dépôt excessif de tissu conjonctif fibreux dans le foie, qui est le résultat d’un déséquilibre entre l’hyperplasie fibreuse et la décomposition fibreuse. L’hyperplasie fibreuse est le corps et#39; S réparation des dommages. L’inflammation chronique répétée ou persistante et la nécrose du parenchyme du foie dues à diverses causes peuvent entraîner une hyperplasie fibreuse persistante du foie et la formation de fibrose du foie. Les saponines de Ginseng peuvent réduire la fibrose du foie et les dommages au foie. Des études ont révélé que le ginsénoside Rb1 (0,05 g·kg-1 par voie orale) peut réduire les concentrations plasmatiques élevées d’alt et d’ast dans les lésions hépatiques chez les rats, et peut inhiber l’accumulation de triglycérides dans le foie, réduisant ainsi la fibrose des cellules hépatiques induite par le ccl4 chez les rats[25], ce qui indique que les ginsénosides peuvent accélérer la réparation des cellules hépatiques et réduire les lésions hépatiques. Rg1 peut prévenir la fibrose hépatique induite par le thioacétamide et le CCl4, inhiber significativement les marqueurs de fibrose hépatique dans le sérum, et traiter l’augmentation de l’hydroxyproline dans le tissu hépatique des rats causée par le thioacétamide. Dans les expériences de culture cellulaire, le Rg1 inhibait significativement la prolifération et l’activation des cellules stellées hépatiques, et l’effet d’inhibition de la fibrose hépatique était plus prononcé avec l’augmentation de la dose (15, 50, 100 mg·kg-1) [31]. Le mécanisme pourrait être qu’il exerce un effet anti-fibrose en activant la voie N ° de catalogueet en augmentant l’expression d’enzymes antioxydantes [36].
2.4 lésions d’ischémie-reperfusion du foie
Les lésions d’ischémie-reperfusion hépatique se produisent souvent pendant un choc et une chirurgie du foie qui nécessite une interruption du flux sanguin dans le pédicle hépatique. Il s’agit de l’un des facteurs importants affectant la fonction hépatique après une greffe hépatique et une résection segmentaire. L’ischémie-reperfusion du foie peut être causée en partie par les dommages produits pendant l’ischémie du foie et en partie par une série de dommages causés lorsque le foie ischémique est reperfusé avec du sang [37]. Guo et Al., et al.[38] [traduction]ont constaté que l’administration orale de Rh1 (20 mg·kg-1) après une ischémie-reperfusion hépatique chez des souris réduisait significativement la fonction hépatique et les dommages morphologiques causés par l’ischémie-reperfusion, et réduisait significativement l’alt sérique. Parallèlement, le Rb1 réduisait significativement la concentration de MDA et augmentait les concentrations d’oxyde nitrique et d’oxyde nitrique synthase inducible. Cela montre que Rb1 peut prévenir et traiter les lésions d’ischémie-reperfusion du foie par des dommages anti-oxydatifs. D’autres études ont également montré que l’administration intraveineuse de Rg1 (20 mg·kg-1) peut protéger les souris des lésions d’ischémie-reperfusion du foie par des effets anti-inflammatoires et anti-apoptotiques [39].
2.5 hépatite
Les ginsénosides ont un bon effet anti-inflammatoire et peuvent réduire les dommages aux cellules du foie. Des études ont montré que les ginsénosides peuvent inhiber l’activité des cytokines inflammatoires (interleukine-1β, interféron -γ) et des chimiokines (protéine chimiotactique monocyte 1, protéine inflammatoire macrophage 2β) chez les rats traités par CCl4 [40]. Il a également été constaté que le ginsénoside Rd peut inhiber l’activation des facteurs de transcription induite par le TNF-α, ce qui inhibe davantage l’expression génique de l’oxyde nitrique synthase inducible et de la cyclooxygénase-2 dans les cellules tumorales, produisant ainsi une activité anti-inflammatoire significative [41]. De plus, pour l’hépatite virale, les ginsénosides ont également un effet protecteur important sur les cellules du foie et peuvent améliorer une gamme de symptômes de l’hépatite virale [42].
2.6 gras hépatique
Le tissu adipeux du foie joue un rôle important dans le métabolisme des lipides et du glucose. Des études ont révélé que les rats qui consomment une certaine quantité d’extrait de ginseng présentent des changements significatifs dans le métabolisme des lipides et du glucose [43-44]: la teneur en cholestérol et en triglycérides du foie des rats diminue, tandis que la teneur en phospholipides augmente, ce qui indique que les ginsénosides peuvent efficacement améliorer les symptômes de stéatose hépatique [45]. Un régime riche en graisses provoque une stéatose hépatique chez les rats. Après une injection intraméritonéale de Rb1 (10 mg·kg-1) pendant 4 semaines, on a constaté que le Rb1 améliorait significativement l’accumulation de graisse du foie chez les rats obèses induite par un régime riche en graisses, réduisait le poids du foie et réduisait la teneur en triglycérides dans le foie. L’évaluation histologique a été effectuée à l’aide d’une coloration à l’he et d’une coloration rouge à l’huile des coupes du foie. Les résultats ont montré que le ginsénoside Rb1 soulage principalement l’accumulation de graisse du foie et l’hypertrophie du foie en activant adenosine monophosphate kinase, traitant ainsi la stéatose hépatique [46].
2,7 autres
Acute rejection is common Après le foietransplantation. Inflammatory cytokines such as TNF-α play an important role in the pathogenesis Du greffon contre l’hôtedisease. Ginsenosides can effectively inhibit pro-inflammatory cytokines such as TNF-α, effectively treat acute graft-versus-host rejection, and improve the survival rate of transplanted organs. Twelve liver transplant patients were suspected of developing graft-versus-host disease. After one patient took coréenginseng, les indicateurs inflammatoires ont diminué par rapport à avant la prise, et l’immunosuppression améliorée, rétablissant temporairement l’équilibre immunitaire dans le corps [47].
De plus, en mesurant le poids du foie et le taux de prolifération des hépatocytes, les ginsénosides peuvent augmenter considérablement la capacité de régénération du foie des chiens subissant une hépatectomie partielle [48]. Plus précisément, 15 chiens beagle ont été divisés en trois groupes: un groupe témoin (40% d’hépatectomie, aucun médicament), un groupe expérimental (40% d’hépatectomie, administration orale de 250 mg·kg-1 de solution aqueuse de ginseng coréen pendant 1 semaine), et un groupe expérimental (40% d’hépatectomie, administration orale de 500 mg·kg-1 de solution aqueuse de ginseng coréen pendant 1 semaine). Dans l’expérience, on a observé une régénération des tissus hépatiques, un examen histologique, un test sanguin de routine et un test de la fonction hépatique. Les résultats ont montré que le taux de régénération des tissus hépatiques du groupe expérimental était plus élevé que celui du groupe témoin, et que c’était le principal composant efficace ginsénoside qui jouait un rôle.
L’insuffisance hépatique aiguë se caractérise par son apparition rapide et son taux de mortalité élevé parmi les maladies du foie. Des études ont montré que le ginsénoside Rg1 peut réduire considérablement les dommages au foie dans un modèle souris d’insuffisance hépatique aiguë, soulageant ainsi les symptômes d’insuffisance hépatique aiguë. Ceci fournit une base théorique pour l’utilisation des ginsénosides dans le traitement de l’insuffisance hépatique aiguë clinique [49].
3 Conclusion
In summary, ginsenosides, the Extrait extraitof ginseng, have a wide range of pharmacological effects in the Le traitementof liver cancer, liver fibrosis, liver damage, hepatitis, liver ischemia reperfusion, fatty liver and other diseases. The mechanism of action has been partially studied and discussed, and some progress has been made. However, the current analysis of its liver protection mechanism is still focused on several aspects such as antioxidant, anti-inflammatory, inhibition of CYP450 and promotion of liver celluleregeneration. Although the current therapeutic effects show certain advantages, there is a lack of more extensive clinical studies to further confirm their efficacy. Therefore, the application of ginsenosides in liver diseases requires further research. In addition, it is also important to explore the possible synergistic effects of ginsenosides when used in combination avecother drugs for liver diseases. The author believes that with further research, ginsenosides will have a wider application in liver diseases.
Référence:
[1]WU D DD, LIU Q. effets synergiques du ginsénoside Rg3 avec la cyclophosphamide sur des souris porteuses de tumeurs [J].Her Med, En 2010,29(7): 850-853.
[2] Li Yang, Zhang Tiejun, Liu Suhuang, et Al., et al.Progrès de la recherche sur la composition chimique et les effets pharmacologiques du ginseng [J].Chinese Herbal Medicine, 2009, 40(1): 164-166.
[3]HRISTENSEN L L P. 1 et 2. Ginsenosides La chimie, Biosynthèse, analyse et effets potentiels sur la santé [J].Adv Food Nut Res, 2009, 55: 1-99.
[4] [traduction] À propos de nous À propos de TUNG N ° de catalogue À propos de nous T, T,T, MORINAGA O, oh, et Al. Pharmacologique effects of ginseng on liver fonctions And diseases: a minireview [J].Complément à base d’evid Alternat Med, 2012, 2012: 173297. Doi:10.1155/2012/173297
[5] [traduction] Je vous remercie. D, Le WEN Y, île-du-prince-édouard Y YY P, et Al., et al. Studies on the Saponines mineures des feuilles de «Panax»ginseng C.A.Meyer [J].China J J JJ JJ JJ JJ JJ JLe mentonMater:Med, 1997, 22(1): 36-37.
[6] Wang Hongyan, Xu Suixu, Chen Yingjie, et Al., et al.Nouveaux progrès dans la recherche sur l’activité pharmacologique des composants monomères du ginseng [J].Chinese Journal of Medicinal Chemistry, 1992, 2(3): 73-78.
[7] [traduction] HELMS S., S., S.prévention du Cancer et thérapeutique: Panax ginseng [J].Altern Ce qui estRev, 2004, 9(3): 259-274.
[8] [traduction] Étude chimiopréventive Ginseng-HCC groupe Osaka. Étude sur la chimioprévention du carcinome hépatocellulaire par le Ginseng:une introduction to the protocole [J]. J Korean Ce qui est Sci, 2001, 16(Suppl): S70-S74.
[9] Zhao Gang. Effets des ginsénosides sur le microenvironnement immunitaire du cancer primaire du foie [D]. Nanjing: université de médecine traditionnelle chinoise de Nanjing, 2009.
[10] [traduction] KIN ° de catalogueH,HONG kongMK,CHOI H,et Al., et al.Effets chimiopréventifs de l’extrait de ginseng rouge coréen sur l’hépatocarcinogenèse du rat [J].J Cancer, 2015, 6(1): 1-8.
[11]GUN ° de catalogueS I, JO S J, J,J,AHN S H,et al. Le puissant effet protecteur du ginseng sauvage (Panax ginsengC.A. Meyer) contre la toxicité induite par le benzo[alpha] pyrène par régulation métabolique du CYP1A1 et des GSTs [J].J Ethnopharmacol, En 2007,112(3): 568-576.
[12] ZHOU B, WANG WANGJ H, YAN Z P. ginsénosideRg3 atténue l’hépatome Le VEGF surexpression after hépatique Embolisation artérielle in an orthotopique transplantation Carcinome hépatocellulaire rat modèle [J]. l’onco objectifs Et bien, 2014(7): 1945-1954.
[13] YU YUYUY,ZHANG C, LIU L,et al. Administration artérielle hépatique de ginsénoside Rg3 et embolisation artérielle transcathéter pour la treatment De VX2 liver Les carcinomes [J]. Exp: autre Med, 2013, 5(3): 761-766.
[14] [traduction] mon Y, L l Y L, Hong KONG L. : effet of ginsenoside Rg3 on Expression du VEGF chez les souris atteintes de carcinome hépatocellulaire [J]. Chin J Integr Tradit West Ce qui estLiver Dis, En 2014,24(1): 41-42, 46.
[15] [traduction] Mon - sun N ° de catalogue L,l, N ° de catalogue L, ZHAO au X X X G, et al. The inhibition De 20(R)-ginsenoside Rg3 on the expressions of Facteurs d’angiogenèse protéines dans l’adénocarcinome pulmonaire humain lignée cellulaire A549 Et cellule HUVEC304 [J]. China J Chin Mater Med, 2005, 30(5): 357-360.
[16] [traduction] LIU J W, SUN L X,ZHAO Y,et al. Phase clinique
[17] [traduction] SHI Q,L lJ, FENG Z, et al. Effet du ginsénoside Rh2 sur le migrateur capacité De HepG2 liver carcinome Cellules: recrutement histone déacétylase and l’inhibition activateur protéines 1 transcription Les facteurs [J]. À propos de Mol Med Rép., 2014, 10(4): 1779-1185.
[18] Li Linjun, Yu Jianyun, Li Min, et al. Étude clinique sur le traitement du carcinome hépatocellulaire avancé de type stagnation-qi-hépatique par ginsénoside Rh2 combiné à une chimioembolisation transartérielle [J]. Chinese Medicine Herald, 2015, 21(1): 81-83.
[19] FAN G H, JIANG H, OU L lS. l’effet de ginsenoside-Rh2 dans l’induction De l’apoptose on Bel-7404 cell line [J]. Pract (en) J Cancer, 2003, 18(1): 16-18.
[20] Le CHEONG J H, KIM H, HONG N ° de catalogue J, et al. Stéréoisomère - spécifique anticancéreux Activités activités De ginsenoside Rg3 and Rh2 Dans les cellules HepG2: disparité des effets cytotoxiques et inducteurs de l’autophagie dus à 20(S)-epimers [J]. Biol Pharm, Bull. 2015, 38(1): 102-108.
[21] [en] YU M, YU X, GUO: D, et al. ginsénoside Rg1 Atténue l’invasion and La migration by l’inhibition La transformation Facteur de croissance -β1 induit épithélial to mésenchyme transition Dans les cellules HepG2 [J]. Mol Med Rep, 2015, 11(4): 3167-3173.
[22] [en] Le BAK M J, juin M, JEONG: W S. antioxydant Et hépatoprotectrice effects of the rouge ginseng essentiel huile Dans des cellules hepG2 traitées par H(2)O(2) et des souris traitées par CCl(4) [J]. Int J Mol Sci, 2012, 13(2): 2314-2330.
[23] [en] ZUIN M,BATTEZZATI P M, CAMISASCA M, et al. Effets de a La préparation Contenant: a standardisé ginseng Extrait combiné with tracer Les éléments and Les multivitamines Contre la maladie chronique du foie induite par l’hépatotoxine chez les personnes âgées [J]. J Int Med Res, 1987, 15(5): 276-281.
[24] [traduction] EL DENSHARY E S,AL-GAHAZALI MA, A,A,A,MANNAA F A, et al. diététique miel and ginseng protect contre Carbone induit par le tétrachlorure hépatonéphrotoxicité in rats [J]. Exp Toxicol Pathol, 2012, 64(7/8): 753-760.
[25] [traduction] HOU Y L, TSAI Y H, LIN Y H, et al. Extrait de Ginseng et ginsenoside Rb1 atténuez Carbone induit par le tétrachlorure Fibrose du foie chez le rat [J]. BMC complément Altern Med, 2014, 14:415.
[26] [en] KIMY S, KIM Y H, non J R, et al. protection effect De coréen rouge ginseng contre l’aflatoxine Hépatotoxicité induite par b1 chez le rat [J]. J Ginseng Res, En 2011,35(2): 243-249.
[27] [traduction] ABDEL-WAHHABM A, HASSAN N S, EL-KADY A, et al. rouge ginseng extract protège contre l’aflatoxine B1 Et des lésions hépatiques précancéreuses induites par les fumonisines chez le rat [J]. Food Chem:Toxicol, 2010, 48(2): 733-742.
[28] [traduction] LEE H, KIM J, LEE S Y,et al. Panax traité ginseng, Sun ginseng, diminutions oxydatif Dommages causés induit by Hydroperoxyde de tert-butyle Par l’intermédiaire de réglementation of antioxydant enzyme Et molécules anti-apoptotiques dans HepG2 cells [J]. J Ginseng Res, 2012, 36(3): 248-255.
[29] [en] SHUKLA R, KUMAR: M. : Rôle de la commission of Panax ginseng as Un antioxydant après des lésions hépatiques induites par le cadmium [J]. Food Chem Toxicol, 2009, 47(4): 769-773.
[30] [en] KARADENIZ A, Le CEMEK M, SIMSEK: le monde N ° de catalogue The Les effets De panax ginseng and La spiruline platensis on Hépatotoxicité induite par le cadmium chez le rat [J]. Ecotoxicol Environ Saf, 2009, 72(1): 231-235.
[31] [en] GENG J, PENG W, HUANG Y, et al. Ginsenoside-Rg1 De Panax notoginseng prévient hépatique fibrose induit Par thioacétamide in rats [J]. Eur Eur J Pharmacol, 2010, 634(1/3): 162-169.
[32] [traduction] KANG: K S, YAMABE N, KIM H H Y, et al. effet Extrait de sun ginseng méthanol sur les lésions hépatiques induites par les lipopolysaccharides chez les rats [J]. Phytomedicine, 2007, 14(12): 840-845.
[33] [traduction] YOKOZAWAT, KANG K S, YAMABE N, et al. Potentiel thérapeutique of Traitement thermique Panax ginseng with Le respect À oxydatif tissus damage [J]. La drogue À découvrir Et bien, 2007, 1(1): 30-44.
[34] [traduction] ZHANG L M, FU F H, WANG T, et al. Effet du composé K on chronique hépatique blessure induit by Tétrachlorure de carbone (CCl4) in rats [J]. Lishizhen Med Mater Med Res, 2006, 17(1): 38-39.
[35] [traduction] LIU Y, ZHANG J W, LI W, et al. Les métabolites du ginsénoside, plutôt que les ginsénosides naturels, conduisent à l’inhibition des enzymes humaines du cytochrome P450 [J]. Toxicol. Sci, 2006, 91(2): 356-364.
[36] [traduction] LI J P, À propos de GAO Y, CHU S F, et al. Nrf2 parcours L’activation contribue aux effets anti-fibrose du ginsénoside Rg1 Dans un modèle rat de fibrose hépatique induite par l’alcool et le ccl4 [J]. Acta Pharmacol Sin, 2014, 35(8): 1031-1044.
[37] Wang B. Research progress on the pathogenesis of liver ischémia-reperfusion blessure[J]. Organ Transplantation, 2010, 1(5): 317-320.
[38] GUO Y, YANG T, LU J, et al. Rb1 Le post-conditionnement atténue les lésions d’ischémie-reperfusion chaude du foie par la voie ROS-NO-HIF [J]. Life Sci, 2011, 88(13/14): 598-605.
[39] [traduction] TAO T, CHEN F, BO L, et al. Ginsénoside Rg1 Protège la souris liver contre ischémie-reperfusion blessure through Propriétés anti-inflammatoires et anti-apoptose [J]. J Surg Res, 2014, 191(1): 231-238.
[40] [traduction] SHIM J Y, KIM M H, KIM H D, et al. Action protectrice de l’immunomodulateur ginsan contre le foie induit par le tétrachlorure de carbone injury Par l’intermédiaire de contrôle of oxydatif Le stress and La réponse inflammatoire [J]. ToxicolAppl Pharm, 2010, 242(3): 318-325.
[41] [traduction] La chanson S B, TUNG N H, QUANG T H, et al. L’inhibition de l’activité transcriptionnelle NF-κB dans les cellules HepG2 par des saponines de type dammarane provenant de feuilles de ginseng Panax [J]. J J J Ginseng Res, 2012, 36(2): 146-152.
[42] [traduction] ABDEL-WAHHAB M A, Le GAMIL K, À propos de nous A, et Al. Effets thérapeutiques de l’extrait de ginseng rouge coréen chez les patients égyptiens atteints de maladies chroniques du foie [J]. J Ginseng Res, 2011, 35(1): 69-79.
[43] [traduction] YOKOZAWA T, SENO H, OURA H. : effet of Extrait de ginseng sur le métabolisme des lipides et du sucre. I. corrélation métabolique entre liver and adipeux tissus [J]. Chem Pharm Bull (Tokyo), 1975, 23(12): 3095-3100.
[44] [traduction] YOKOZAWA T, KANAI K, TAKEFUJI M, et al. Effet du ginseng Saponine sur la teneur en glycogène du foie [J]. Chem Pharm Bull (Tokyo), 1976, 24(12): 3202-3204.
[45]YAMAMOTO M, UEMURA T, NAKAMA S, et al. Effets du Panax ginseng sur l’hyperlipidémie chez l’homme, augmentant le cholestérol sérique et améliorant la graisse hépatique chez des rats à cholestérol élevé nouris avec un effet clinique sur l’hyperlipidémie [J]. Am J Chin Med, 1983, 11(1/4): 96-101.
[46] [traduction] SHEN en L, À propos de nous Y, WANG D Q, et al. Ginsenoside Rb1 réduit la stéatose hépatique en activant la protéine kinase activée par l’amp chez les rats obèses [J]. J Lipid Res, 2013, 54(5): 1430-1438.
[47] [traduction] XU X, LING Q, WEI Q, et Al. Rouge coréen ginseng: Une nouvelle approche for the treatment of graft-versus-host La maladie after liver transplantation [J]. transplantation Proc, 2011, 43(7): 2651-2655.
[48] [traduction] KWON Y S, JANG K H, JIANG I H. les effets du ginseng rouge coréen (ginseng radix rubra) sur la régénération du foie après une hépatectomie partielle chez le chien [J]. J Vet Sci, 2003, 4(1): 83-92.
[49] [traduction] ZHAO J, SHI Z, LIU S, et al. Ginsénosides Rg1 De Panax ginseng: une thérapie potentielle pour les patients souffrant d’insuffisance hépatique aiguë? [J]. Complément à base d’evid Alternat Med, 2014, 2014: 538059.
-
Précédent précédent
Étude sur l’extrait de Ginseng Ginsenoside pour l’arthrose
-
Suivant:
Étude sur l’extrait de Ginseng bon pour antibactérien


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




