Étude sur le ginsénoside Rare Rg1 Rb1
Ginseng («Panax»Ginseng C....... A. Meyer) is a perennial herb dansLe conseil des ministresfamily Araliaceae Et en plusis a traditional precious Chinese medicine. ginsénosidesare one De laLe conseil des ministresmadansactive ingredients De laginseng. They belong to the group De latriterpenoid glycosides Et en plusare formed Par:the condensatiSur leDe laa sugar Et en plusa glycoside precursor. Studies have shown that ginsénosideshave a variety De lapharmacological effects [1-3]. After oral administration, most protopanaxadiol-type ginsénosidesare hydrolyzed by intestinal flora to ginsénosideC-K, Rg3, L / 2and PPD D[4-5], and protopanaxatriol-type ginsenosides are mainly degraded to ginsenoside F1 and 20(S)-PPT[6- 7]. The metabolite C-K De laprotopanaxadiol-type ginsenosides has significant antitumor activity in vitro and in vivo, and sonactivity is enhanced compared to the precursor[8]. Rg1, Re and 20(S)-PPT have a strong anti-tumor cellulemetastasis effect after oral administration, while only 20(S)-PPT has an anti-tumor effect when administered intravenously, indicating that the anti-tumor metastasis effect of Rg1 and Re after oral administratiSur leis produced by their metabolite 20(S)-PPT [9].
Un grand nombre d’études ont montré que le ginsénoside est déglucosylé par les bactéries intestinales pour produire des ginsénosides rares avec deux ou des liaisons glycosidiques simples, qui ont une activité biologique plus forte [10].

La La Biotransformationpeut modifier la structure chimique des ginsénosides, améliorer efficacement l’utilisation in vivo des ginsénosides, optimiser l’efficacité clinique du médicament Et etréduire les effets indésirables [11]. La La biotransformationdes ginsénosides comprend des changements dans la glycosylation, l’hydroxylation Et etles liaisons doubles. La glycosylation des ginsénosides se produit principalement aux niveaux C-3, C-6 Et etC-21, y compris l’hydrolyse Et etla glycosylation des glycosides; Certaines transformations se produisent également sur les chaînes latérales C-3, C-12 Et etC-17, reliant les groupes méthyle et les groupes hydroxyle; La modification des doubles liaisons implique principalement l’addition ou l’oxydation de la double liaison C-24/C-25. Cet article passe en revue le développement de la biotransformation microbienne des ginsénosides rares au cours des dernières années, les changements structurels du noyau parent et l’applicationde ses dérivés, avec l’espoir de fournir une base théorique pour la recherche structurelle et l’application des ginsénosides et de leurs dérivés.
1 Structure et application de ginsénosides rares
1.1 Structure des ginsénosides rares
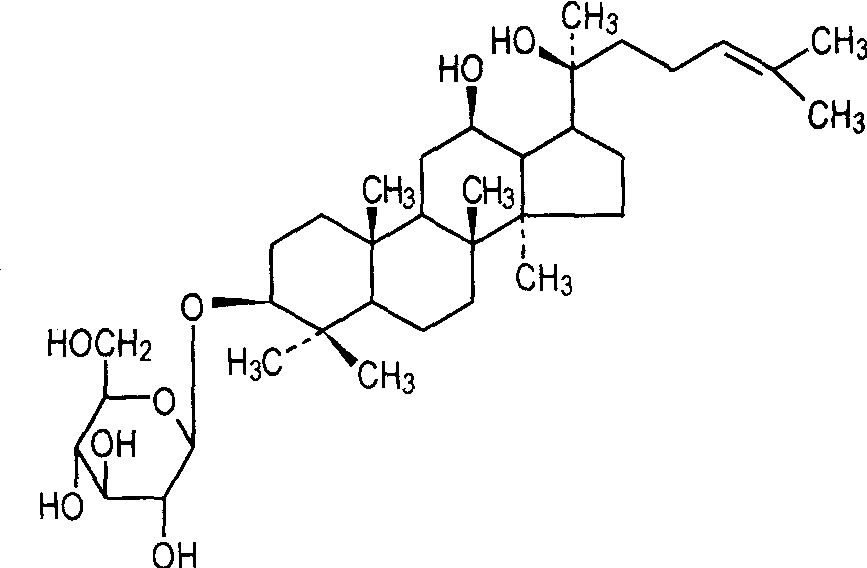
Les ginsénosides sont divisés en triterpénoïdes tétracycliques et en triterpénoïdes pentacycliques selon la structure de l’aglycone. Les ginsénosides de type protopanaxadiol (Figure 1a) et les ginsénosides de type protopanaxatriol (Figure 1b) sont tous deux des ginsénosides triterpénoïdes tétracycliques de type dammarane, les saponines de type Oxytirone (Figure 1c) sont un type de saponine triterpénique tétracyclique avec une chaîne latérale contenant un anneau de furane; Les saponines de type oléanane dont le noyau d’origine est l’acide oléanolique appartiennent aux saponines pentacycliques triterpéniques (Figure 1).
Le nom de "ginsénosides rares" est dérivé du fait qu’ils sont naturellement présents en quantités faibles ou presque inexistantes. Les ginsénosides rares sont principalement des saponines de type damascane, avec pas plus de trois groupes de sucre attachés aux positions C-3, C-6 et C-20 de l’aglycone, et pas plus de deux groupes de sucre attachés à une seule position. Les ginsénosides rares sont principalement obtenus par déglycosylation ou déshydratation des ginsénosides. Actuellement, les principaux ginsénosides rares identifiés sont Rg3, Rg1, Rh1, Rh2, Rh3, RT3, F1, F2, C-K, PPD,PPT, etc., comme le montre le tableau 1.
1.2 Application de saponines rares au ginseng
Rare Rareginseng saponins are mainly found in red ginseng and black ginseng, and are the basis of the physiological activity of red ginseng and black ginseng, which is different À partir dethat of ginseng. Poudre de Ginseng and ginseng tablets sold on the market only grind the raw materials (ginseng, American ginseng, etc.) from which ginseng saponins are extracted Dans lepowder, or add excipients and then press into tablets. Ginseng saponin tablets and capsules only extract the total ginsenosides from the medicinal herb, without further separation or transformation. This directly extracted ginsenoside needs to be broken down by specific enzymes before it can be absorbed by the body. However, these enzymes are either rare or absent in the human body. This results in low bioavailability and weak pharmacological effects in the human body.
À l’heure actuelle, la plupart des rares préparations de ginsénoside en Chine contiennent les composants monomères Rh2 ou Rg3. Les préparations contenant un seul type de ginsénoside monomère sont indiquées dans le tableau 2.
Common rare ginsenosides such as ginsenoside C-K, Rg3 and Rh2 have been used in clinical applications to improve the body' L lsanté immunitaire ou en association avec d’autres médicaments pour un traitement adjuvant. Pendant ce temps, la recherche d’application des ginsénosides rares est toujours une partie importante du développement du ginsénoside. En utilisant le 20(R) -ginsénoside comme matière première, les chercheurs ont synthétisé un nouveau dérivé du glycinate de ginsénoside par une réaction d’estérification entre la position C-3 et la tert-butoxycarbonylglycine. Et a déterminé que l’activité anti-tumorale de ce dérivé est plus de 100 fois celle du 20(R) -ginsénoside (ci50 >30 mmol/L). L’effet inhibiteur in vivo de l’a11 est plus significatif que celui du 20(R) -ginsénoside (P< 0,01). En même temps, A11 inhibe la prolifération, la migration et l’invasion des cellules HeLa et favorise l’apoptose [12]. Le ginsénoside Rg4 est un ginsénoside rare présent dans les feuilles de ginseng et le ginseng noir. Le Rg4 inhibe l’inflammation et présente des effets protecteurs contre la sepsis induite par la CLP [13]. Rg5 forme un complexe stable avec le récepteur purinergique humain 12 (P2RY12) par des interactions allostérique, réduisant son activité via les résidus E188 et R265, entraînant une diminution de la libération d’interleukine (IL)-6, IL-1β et le facteur de nécrose tumorale -α dans le plasma sanguin, améliorant la réponse inflammatoire tout en inhibant la formation de thrombi veineux [14]. Le ginsénoside Rk1 est anti-tumorale [15], régule la glycémie [16-17], protège le système nerveux [18-19] et, lorsqu’il est utilisé en combinaison avec le ginsénoside Rk5, favorise la différenciation et la croissance de l’ostéoblaste en augmentant l’activité de la phosphatase alcaline, ce qui traite l’ostéoporose [20]. Au fur et à mesure que la recherche progresse, on découvrira davantage d’activités biologiques des ginsénosides rares et de leurs dérivés.

2 état de la recherche sur la biotransformation des ginsénosides rares
Les principales méthodes de transformation du ginsénoside sont la transformation chimique et la biotransformation. La transformation chimique utilise principalement des réactions telles que l’hydrolyse acidobasique des liaisons glycosidiques, l’addition oxydative et l’acétylation pour changer les substituants. La Biotransformation utilise des cellules microbiennes pour modifier la structure de substrats exogènes, et utilise une ou plusieurs enzymes produites au cours du métabolisme pour catalyser des réactions sur des parties (groupes) spécifiques du substrat, augmentant ainsi la teneur et les propriétés médicinales des ingrédients actifs [21]. Les méthodes de Bioconversion comprennent la transformation bactérienne, la transformation de la flore intestinale, la transformation fongique et la catalyse enzymatique in vitro, qui compensent les lacunes des méthodes de transformation chimique, telles que les conditions de réaction drastiques, la pollution de l’environnement et la La productionde sous-produits. Ils sont largement utilisés dans la recherche et la production. Les principaux types de réaction de biotransformation comprennent les réactions d’hydrolyse du glycoside et les réactions redox [22], parmi lesquelles les réactions d’hydrolyse du glycoside sont les plus largement utilisées [23]. Ces dernières années, la réaction d’addition aux positions C-24 et C-25 a également été progressivement appliquée dans la production pratique.
2.1 hydrolyse Glycoside des rares saponines au ginseng
2.1.1 hydrolyse du glycoside microbien des saponines de ginseng
The metabolic pathway of ginseng saponins in vivo is an Important:part of the research on the structure-activity relationship of ginseng saponins. Stepwise deglycosylation is the main metabolic pathway of ginseng saponins in vivo. The rare ginseng saponins and aglycones produced by metabolism have significant pharmacological effects in the body. The main transformation products of ginsenoside Rd were found to be F2, Rg3, C-K, Rh2 and PPD; the main transformation products of ginsenoside F2 were C-K and PPD; the main transformation products of ginsenoside Rg3 are Rh2 and PPD[24]; and C-K and Rh2 can be converted to PPD[25]. Through the analysis of the transformation products of protopanaxatriol-type saponins Re, Rg1, Rh1, Rf, F1 and R1 in the human intestinal flora, their metabolites and transformation pathways were determined i.e., the conversion pathway of ginsenoside Re is Re →Rg1/Rg2 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rg1 is Rg1 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rf is Rf→Rh1 →PPT; and the metabolic pathway of notoginsenoside R1 is R1 →Rg1/Rg2 →Rh 1 →PPT[26].
La voie métabolique du ginsénoside Rb1par les bactéries intestinales in vitro est un processus de déglucosylation, et l’hydrolyse du ginsénoside Rb1 par les bactéries intestinales in vitro est également un processus de déglucosylation par étapes [27]. Il en va de même pour le métabolisme du ginsénoside par les bactéries intestinales in vivo. GUO et Al., et al.[28] ont utilisé des antibiotiques à large spectre pour construire un modèle de rats sans germes et ont vérifié la conversion des saponines de notoginseng (1,535 g/kg) par le microbiote intestinal chez les rats. Les résultats ont montré que les quatre métabolites ginsénoside F1, Rh2, C-K et PPT ont été détectés dans le plasma des rats exempts de germes, mais pas dans le plasma des rats porteurs de germes. Par conséquent, on en déduit que la loi fondamentale du métabolisme du ginsénoside in vivo est le tétraglycoside → trisaccharide → disaccharide → monosaccharide → aglycone.
Il existe de nombreux types d’enzymes présents dans les micro-organismes, qui ont le potentiel de convertir les glycosides [29]. En même temps, les sucres éliminés après la fermentation peuvent être utilisés comme source de carbone pour la croissance et la reproduction fongiques, ce qui permet de se métaboliser pour produire plus d’enzymes [30]. Par conséquent, différents microorganismes peuvent être utilisés comme biocatalyseurs pour jouer un rôle important dans la biotransformation de produits naturels. Des chercheurs canadiens et étrangers ont utilisé des bactéries et des champignons pour mener des recherches sur la biotransformation des ginsénosides (Figure 2).
Des études ont montré que certains champignons et bactéries tels que Aspergillus Niger, Fusarium sp., Penicillium sp., Cordyceps sinensis et Armillaria mellea, Bifidobacterium breve, Bacillus sp., Lactococcus lactis et Lactobacillus plantarum sub sp., Terrabacter sp., Cellulosimicrobium cellulans sp., Et Thermotoga thermarum peut métaboliser les groupes de sucre du ginsénoside C-3 ou C-20 pour produire des ginsénosides ou aglycones rares (tableau 3). Aspergillus Niger peut métaboliser le ginsénoside Rb1 et Rb3 en ginsénosides Rd, F2 et C-K, respectivement [31, 38]; Il peut également hydrolyser le 3-O-Glc des ginsénosides Rb2 et Rc d’abord, puis hydrolyser le 20-O-Ara pour produire une voie d’hydrolyse unique: Rb2 → C-O → C-Y → C-K, Rc → C-Mc1 → C-Mc → C-K, et principalement par la voie de Rb3 → C-Mx1 → C-Mx → C-K pour hydrolyser le 3-O-Glc de Rb3, et hydrolyse lentement Rb3 20-O-Xly par la voie Rb3 → Rd → F2 → CK [38]. Le Penicillium hydrolyse les ginsénosides et les monomères ginsénosides par la voie Rb1 → Rd → F2 → C-K, produisant des ginsénosides rares [32-33,52]; Fusarium convertit les saponines totales de ginsenoside en rares ginsenoside C-K par fermentation [47]; Bifidobacterium fermentum peut convertir le ginsenoside F2 en ginsenoside C-K [39]; Bacillus subtilis hydrolyse les positions C-3 et C-20 du ginsénoside Rb1 aux positions C-3 et C-20 de l’aglycone, respectivement, pour générer des ginsénosides Rd, Rg3[39] et Gyp-x
In recent years, edible fungi have also been used in the study of the glycosidase hydrolysis of ginseng saponins. For example, Cordyceps militaris can convert ginseng saponin Rb1 to the rare ginseng saponin F2, with the conversion pathway being Rb1→Rd→F2 [44]. The honey ring fungus can convert ginsenoside Rb2 into the rare ginsenosides C-Y and C-K, with the conversion pathway being Rb2→C-Y→C-K [45]. This is the first time in the literature that a basidiomycete has been used to convert ginsenoside Rb2 into the rare ginsenoside C-K.
La transformation microbienne a ses propres avantages uniques. Les conditions de réaction sont douces, et comparées aux méthodes de transformation physique et chimique, il ne nécessite pas de températures et de pressions élevées, ce qui réduit les coûts. Pendant la réaction, presque aucun réactif organique n’est utilisé, ce qui peut assurer l’activité des ginsénosides dans la plus grande mesure. Les enzymes sécrétées par les micro-organismes peuvent se décomposer et consommer des impuretés telles que les sucres et les protéines, augmenter la concentration de ginsénosides et augmenter le taux de conversion. La méthode de conversion microbienne a une grande efficacité d’utilisation des matières premières et une grande efficacité de conversion, ce qui non seulement permet d’économiser des matières premières, mais augmente également la production [46].
2.1.2 hydrolyse enzymatique du groupe sucrier des ginsénosides
La spécificité de la conversion microbienne est inférieure à celle de la conversion enzymatique directe, de sorte que l’activité de la glycosidase doit être ajustée pour limiter la production de sous-produits et améliorer la spécificité de la conversion.
Les saponines présentent des différences structurelles et une diversité fonctionnelle. La structure de la saponine de Ginseng comprend 1 à 4 liaisons glycosidiques. Les groupes de sucre courants comprennent le β-glucose, le L-arabinose, le D-xylose et la L-rhamnose, qui nécessitent l’action synergique de différentes enzymes pour réaliser la bioconversion. Les enzymes courantes comprennent la glucosidase, la mannosidase, l’arabinosidase et la xylosidase, qui sont principalement isolées et purifiées à partir de micro-organismes ou d’animaux et de plantes. Dans l’étude de la conversion enzymatique des ginsénosides, les chercheurs ont d’abord utilisé des enzymes produites par des microorganismes naturels pour hydrolyser les liaisons glycosidiques des ginsénosides. Par exemple, l’utilisation de Monascus purpureus, qui peut produire de la β-glucosidase extracellulairement, pour fermenter les ginsénosides a permis une augmentation de 2,3 fois de la fraction massique de Rg3 dans les ginsénosides [57]. À mesure que la recherche progressait, les chercheurs ont extrait de la β-glucosidase relativement pure de champignons, d’animaux et de plantes pour hydrolyser les ginsénosides. Jin et Al., et al.[58] ont utilisé la β-glucosidase pour convertir les ginsénosides Rb1, Rb2, Rc et Rd qui ont été convertis en la rare saponine Rh2 à l’aide de la β-glucosidase. Cependant, les enzymes isolées de microorganismes et d’animaux et de plantes sont pour la plupart des enzymes mixtes, difficiles à convertir de manière ciblée et comportant de nombreux produits de réaction secondaire, ce qui augmente la difficulté d’isoler et de purifier les produits de conversion.
Avec le développement de la biologie moléculaire et de la technologie de génie génétique, l’utilisation de la technologie de recombinaison génétique pour construire des bactéries génétiquement modifiées pour effectuer la glycosylation des saponines de ginseng est un moyen efficace d’améliorer l’efficacité de conversion. Escherichia coli et les cellules de levure, en tant qu’hôtes d’expression matures, sont souvent utilisées comme vecteurs d’expression préférés pour les protéines enzymatiques biologiques recombinantes. L’introduction du gène de la glycosyltransférase dans la cellule vecteur produit efficacement le ginsénoside Rh2 [59]. Ces dernières années, le gène de la xylosidase xln-DT d’une bactérie thermophile a été recombiné dans le plasmide pET-20b en aval du peptide signal pelB à l’aide de la technologie d’épissage génétique. Le plasmide recombinant pelB-xln-DT a été transformé en hôte d’expression E. coli E. coli BL21 (DE3), et l’enzyme a été utilisée comme catalyseur pour hydrolyser la liaison glycosidique de la saponine de notoginseng R1. Et produit avec succès ginsenoside Rg1[44]. Jeon et Al., et al.ont utilisé la glucosidase recombinante (MT619) pour convertir le ginsénoside Re, et la voie de conversion était Re →Rg1 →F1 →MT1[60]. MT1 est un nouveau ginsénoside de type PTT. Le gène codant pour la β-glucosidase de deux souches de bacille a été cloné et fortement exprimé dans E. coli BL21 (DE3). Utiliser l’extrait brut de BL21 (DE3) pour hydrolyser le ginsénoside Rb1 pour produire le ginsénoside F2[40]; L’enzyme recombinante exprimée en tandem dans E. coli est de plus grande pureté et peut convertir des ginsénosides de type PPP en le rare ginsénoside Rh2(S)[61].
Actuellement, la plupart des études utilisent une seule enzyme pour convertir les ginsénosides. Par conséquent, les études futures peuvent utiliser la technologie de recombinaison génétique pour exprimer des enzymes ayant des fonctions différentes chez le même hôte. Grâce à l’effet synergique de différentes enzymes, l’objectif de produire des ginsénosides rares et leurs dérivés qui répondent à des besoins spécifiques peut être atteint, améliorant ainsi le taux d’utilisation des ressources de ginseng.
2.2 modification microbienne de la structure de l’aglycone des ginsénosides
La recherche sur la modification structurelle des aglycones de ginsénoside s’est principalement concentrée sur les ginsénosides de type PPP, et des dérivés tels que 25-OH-PPD et 25-OCH3-PPD ont été obtenus. Les méthodes de dérivation sont généralement des méthodes chimiques et physiques, et il y a eu peu d’études sur la modification de la structure de l’aglycone par des méthodes biologiques. Les principales méthodes qui ont été rapportées sont l’hydratation de la double liaison à la position C24-C25, chez le rat. La principale voie métabolique du 20S-dammar-24-en-2α, 3β, 12β, 20-tétrol (GP) observée est l’oxydation de la liaison 24,25-double pour former le 24,25-époxyde, suivie par l’hydrolyse et le réarrangement pour former le 20,24-époxyde (Figure 3) [62]. Les chercheurs ont utilisé la co-culture de saponines de ginseng et de Cordyceps militaris pour convertir le ginsénoside Rg1 en 25-OH-(S/R)-Rh1 et le panaxoside R1 en 25-OH-20(S/R)-R2. La teneur en dérivés 25-OH dans les produits de conversion est beaucoup plus élevée que celle du ginsénoside Rh1 et du panaxoside R2, ce qui facilite l’isolement et la purification du dérivant [63-64]. En utilisant Mucor spinosus en co-culture avec 20(S)-protopanaxatriol, six dérivés ont été obtenus. Les résultats de l’étude ont prouvé que les dérivés de ginsénoside produits par déshydrogénation à la position C-12 suivie d’une hydroxylation à la position C-7 ou C-11 et d’une carbonylation à la position C-15, ainsi que par un réarrangement de double liaison à la position C-26, ont une activité inhibiteur importante contre les cellules cancéreuses [65].
Selon des recherches nationales et étrangères, il est spéculé que ce pourrait être le système biocatalytique le plus efficace pour l’hydroxylation sélective régionale des ginsénosides. Des études expérimentales ont révélé que ces dérivés exercent des effets différents in vivo et in vitro par différents mécanismes, et que leur activité biologique est plus élevée que celle des ginsénosides communs [66]. Par exemple, le Rb1 subisse une réaction de déshydrogénation pour former le dihydroginsénoside Dg-Rb1, qui peut réparer les neurones endommagés sans affecter les paramètres systémiques, et la dose efficace de Dg-Rb1 est 10 fois inférieure à celle du Rb1 [67]. Le dérivé d’ester octyle Rh2-O du ginsénoside Rh2 a une activité anticancéreuse plus élevée que le Rh2 en activant la voie intrinsèque de l’apoptose [68]. Les dérivés acétyliques de la PPD ont une activité importante d’induction antiproliférative et apoptotique, et certains dérivés ont une activité anticancéreuse plus élevée que la PPD [69]. L’anneau pyrazine a été introduit dans 25-OH-PPD pour améliorer son activité antitumorale. La 2-Pyrazine-PPD peut inhiber de manière significative la prolifération des cellules cancéreuses gastriques et a peu de toxicité pour les cellules normales (lignée cellulaire épithéliale gastrique humaine GES-1) [70]. Le dérivé 25-OH-PPD de l’ aglycone PPD a une meilleure activité anticancéreuse que les médicaments existants sur le marché tels que le ginsénoside Rg3, le paclitaxel et l’acide aminolévulinique [71].
Par conséquent, tout en maintenant la structure active originale du ginsénoside, la structure aglycone du ginsénoside peut être modifiée en introduisant des groupes polaires et des groupes pharmacophore pour améliorer la solubilité dans l’eau, le ciblage et l’efficacité du ginsénoside, et améliorer la biodisponibilité du ginsénoside.
2.3 Glycosylation des ginsénosides
À partir de 2,3-oxidosqualene, laBiosynthèse des ginsénosidesPeut être divisé en trois étapes: 2,3-oxidosqualene cyclase (OSC) cyclizes 2,3-oxidosqualene; Les réactions d’hydroxylation et de glycosylation sont ensuite réalisées par cytochrome (Cyt) et glycosyltransférase (GT), produisant finalement des ginsénosides [72]. L’enzyme UGT est l’une des enzymes les plus critiques dans la synthèse des ginsénosides rares dans les organismes vivants [73] et est également la dernière étape de la biosynthèse des ginsénosides. Le gène UGT a été cloné à partir de Lactobacillus rhamnosus et exprimé dans E. coli BL21 (DE3). La protéine UGT recombinante peut convertir le Rh2 en deux nouveaux ginsénosides, le ginsénoside glucosylé Rh2 et le ginsénoside diglucosylé Rh2 [74].
Le triterpénoïde aglycon est catalysé par l’ugt pour former des ginsénosides avec des structures différentes. L’aglycon de protopanaxadiol est glycosylé aux positions C-3 et C-20, et l’aglycon de protopanaxatriol est glycosylé aux positions C-6 et C-20 [80]. La rare voie de glycosylation ginsénoside est illustrée à la Figure 4. La glycosyltransférase 73C5 (UGT 73C5) a été isolée chez Arabidopsis thaliana et ajoutée par étape à la PPD. Cette glycosyltransférase peut transférer sélectivement du glucose au groupe hydroxyle C-3 de la PPD pour synthétiser le ginsénoside Rh2, ce qui permet d’obtenir le plus grand rendement rapporté de ginsénoside Rh2 (3,2 mg/mL) [75]. La glycosyltransférase 74AE2 (UGT 74AE2) catalyse le transfert de glucose vers les groupes hydroxyle C-3 de PPD et C-K pour former Rh2 et F2, respectivement [76]. La glycosyltransférase 94Q2 (UGT 94Q2) peut transférer du glucose à Rh2 et F2 pour former respectivement Rg3 et Rd [77]. L’ugt51 est l’une des glycosyltransférases de Saccharomyces cerevisiae S288c [78], qui peut transférer du glucose dans le groupe hydroxyle C-3 de PPD pour former Rh2 [79]. Des recherches futures sur les UGTs pourraient fournir un aperçu du mécanisme de régulation de la glycosylation du ginsénoside et offrir de nouvelles façons de modifier la production de ginsénoside.
En tant que facteur catalyseur direct de la formation de ginsénosides, les ugt jouent un rôle vital dans la production de ginsénosides par biocatalyse. La plupart des ugt d’origine végétale ont une faible activité catalytique, tandis que les ugt microbiennes recombinantes ont des propriétés biocatalytiques spéciales, telles que la promiscuité du substrat et des niveaux élevés d’expression dans les cellules de substrat microbien, qui en font des outils efficaces pour la production de ginsénosides. Par conséquent, il est nécessaire d’améliorer l’activité catalytique des UGTs afin d’augmenter le rendement et la production des ginsénosides rares cibles.
3 Conclusion et perspectives
Studies have shown that rare ginsenosides have higher medicinal value....... En même temps, la faible solubilité dans l’eau et la faible teneur en ginsénosides rares ont limité leur application. L’hydrolyse ou la glycosylation des ginsénosides par des enzymes intracellulaires ou extracellulaires de différents micro-organismes convertis efficacement les ginsénosides polysacchride et les aglycones inactifs en ginsénosides rares, améliorant ainsi la biodisponibilité des ginsénosides.
Des études ont révélé que des changements dans certains groupes fonctionnels peuvent modifier la structure et les propriétés moléculaires, affectant ainsi la liaison des médicaments aux récepteurs et affectant l’efficacité. Par exemple, les groupes alkylés peuvent augmenter la solubilité lipidique d’un composé, réduire la dissociation, augmenter la stabilité et prolonger la durée d’action du médicament; Les groupes sulfhydryliques augmentent la solubilité des lipides et facilitent l’absorption des médicaments; Les liaisons amide peuvent facilement former des liaisons hydrogène avec des macromolécules biologiques et se lier aux récepteurs, montrant une spécificité structurelle spéciale; Et la rupture d’un groupe hydroxyle pour former une liaison hydrogène augmente la solubilité dans l’eau du composé, augmentant ainsi l’activité du médicament.

Compte tenu de la structure des ginsénosides, on pense que des réactions d’hydroxylation peuvent se produire aux positions C-2, C-11, C-15, C-24 et C-30 et peuvent subir des réactions d’hydroxylation; Les doubles liaisons carbone-carbone aux positions C-12 et C-13 peuvent subir des réactions d’addition et des réactions d’oxydation; En même temps, les ginsénosides de type diol peuvent être oxydés aux positions C-12 et C-24 pour former les ginsénosides de type oryctol. Par conséquent, sides enzymes pouvant modifier la structure des ginsénosides peuvent être trouvées par le cribage de différents microorganismes et enzymes, et que certains groupes peuvent être ajoutés ou éliminés en fonction de la structure active existante des ginsénosides rares, l’activité pharmacologique et le ciblage des ginsénosides peuvent être améliorés, et la biodisponibilité des ginsénosides peut être augmentée, fournissant une nouvelle direction pour la modification structurelle des ginsénosides.
At the same time, with the continuous development of technology in the fields of food, medicine, the continuous development of technology in the fields of food, medicine, and biochemistry, researchers can use genetics, molecular cytology, and other interdisciplinary integration, as well as high-throughput screening and genomics technology to select or design enzymes or strains with high selectivity and conversion rates. Biological means can be used to achieve the industrial production of highly active rare ginseng saponins and their derivatives, further increasing the yield of rare ginseng saponins and their highly active derivatives. This is of great significance pourmaking full use of ginseng resources for the benefit of the public.
Référence:
[1] [traduction] Jin Hee Kim, elle,Miseon Kim, Sun-Mi Yun et Al., et al.Le ginsénoside Rh2 induit l’apoptose et inhibe la transition épithélial-mésenchymateux dans les cellules cancéreuses de l’endomètre HEC1A Aet Ishikawa [J]. Biomédecine &; Pharmacothérapie,2017,96. 871-876.
[2] [traduction] Jiang Z, Yang Y, Yang Y, et Al., et al.Le ginsénoside Rg3 atténue la résistance au cisplatine dans le cancer du poumon en régulant la PD-L1 et en reprenant le système immunitaire [J]. Biomed. Pharm. 2017.96.378-383.
[3] [traduction] À propos de nous L, l, Guan Y. Ginsenosides in Cancer: A Point de mire on the réglementation of cellule Métabolisme. Biomed Pharmacother. 2022 10 octobre;156:113756. Doi: 10.1016/j.biopha.2022.113756.
[4] [traduction] Yu H, Wang WangY, Liu C, et Al., et al.Conversion du ginsénoside Rb1 en Six Types de ginsénoside Rg3 hautement bioactif et ses dérivés par catalyse FeCl3. Chem Pharm Bull (Tokyo). 2018;66(9):901-906.
[5] [traduction] Zhang J, J,Ai Z, Hu Y, et al. Impact remarquable de la stérilisation commerciale sur la transformation des ginsénosides dans la pulpe de ginseng fraîche basée sur une analyse métabolomique largement ciblée. Food Chem X. 2022 août 9;15:100415.
[6] [traduction] Hasegawa, Hideo,Sung, et al. Principaux métabolites de saponine de Ginseng formés par des bactéries intestinales. Planta Medica, 1998, 62(5), 453-457.
[7] [traduction] Hasegawa, Hideo, Sung, et al. Rôle de la Prevotella oris intestinale humaine dans l’hydrolyse du Ginseng Saponines. Planta Medica, 1997,63(5), 436-440.
[8]SHANGGUAN Lihua, LIU LIU Guoquan. Progrès de la recherche dans le métabolisme des composants du ginseng [J]. Chinese Traditional and Herbal Drugs, 1999(11):865-870.
[9] [traduction] Lee Lee Byung-Hoon, Lee, c’est moi, Sang-Jun Hui, et al. Activité antigénotoxique In vitro du nouveau Ginseng saponine métabolites formés par des bactéries intestinales. Planta Medica, 1998, 64(6), 500 -503.
[10] Yoshimasa Yamaguchi, Masaya - Masaya Higashi, le Maître, Hideshi Kobayashi. Les effets of ginsenosides on altéré La performance causé Byscopolamine chez le rat [J]. European Journal of Pharmacology, 1996, 312(2): 149-151.
[11] Kim WY, Kim JM, Han SB, et al. Le fait de cuire le ginseng à la vapeur à haute température améliore l’activité biologique [J]. J Nat Prod, 2000, 63(12):1702-1704.
[12] Guo HY, Xing Y, Sun YQ, et al. La présente invention concerne des dérivés de ginsengenine synthétiser à partir du 20(R)-panaxotriol: synthèse, caractérisation et activité antitumorale ciblant la voie HIF-1. J Ginseng Res. 2022 Nov;46(6):738-749.
[13] Kim GO, Kim N, Song GY, et al. Activité inhibitrice du ginsénoside Rg4 Rare sur la ligature des cèques et la Sepsis induite par la perforation. IntJ Mol Sci. 2022 16; 23(18):10836. Doi: 10.3390/ijms231810836.
[14] Chen Z, Wang G, Xie X et al. Le ginsénoside Rg5 interagit allostériquement avec le P2RY12 et améliore la thrombose veineuse profonde en combattant la nétose des neutrophiles et la réponse inflammatoire. Immunol avant. 2022 août 12;13:918476.
[15] LIU Yannan. Préparation du ginsénoside Rg5 et son activité anti-gastrique et cancer du sein [D]. Shaanxi: université du nord-ouest, 2019.
[16] DENG J J, LIU Y, DUAN Z G, et al. Le Protopanaxadiolet les saponines de type protopanaxatriol améliorent le métabolisme du glucose et des lipides dans le diabète sucré de type 2 chez les souris riches en matières grasses/induites par la streptozocine [J]. Avant Pharmacol,2017, 8: 506.
[17] MAENG Y S, MAHARJAN S, KIM J H, et al. Rk1, un ginsenoside, est un nouveau bloquant de la fuite vasculaire agissant par la structure d’actin remodelant [J], PLoS One, 2013, 8(7) : e68659.
[18] RYOO N, RAHMAN MA, HWANG H, et al. Le ginsénoside Rk1 est un nouvel inhibiteur des récepteurs NMDA dans des neurones hippocampiens cultivés chez le rat [J]. J Ginseng Res, 2020, 44 (3) :490-495.
[19] OH J M, LEE J, IM W T, et al. Le ginsénoside Rk1 induit l’apoptose dans les cellules du neuroblastome par la perte du potentiel de la membrane mitochondriale et l’activation des caspases[J]. Int J Mol Sci, 2019, 20(5) : 1213.
[20] SIDDIQI M H, SIDDIQI M Z, AHN S,et al. Effet stimulant des ginsénosides Rg5: Rk1 sur les cellules murines osteoblasticMC3T3-E1 [J]. Phytother Res, 2014, 28(10) : 1447-1455.
[21] Krishika Sambyal, Rahul Vikram Singh. Aspects de la Production de testostérone par biotransformation microbienne et perspectives d’avenir [J]. Stéroïdes, 2020, 159(C).
[22]NAN bo,YOU ying,WANG yushan, et al.progrès de la recherche sur la La Transformationmicrobienne des ginsénosides [J]. Food Research And Development, 2017, 38(14): 196-199
[23]ZHOU Zhong-liu, L lChun-Yan,CHEN Lin-hao1, et autres. Biotransformation du naturel Saponines [J]. Chinese Journal of Experimental Traditional Medical formules, 2019, 25(16): 173-192.
[24] M. J. H, Eun-Ah BAE, Min-Kyung, et al. Métabolisme du 20(S)- et du 20(R) -ginsénoside Rg3 par les bactéries intestinales humaines et sa Relation avec les activités biologiques in Vitro [J]. Biol. Pharm Bull, 2002, 25(1): 58-63.
[25] [traduction] Ont. Mingxin, LI Fangtong, ZHANG ZHANG yan, et al. Biotransformation of Rare Protopanaxadiol La saponine humain Microflore intestinale [J]. Journal chimique des universités chinoises, 2019, 40(07): 1390-1396.
[26] ZHANG yan, LI fangtong, HAN mingxin, et al.analyse des métabolites des saponines Protopanaxatriol dans la flore intestinale humaine par MS RRLC-Q-TOF et UPLC-QQQ [J]. Journal de la société chinoise de spectrométrie de masse, 2020, 41(01): 66-75.
[27] TANG lan1, FU lulu, SHEN liting, et al.dégradation des saponines totales du Panax notoginseng par la flore intestinale des rats in vitro[J]. Médicaments traditionnels et à base de plantes chinois, 2018, 49(02): 396-399.
[28] Guo Y P, Chen M Y, Shao L, et al. Quantification des métabolites des saponines de Panax notoginseng dans le plasma de rat avec biotransformation in vivo médiée par la microtransformation intestinale par HPLC-MS/MS[J]. Chinese Journal of Natural Medicines, 2019, 17(3): 231-240.
[29]CHEN sijian, WU dongxue, LIU suying et autres. Avances in chemical and biological transformation of ginsenoside[J] Chinese Traditional Patent Medicine,2022, 44(5): 1539-1545.
[30] WANG shanshan,HU ping,YU shaowen. Progrès de la recherche sur la biotransformation des produits naturels [J]. Chinese Journal of New Drugs, 2016, 25(1): 71-75.
[31]GAO juan, ZHOU andong, YUAN ye, et al. Dégradation enzymatique du ginsénoside Rb1 pour la préparation du composé K par Aspergillus Niger sp. J7[J]. Biotechnologie actuelle, 2016, 6(02): 98-104.
[32] Song X L, Wu H, Piao X C et al. Transformation microbienne de ginsénosides extraites de racines fortuites de ginseng Panax dans un bioréacteur aérien [J]. Electronic Journal of Biotechnology, 2017, 26:20-26.
[33] [traduction] Yan Q, Zhou W, Shi X L, et al. Voies de Biotransformation du ginsénoside Rb1 en composé K par β-glucosidases dans le champignon Paecilomyces Bainier sp. 229[J], Process Biochemistry, 2010, 45(9): 1550-1556.
[34] Hu Y B, Wang N, Yan X C, et al. Ginsenoside Re impacts sur les produits de biotransformation du Ginsenoside Rb1 par Cellulosimicrobium cellulans sp. 21 et ses mécanismes [J], Process Biochemistry, 2019, 77: 57-62.
[35] Jitendra Upadhyaya, Min-Ji Kim, Young-Hoi Kim et al. Formation enzymatique du compound-K à partir du ginsénoside Rb1 par préparation enzymatique à partir de culture de mycélie d’armillaria mellea[J]. Journal of Ginseng Research, 2016, 40(2): 105-112.
[36] Li Ling, Lee Soo Jin, Yuan Qiu Ping, et Al. Production de bioactifs Ginsénoside Rg3(S) et composé K utilisant Lactococcus lactis recombinant [J]. Journal of Ginseng Research, 2017, 42(4): 412-418.
[37] Hyojin Lee, Seung Il Ahn, Byung Wook Yang et autres. Biotransformation des ginsénosides par des bactéries lactiques dérivées d’eoyukjang dans le Ginseng cultivé en montagne [J]. Microbiology and Biotechnology Letters, 2019, 47(2): 201-210.
[38] Liu C Y, Zuo K Z, Yu H S et al. Préparation de ginsénosides mineures C-Mx et C-K à partir de ginsénosides feuilles notoginseng par une ginsenosidase spéciale de type i [J]. Process Biochemistry, 2015, 50(12): 2158-2167.
[39] Zhang R, Huang X M, Yan H J et al. Production hautement sélective du composé K à partir du ginsénoside Rd par hydrolyse du Glucose au Glycoside C-3 à l’aide de β-Glucosidase de Bifidobacterium breve ATCC 15700[J]. Journal de microbiologie et de biotechnologie, 2019, 29(3): 410-418.
[40] Almando Géraldi, N ° de catalogue Matuzahrohabet, Fatimahab, al. enzymatique biotransformation of ginsenoside Rb1 by β - glucosidase recombinante d’isolats bactériens d’Indonésie [J]. Biocatalysis et biotechnologie agricole. 2020, 23(C): 101449-101449.
[41] Li L, Lee S J,Yuan Q P et al. Production de ginsénoside bioactif Rg3(S) Et le composé K utilisant Lactococcus lactis recombinant [J]. Journal of Ginseng Research, 2017, 42(4): 412-418.
[42] Pei J J, Xie J C, Yin R, et al. Transformation enzymatique du ginsénoside Rb1 en ginsénoside 20(S)-Rg3 par GH3 β-glucosidase de Thermotogathermarum DSM 5069 T[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 113:104-109.
[43] Zhang S H, Xie J C, Zhao auL G. clonage, surexpression et caractérisation d’une thermostable β-xylosidase de Thermotoga Petrophila et transformation coopérée de l’extrait de ginsénoside en ginsénoside 20(S)-Rg3 avec un β-glucosidase[J]. Bioorganic Chemistry, 2019, 85:159-167.
[44]114-120. [LI Qi, qi, qi Tonneau à pince Xinyi, JIANG JIANG Yujie, et al. Construction of Entier entier cell catalyseur pelB-Xln-DT and its application Dans la biotransformation de Panax notoginsénoside R1[J]. Journal of Forestry Engineering, 2020, 5(04): 114-120.
[45] Min-Ji Kim, Jitendra Upadh ya ya, Min-SunYoon, et autres. Biotransformation hautement régiosélective du ginsénoside Rb2 en composé Y et en composé K par β-glycosidase purifiée d’armillaria mellea mycelia[J]. Journal of Ginseng Research. 2017, 42(4) : 504-511.
[46]ZHONG yating. Dépistage du Ginseng La saponine La transformation souche GsBt3 and son Transformation Dans le Total Les saponines De Panax Quinquefolium [D]. Shanghai: Shanghai Normal University, 2012.
[47] YANG yuanchao, WANG yingping, YAN meixia et autres. Criblage de champignons phytopathogènes par production de composés K de ginsénoside [J]. China Journal of Chinese Materia Medica, 2011, 36(12): 1596-1598.
[48] CHEN yang,ZHANG mmeiping, WANG yi et al. Ginsenoside transformé microbien Rg3 des saponines totales du Panax ginseng par Bacillus subtilis [J]. Lishizhen Medicine and Materia Medica Research, 2014, 25(11):2676-2678.
[49] [traduction] JIN yan, JIN xiangmei, YIN chengriBiotransformation du ginsenoside majeur Re en ginsenoside mineur rh1par Sphingomonas sp.2-F2[J]. Agricultural Science Journal of Yanbian University, 2011, 33(02): 103-107.
[50] LIANG zhiqi, ZHANG jinglou, JING haizhu, et autres. Transformation microbiologique du ginsénoside Rg3 en Rh2[J]. Ginseng Research, 2018, 30(03): 6-10.
[51] Yan Q, Zhou W, Shi X L, et al. Voies de Biotransformation du ginsénoside Rb1 en composé K par β-glucosidases chez le champignon Paecilomyces Bainier sp. 229[J]. Process Biochemistry, 2010, 45(9): 1550-1556.
[52] Ye L, Zhou C Q, Zhou W, et al. Biotransformation du ginsénoside Rb1 en ginsénoside Rd par Paecilomyces bainier 229-7 très tolérant au substrat [J]. Bioresource Technology, 2010, 101(20):7872-7876
[53] CHEN xiaochun, DAI zhu, FU rongzhao. Synthèse biocatalytique de ginsénoside Rh2 rare [J]. Industrie chimique de Jiangxi, 2019(02): 55-57.
[54] Su J H, Xu J H, Lu W Y, et al. Transformation enzymatique du ginsénoside Rg3 en Rh2 à l’aide de Fusarium proliferatum ECU2042 nouvellement isolé [J]. Journal of Molecular Catalysis B Enzymatic, 2006, 38(2):113-118.
[55] Su J H, Xu J H, Yu H L et al. Propriétés d’un roman β-glucosidase de Fusarium proliferatum ECU2042 qui convertit le ginsénoside Rg3 en Rh2[J]. Journal of Molecular Catalysis B Enzymatic, 2009, 57(1-4):278-283.
[56] le gouvernement du Canada Xiuli, WANG yan, ZHAO wenqian, et al. Biotransformation fongique du ginsénoside Rg3[J]. Acta Microbiologica Sinica, 2008(09): 1181-1185.
[57] CONG yueyi, SUN jia, YU en, et al. Etude sur la transformation du ginsénoside Rg3 fermenté par Monascus purpureus[J]. Médicaments traditionnels et à base de plantes chinois, 2018,49(06): 1298-1303.
[58] Jin, F.X. Dans le deuxième Symposium International sur la médecine naturelle et la microflore [M]. Tokyo, Japon 1998, Oct, 24-26:1-15.
[59] Zhuang Y, Yang G Y, Chen X H, et al. Biosynthèse du ginsénoside Rh2 d’origine végétale dans la levure par réutilisation d’une enzyme microbienne promiscueuse clé [J]. Metabolic Engineering, 2017, 42:25-32.
[60] Byeong-Min Jeon, Jong-In Baek,Min-Sung Kim et autres. Caractérisation d’un nouveau ginsénoside MT1 produit par une Transrhamnosylation enzymatique de ginsénosides de type protopanaxatriol Re[J]. Biomolécules. 2020, 10(4): 525-525.
[61] Muhammad Zubair Siddiqi, hipólito Amaral Ximenes, Bong-Kyu Song, et autres. Amélioration de la production de ginsénoside Rh2(S) à partir de ginsénosides majeurs de type PPP à l’aide de BglSk cloné à partir de Saccharibacillus kuerlensis avec deux glycosidases en série [J]. Saudi Journal of Biological Sciences. 2021, 04, 079.
[62] Chen H, Dong, Zhi F, et al. Découverte, synthèse et relations structure-activité de dérivés 20S-dammar-24-en-2 α, 3 β, 12β, 20-tétrol (GP) en tant que nouvelle classe d’activateurs AMPK α2β1 γ 1 [J]. Biobiologique & Medicinal chemistry, 2016, 24(12): 2688-96.
[63] Xin S, Jl A, Yu X A et al. Biotransformation hautement régiosélective du ginsénoside Rg1 en dérivés 25-OH de 20(S/R)-Rh1 par Cordyceps Sinensis-ScienceDirect[J]. Biobiologique & Lettres de chimie médicinale. 2020, 30(21): 127-504.
[64] Liu J S, Yu X N, Qiu Z D, et al.Cordyceps biotransformation sinensis du notoginsénoside R1 en 25-OH-20(S/R)-R2 avec un effet cardioprotecteur élevé contre les lésions cellulaires induites par dox [J]. Avances RSC, 2022, 12, 129-38.
[65] Chen G T, Ge H J, Song Y et al. Biotransformation du 20(S)-protopanaxatriol par Mucor racemosus et les activités anticancéreuses de certains produits [J]. Biotechnology Letters, 2015, 37(10): 2005-2009.
[66] Kim M Y, Cho J Y. 20S-dihydroprotopanaxadiol, un dérivant de ginsénoside, stimule les réponses immunitaires innées des monocytes et des macrophages[J]. Journal of Ginseng Research, 2013, Jul, 37(3): 293-9.
[67] akanaka M, Zhu P, Bo Z et al. L’infusion intraveineuse de dihydroginsénoside Rb1 empêche les lésions de la moelle épinière compressives et les lésions cérébrales ischémiques par une régulation plus élevée du VEGF et du Bcl-XL.[J]. J Neurotrauma, 2007, 24(6): 1037-1054.
[68] Chen F, Zheng S L, Hu N ° de catalogueet al. L’ester octyle du ginsénoside Rh2 induit l’apoptose et l’arrêt du Cycle cellulaire G1 dans les cellules hepg2 humaines en activant la voie extrinsèque apoptotique et en modulant la voie de signalisation Akt/p38 MAPK [J]. Journal de chimie agricole et alimentaire, 2016, acs.jafc. , 6b03519.
[69] Du G J, Dai Q, Williams S, et al. Synthèse des dérivés du protopanaxadiol et évaluation de leurs activités anticancéreuses [J]. Anticancer drugs, 2011, 22(1):35.
[70] Xu D, Tao L, Yan L, et al. 2-Pyrazine-PPD, un nouveau dérivant de dammarane, ont montré une activité anticancéreuse par l’apoptose réactive des espèces d’oxygène et le stress endoplasmique du réticulum dans les cellules cancéreuses gastriques [J]. Revue européenne de pharmacologie, 2020, 881.
[71] Xu D, Yuan Y, Fan Z, et al. 4-XL-PPD, un nouveau dérivé de ginsénoside, en tant qu’agents thérapeutiques potentiels pour le cancer gastrique montre une activité anticancéreuse par l’intermédiaire de la génération médicinale d’apoptose cellulaire d’induction d’espèces réactives d’oxygène et d’inhibition migratoire et invasive[J]. Biomédecine &; Pharmacotherapy, 2019, (118): 108.
[72] Li Y, Baldauf S, Lim E K, et al. Analyse phylogénétique de la famille multigène udp-glycosyltransférase d’arabidopsis thaliana[J]. Journal of Biological Chemistry, 2001, 276(6):4338.
[73] Christensen L P. Ginsénosides: chimie, biosynthèse, analyse et effets potentiels sur la santé (chapitre 1)[J]. Adv Food Nutr Res, 2008, 55(55):1-99.
[74] Wang D D, Yeon-Ju Kim, Nam Nam Baek, et al. Glycosyltransformation du ginsénoside Rh2 into deux Le roman ginsenosides Utilisation de la glycosyltransférase recombinante de Lactobacillus rhamnosus et de ses applications in vitro [J]. Journal of Ginseng Research. 2021 45(1): 48-57.
[75] Hu Y, Xue J, Min J, et al. Synthèse biocatalytique du ginsénoside Rh2 à l’aide de réactions couplées catalysées par Arabidopsis thaliana à la glucosyltransférase [J]. Journal of Biotechnology, 2020, 309: 107-112.
[76] Jung S C, Kim W, Park S C, et autres. Deux udp-glycosyltransférases de ginseng synthétisent le ginsénoside Rg3 et Rd.[J]. Plante &; Cell physiology, 2014, 55(12): 2177-88.
[77] Khorolragchaa, Altanzul, Kim, et al. regroupement and caractérisation De putative La glycosyltransférase gènes from Panax Ginseng Meyer[J]. Gene, 536(1): 186-192.
[78] Warnecke D, Erdmann R, Fahl A, et al. Clonage et expression fonctionnelle des gènes UGT codés pour les stérol-glucosyltransférases de Saccharomyces cerevisiae, Candida albicans, pichiapastoris et Dictyostelium discoideum[J]. J Biol Chem, 1999, 274(19): 13048-13059. [79] Zhuang Y, Yang G Y, Chen X H, et al. Biosynthèse du ginsénoside Rh2 d’origine végétale dans la levure par réutilisation d’une enzyme microbienne promiscueuse clé [J]. Metab Eng, 2017, 42: 25-32.
[80] Zhao J N, Wang R F, Zhao S J, et al. avance in Les glycosyltransférases, the important Pièces de rechange for production of Ginsénosides diversifiés [J]. Chinese Journal of Natural Medicines, 2020, 18(9): 643-658.
-
Précédent précédent
Natural Black Rice Extract Anthocyanins: Antioxidant Product Solutions
-
Suivant:
Étude sur le ginsénoside Rare Rg1 Rb1 Rg3


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




