La méthode de synthèse de la poudre de Tagatose D?
Les humains ne peuvent pas se passer de sucre dans leurs trois repas par jour. Manger la bonne quantité de sucre répond nSur leseulement aux besoins du corps et#39; S fonctions, mais apporte également un sentiment de bonheur. Cependant, avec l’amélioratiSur ledu niveau de vie, les gens consomment trop de sucre, ce qui a entraîné une augmentation de la prévalence de maladies telles que l’obésité, le diabète, la carie dentaire Et etles maladies cardiaques [1]. Ces dernières années, les sucres traditionnels à forte absorption Et età forte teneur en calories (comme le saccharose, le sucre blanc, le glucose, etc.) ont été progressivement remplacés par des sucres rares à faible teneur en calories Et età faible absorption (comme le xylitol, l’érythritol, la D-allulose, etc.). L’international Society De laRare Sugars (ISRS) définit les sucres rares comme une classe de monosaccharides Et etde leurs dérivés qui existent dans la nature, mais en très petites quantités [3]. Les sucres rares ont non seulement un goût sucré, mais ils sont également faibles en calories. Plus important encore, ils ont des fonctions physiologiques qui sont bénéfiques pour la santé humaine Et etont de grandes perspectives de développement.
Rare sugar D-tagatose, avec la formule moléculaire C6H12O6 Et etle poids moléculaire 180,16, a la formule structurelle montrée dans la Figure 1. C’est un isomère de D-galactose, un diastéréoisomère de D-sorbitol à la position C-3, Et etun diastéréoisomère de D-fructose à la position C-4. Il granules cristallins blancs ou poudre blanche, facilement soluble dans l’eau, légèrement soluble en éthanol. Il s’agit d’un édulcorant fonctionnel à faible teneur en calories d’origine naturelle, d’une douceur qui est 92% de celle du saccharose [4] [traduction]Et etd’une valeur calorique de 1,5 kcal/g[5]. D-Tagatose (anglais)a été approuvé par la Food Et en plusDrug Administration des États-Unis (FDA) en tant qu’ingrédient sûr (généralement reconnu comme sûr, GRAS) [5-7]. En 2014, China' la Commission nationale de la santé et de la planification familiale a approuvé le D-tagatosecomme nouvel ingrédient alimentaire [6]. La D-tagatosea non seulement pour effet de prévenir la carie dentaire et l’obésité et d’abaisser la glycémie, mais a également un effet bénéfique sur la santé intestinale [8].
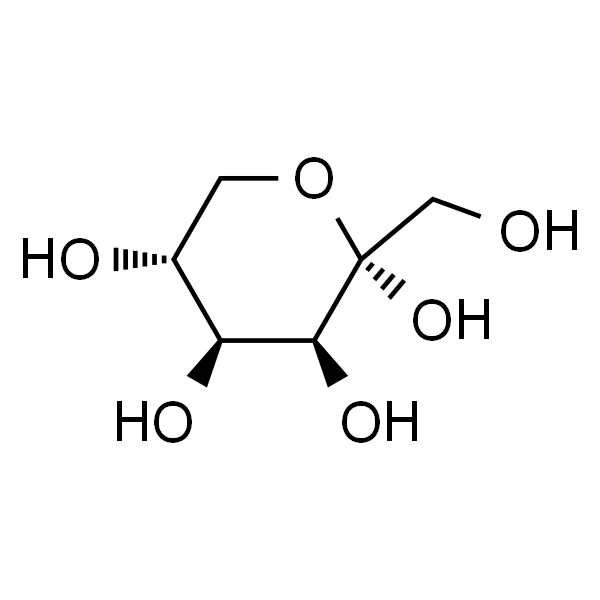
Cet article décrit brièvement les fonctions physiologiques et les applications du D-tagatose, présente les principales enzymes biologiques nécessaires à la biosynthèse du D-tagatose, résume les progrès de la recherche sur la biosynthèse du D-tagatose au cours des dernières années et donne un aperçu de la biosynthèse du D-tagatose.
1 fonctions physiologiques et applications de D-tagatose
1.1 édulcorant hypocalorique pouvant subir la réaction de Maillard et être utilisé dans les aliments
D-tagatose is a low-calorie sweetener. It is 92% as sweet as sucrose, but only 37.5% as hautedanscalories (4kcal/g) [5]. It cunreact avecproteins in food À propos deform a Maillard reaction, which improves Le conseil des ministrescolour Et en plusflavour De laLe conseil des ministresfood. It is therefore used in baked goods, drinks Et en plusconfectionery.
1.2 prévient l’obésité, abaisse la glycémie et aide au traitement du diabète de type 2
D-tagatose est un édulcorant fonctionnel à faible teneur en calories qui peut être utilisé dans les aliments pour remplacer les édulcorants traditionnels tels que le saccharose. Il peut atténuer l’obésité et abaisser la glycémie [9]. Dans le domaine de la médecine et de la santé, D-tagatose peut être utilisé pour préparer des médicaments pour le traitement du diabète de type 2 et de l’obésité [10-12].
1.3 Excellent prébiotique, bénéfique pour la santé intestinale
D-tagatose peut être fermenté par la flore intestinale dans le côlon, stimulant la croissance de bactéries intestinales bénéfiques et inhibant la croissance de bactéries pathogènes dans l’intestin [13]. De plus, la fermentation du D-tagatose peut produire des acides gras à chaîne courte tels que l’acide butyrique, qui sont bénéfiques pour la santé intestinale. Ces acides peuvent favoriser la croissance et la reLa productiondes cellules épithéliales du côlon et inhiber l’apparition du cancer du côlon [14].
1.4 Anti-caries, bénéfique pour protéger la santé dentaire
Le D-tagatose ne pouvant être utilisé par les microorganismes de la bouche, il contribue à réduire la production de substances acides dans la bouche et à réduire la carie dentaire, empêchant ainsi efficacement l’apparition de maladies dentaires telles que la gingivite, la carie dentaire et la mauvaise haleine [13].

1.5 utilisé comme substrÀ propos depour produire d’autres alcools de sucre rares
Selon la stratégie de biotransformation pour produire l’hexose, c’est-à-dire la stratégie d’izumoring [15], à partir du D-tagatose, des alcools sucrés rares ayant des fonctions physiologiques importantes comme le D-sorbitol, le D-tagatose et le galactitol peuvent être obtenus par catalyse enzymatique appropriée (Figure 2).
2 méthode de Production de D-tagatose
2.1 méthode d’extraction naturelle
Le D-Tagatose dans la nature se trouve principalement dans les gommes des arbres tropicaux à feuilles persistantes, les mousses, les lichens, le cacao chaud, le fromage et le yogourt, et le contenu est très faible [13,16,17]. L’extraction directe de D-tagatose à partir de ces substances nécessite une grande quantité de matières premières, ce qui rend le coût très élevé et rend difficile la production industrielle de D-tagatose.
2.2 méthode de synthèse chimique
Le D-Tagatose peut être obtenu à partir du D-galactosepar synthèse chimique. Le catalyseur chimique utilisé est un sel métallique alcalin, qui catalyse la réaction d’isomérisation du D-galactoseavec un hydroxyde métallique pour former un complexe hydroxyde-d-tagatose métallique. Après neutralisation acide, le complexe libère de la D-tagatose [13, 14, 18]. Cependant, la méthode de synthèse chimique pour la production de D-tagatose est relativement complexe, et il est facile de produire des sous-produits, ce qui réduit la pureté du produit cible D-tagatose et rend peu commode de séparer et de purifier plus tard. De plus, l’utilisation de réactifs chimiques entraînera une charge environnementale et n’est pas conforme au concept de production verte [19].
2.3 méthode de biosynthèse
Il y a deux façons principales deSynthétiser le D-tagatose biologiquement: l’une consiste à utiliser une réaction enzymatique unique pour synthétiser D-tagatose, et l’autre consiste à utiliser une réaction multi-enzymatique pour synthétiser D-tagatose. Selon la stratégie d’izumoring (Figure 2), l’isomérase aldose unique appropriée, la D-tagatose 3-éimerase et la réductase peuvent être choisies pour catalyser la conversiondu D-galactose, du D-sorbitol et du galactitol en D-tagatose, respectivement. Toutefois, les prix relativement élevés du D-galactose, du D-sorbitol et du galactitol rendent difficile leur application dans la production industrielle, ce qui limite la production industrielle du D-tagatose. À l’heure actuelle, certains chercheurs ont choisi des substrats peu coûteux comme le lactose, la maltodextrine et la poudre de lactosérum de lait comme matières premières, et ont utilisé une réaction catalytique multi-enzyme pour synthétiser le D-tagatose, et certains résultats de recherche ont été obtenus. La méthode biosynthétique de production de D-tagatose présente les avantages d’une grande efficacité de production, d’une grande pureté du produit, de conditions de réaction douces et d’un faible coût, ce qui en fait la méthode préférée pour la production industrielle de D-tagatose [20].
3 synthèse de D-tagatose par réaction enzymatique unique
3.1 L-arabinoseisomérase catalyse la synthèse du D-galactose en D-tagatose
La méthode monoenzymatique de biosynthèse des sucres rares permet d’exploiter pleinement les propriétés physico-chimiques de l’enzyme et est appliquée dans la production de sucres rares. Il a les avantages d’être simple et efficace, l’utilisation élevée du catalyseur d’enzymes, et l’efficacité élevée de production. La L-arabinoseisomérase (L-AI) est actuellement l’enzyme la plus étudiée pour la biosynthèse du D-tagatose et peut catalyser le D-galactose en D-tagatose.
Cette enzyme possède un large éventail de sources microbiennes, y compris acidothermecellulolytiqueATCC43068[21], Le bacillesubtilis STR. 168[22], Lactobacillus sake i 23K[23], Lactobacillus fermentum CGMCC2921[24], bacille thermoglucosidasius KCTC et KCTC 1828[25], Alicyclobacillus Hesperidum URH17-3-68[26], Le bacillecoagulans NL01[27], Pseudoalteromonas haloplanktis Le ccta14393[28], Geobacillus Stéarothermophilus [4], Clostridium hylemonae Le DSM 1505 3[29], Lactobacillus brevis MF 465792[30], Enterococcus faecium DBFIQ E36[31], Bifidobacterium adolescentis CICC 6178[32], Klebsiella pneumoniae DSM 681[33], etc.
The enzymatic properties De laL-arabinoseisoméraseÀ partir deLe conseil des ministresabove microorganisms are shown in Table 1. The optimum reaction temperature is between 40-75 ℃, Le conseil des ministresoptimum reaction pH is between 5.0-8.0, and various metal ions are activators De lathe enzyme, such as Mn2+, Co2+, and Mg2+. Most L-AIs have substratspécificitépourL-arabinoseand D-galactose, while a small number have substrate specificity only pourL-arabinoseand no substrate specificity pourD-galactose, such as L-AIs À partir deBacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. specificity, such as L-AI À partir deBacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. In addition, L-AI enzymes À partir deAcidothermus cellulolytics ATCC43068[21], Lactobacillus sakei 23K[23], Lactobacillus fermentum CGMCC2921[24], Bifidobacterium adolescentis CICC 6178[32], etc. exhibit strong substrate specificity pourD-galactose.
La L-AI de Bacillus coagulans NL01 a été exprimée de façon hétérologue dans un système d’expression d’e. coli et catalysée par des cellules entières à 60 °C et à un pH de 7,5. Lorsque la concentration du substrat D-galactose était de 150 g/L et de 250 g/L,les taux de conversion du D-tagatose ainsi obtenu étaient de 32 et 27%, respectivement, et les temps de conversion étaient de 32 et 48 h, respectivement [27]. Le taux de conversion du D-tagatose était de 56,7% lorsque 100 mmol/L de D-galactose (contenant 6 mmol/L de Mn2+) ont été catalysé par l’enzyme L-AI purifiée de Bifidobacterium adolescentis CICC 6178 à 55 °C et pH 6,5 pendant 10 h [32]. La L-AI de Klebsiella pneumoniae DSM 681 a été exprimée de façon hétérogène dans un système d’expression d’e. coli. Le substrat était de 100 g/L de D-galactose (contenant 1 mmol/L de Mn2+). La réaction catalytique en cellules entières a été effectuée à 50 °C et à un pH de 8,0 pendant 30 minutes, et le taux de conversion du D-tagatose a été de 33,5 % [33].
La technologie d’affichage de la surface des spores est une méthode qui s’appuie sur l’effet d’ancrage de la protéine d’enveloppe des spores pour afficher l’enzyme cible sur la surface des spores en fusionnant l’enzyme cible avec la protéine d’enveloppe des spores, immobilisant ainsi l’enzyme. Les enzymes immobilisées peuvent maintenir l’activité catalytique dans des environnements extrêmes et surmonter la barrière de la perméation du substrat et du produit à travers la membrane [10]. C’est une tentative bénéfique d’immobilisation enzymatique. En 2014, LIU Et Al., et al.[16] ont utilisé la technologie d’affichage des spores pour afficher l’enzyme L-AI de Lactobacillus fermentum CGMCC2921 sur la surface des spores de Bacillus subtilis 168. Les spores L-AI recombinantes obtenues ont montré une activité catalytique relativement élevée et une forte stabilité thermique. Après avoir été conservés à 80 °C pendant 30 min, ils ont conservé 87% de leur activité enzymatique.
En utilisant cette spore de L-AI recombinant comme biocatalyte, 100 g/L de D-galactose ont été utilisés comme substrat, et la réaction a été effectuée à 70 °C pendant 24 h, avec un taux de conversion de D-tagatose d’environ 75%. En 2018, GUO et Al., et al.[10] ont également utilisé la technologie d’affichage de surface des spores pour afficher l’enzenzyme L-AI dérivée de Lactobacillus brevis PC16 sur la surface des spores de Bacillus subtilis DB403. Des spores de L-AI recombinantes ont été utilisées comme biocatalyseur. En utilisant 125 g/L de D-galactose (contenant 1 mmol/L de Mn2+) comme substrat, la réaction a été effectuée à 6 7 °C et à pH 6,5 pendant 28 h. Le taux de conversion du D-tagatose a été de 79,7 % et les spores de L-AI recombinantes ont eu une bonne réutilisation. Après 5 cycles, l’activité spécifique était encore de 87%, et le taux de conversion du D-tagatose était de 40,7%. La technologie d’affichage des spores présente l’inconvénient d’un faible rendement en spores, ce qui rend son application industrielle difficile. Le tableau 2 résume les rapports publiés ci-dessus sur la synthèse catalytique du D-tagatose à partir du D-galactose.
En raison des limites de l’équilibre thermodynamique, les réactions catalysées par l’isomérase se caractérisent par de faibles taux de conversion, ce qui réduit l’efficacité de la production et ne favorise pas la séparation et la purification des produits. Bien que l’augmentation de la température de réaction puisse déplacer l’équilibre de la réaction du côté du produit, des températures excessivement élevées non seulement réduisent l’activité enzymatique, mais conduisent aussi facilement au brunissement du sucre, ce qui affecte la qualité du produit, en particulier dans des conditions alcalines. Par conséquent, le développement d’un catalyseur enzymatique à basse température de réaction, à pH acide, à activité catalytique élevée et à forte résistance à la chaleur sera bénéfique pour les applications industrielles.
3.2 la D-Tagatose 3-epimerase catalyse la production de D-Tagatose à partir de D-sorbitol
D-tagatose 3-epimerase (D-tagatose 3-epimerase, DTE) ou D-psicose 3-epimerase (D-psicose 3-epimerase, DPE) sont des enzymes couramment utilisées pour la biosynthèse du D-psicose. Ils ont une large gamme de spécificités de substrat. Par exemple, les enzymes DPE d’agrobacterium tumefaciens[34] et d’arthrobacter globiformis[35] et l’enzyme DTE de Caballeronia fortuita[36] peuvent toutes se convertir entre D-sorbitol et D-Tagatose, dans lequel le rapport D-Tagatose/D-sorbitol à l’équilibre est de 30,7 à 69,3 lorsque biocatalysé par l’enzyme DTE de Caballeronia fortuita (Figure 3).Production industrielle de D-tagatose À partir deD-sorbitol uneconomical.
3. 3 la Galactitol déshydrogénase catalyse la production de D-tagatose à partir de Galactitol
La Galactitol 2-déshydrogénase (GDH) peut oxyder divers polyalcools et polyols en cétones et cétoses correspondantes, respectivement, en présence de la coenzyme NAD+. JA GTAP,etc. [37] a exprimé de façon hétérogène l’enzyme GDH de Rhizobium leguminosarum bv. Viciae 3841 dans un système d’expression d’e. coli.
La protéine enzymatique GDH a été purifiée par chromatographie d’affinité His-tag. L’électrophorèse sur gel de dodécyl-sulfate-polyacrylamide a été utilisée pour déterminer que le poids moléculaire de l’enzyme était de 28 kDa, et la chromatographie par filtration sur gel a été utilisée pour déterminer que le poids moléculaire de l’enzyme était de 114 kDa, ce qui indique que l’enzyme est un homotétramère. L’analyse des propriétés enzymatiques a montré que la température optimale est de 35 °C et le pH optimal de la réaction est de 9,5. Lorsque le substrat est le galactitol, les paramètres cinétiques Km sont de 8,8 mmol/L, Kcat sont de 835 min-1, et Kcat/Km sont de 94,9 min-1mmol·L-1, ce qui indique que l’enzyme a une bonne spécificité du substrat pour le galactitol. L’enzyme G DH catalyse la réaction du galactitol pendant 30 minutes, et le taux de conversion du D-tagatose est aussi élevé que 72%. On vérifie par la mesure de la rotation optique que le produit d’oxydation est D-tagatose.
Bien que le taux élevé de conversion de D-tagatose peut être obtenu en catalysant la production de D-tagatose à partir de galactitol en utilisant la galactitol déshydrogénase, mais cette réaction d’oxydation nécessite l’ajout de la coenzyme NAD+, et le substrat galactitol est cher, de sorte qu’il n’est pas économique comme matière première pour la production industrielle.
4 Catalyser la synthèse de D-tagatose à partir de substrats peu coûteux par catalyse multi-enzymatique
4. 1 Catalyser la production de D-tagatose à partir du lactose
Le Lactose est un disaccharide composé d’une molécule de D-glucose et d’une molécule de D-galactose. Son prix étant beaucoup plus bas que celui du D-galactose, du D-sorbitol et du galactitol, c’est le substrat préféré pour la production de D-tagatose. Zhang et Al., et al.[38] ont construit un Lactiplantibacillus plantarum Souche ingénieur, éliminant le gène de la galactokinase pour bloquer le métabolisme du D-galactose; Il exprime également la β-galactosidase (β-g galactosidase, β-GAL) et la L-arabinoseisomérase, qui catalyse le D-galactose en D-tagatose, réalisant ainsi la biosynthèse directe du D-tagatose à partir du lactose dans un pot. L’utilisation de cette souche artificielle a été utilisée dans une réaction cellulaire au repos à 65 °C et à un pH de 7,5 pendant 56 h avec un substrat de 175 g/L de lactose, et le taux de conversion du D-tagatose était de 33%.
4. 2. Production catalytique de D-tagatose à partir de poudre de lactosérum
Les déchets de l’industrie laitière sont utilisés comme matière première bon marché pour produire des produits sucrés rares [39, 40]. En 2022, ZHANG ZHANGZHANGet Al., et al.[41] ont fait état de la conversion d’un sous-produit laitier riche en lactose, la poudre de lactosérum du fromage (CWP), en trois édulcorants hypocaloriques, le D-tagatose, le D-arabitol et le galactitol, au moyen d’une catalyse et d’une fermentation en cellules entières en continu (figure 4). Ensuite, le D-glucose et le D-galactose restant sont fermentés par Metschnikowia pulcherrima E1 en D-arabitol et galactitol. Enfin, 68,35 g/L D-tagatose,60.12 g/L D-arabitolEt 28,26 g/L de galactitol ont été obtenus avec 428,57 g/L de CWP (contenant 300 g/L de lactose). Ce rapport a également permis d’utiliser pleinement les métabolites intermédiaires D-glucose et D-galactose résiduel, produisant une série de produits précieux à partir de sous-produits industriels.
4.3 production catalytique de D-tagatose à partir de maltodextrine
20 22 ans, DAI et Al., et al.[42] ont construit un système composé de α-glucane phosphorylase (α-glucane phospho-lyase, αGP), phosphoglucomutase (PGM), glucose 6-phosphate isomérase (PGI), D-tagatose 1,6-bisphosphate aldolase (GatZ), et phosphoglycolate phosphatase (PGP). Phosphatase (PGP) composée d’un biocatalyst de cellules entières d’escherichia coli. La technologie CRISPR-Cas9 a également été utilisée pour éliminer le gène qui provoque le métabolisme du produit intermédiaire (Figure 5), afin d’augmenter l’accumulation du produit intermédiaire. La souche d’e. coli ainsi créée a été utilisée comme biocatalyte pour obtenir 3,383 g/L de D-tagatose avec un taux de conversion de 33,83 g/L en utilisant 10 g/L de maltodextrine comme substrat pendant 3 h.
Multienzyme promoted reactions have great potential in terms of biosynthesis and conversion. Compared with single-enzyme-promoted reactions, multi-enzyme-promoted reactions cunachieve more complex reactions, Les produitshigh value-added products À partir delow-cost substrates, avoid the séparationof intermediates, reduce the inhibition of intermediates, and even change the reaction balance [5]. However, due À propos dethe unbalanced ratio of various enzymes, the unbalanced metabolic flux of intermediates, and the different optimal reaction conditions of various enzymes, the conversion rate De D-tagatoseis not high. In the later stage , it is possible to use techniques such as synthetic biology, metabolic engineering, and protein engineering to optimize enzyme synthesis and Expression,improve enzyme performance, increase the synergy between various enzyme molecules, and improve the conversion rate of D-tagatose.
5 D - séparation, purification et cristallisation du tagatose
La séparation et la purification du D-tagatose est une étape cruciale qui affecte la cristallisation ultérieure du D-tagatose et la qualité du produit. En 2008, Huang Wenxia et Al., et al.[43] ont signalé l’utilisation de résine échangeuse d’ions Ca2+ pour séparer le D-galactose et le D-tagatose, et la pureté du D-tagatose obtenu était de 98%, et le taux de récupération était de 83%; La solution de D-tagatose obtenue a ensuite été soumise à des résines échangeuses d’anions et de cations pour dessalement et décoloration, avec un taux de dessalement de 93% et un taux de récupération de D-tagatose de 87%. Par la suite, le D-tagatose a été cristallisé par addition d’éthanol. Su Qi et Al., et al.ont utilisé la chromatographie à lit mobile simulée pour séparer le D-tagatose et le D-galactose et ont constaté que lorsque le temps de commutation de la vanne était de 6,43 minutes, la pureté du D-tagatose obtenu par séparation atteignait 100%, et le taux de récupération atteignait 99,93% [44]. Ces dernières années, la chromatographie à lit mobile simulé a été largement utilisée dans la production de sucres rares en raison de ses avantages d’efficacité élevée de séparation, d’utilisation élevée de solvant et de faible consommation d’énergie.
At present , there have been few reports on the cristallisationof D-tagatose. The biosynthesis De D-tagatoseis prone to the production of other heterosaccharides (such as D-glucose, D-fructose, etc.), and they often cannot be completely removed during industrial separation, which affects the nucleation and growth of D-tagatose crystals, as well as the morphology, particle size distribution and purity of D-tagatose crystals. In 2022 , WANG WANGet Al., et al.[45] studied the effect of three impurity Les sucres(D-maltose, D-fructose, and D-glucose) on the nucleation rate of D-tagatose crystals and found that the adsorption De l’impuretésugars on the surface of D-tagatose crystals hinders the growth of D-tagatose crystals (Figure 6). WANG et al. also studied the effect of impurity sugars on the growth rate of D-tagatose crystals through single crystal growth experiments, and used molecular dynamics simulations to reveal the crystal nucleation and growth mechanism of D-tagatose at the molecular scale. There are currently few reports on the industrial crystallization process of D-tagatose.
6 résumé et perspectives
As a functional natural sweetener, D-tagatose not only has important application value in the food industry, but also plays a vital Rôle de la commissionin the pharmaceutical and healthcare industries. Although D-tagatose has been approved as a new food ingredient in China, large-scale production has not yet been realized for the following reasons: (1) an enzyme catalyst with high production intensity, strong thermal stability and high conversion rate has not yet been obtained; (2) insufficient development of food-grade host bacteria; (3) high substrate cost; (4) high difficulty in product separation and purification.
1) utiliser l’ingénierie des protéines, l’ingénierie enzymatique et d’autres technologies pour modifier la structure moléculaire des enzymes afin d’obtenir des molécules enzymatiques ayant une activité catalytique élevée, un taux de conversion élevé et une stabilité thermique élevée; 2) développer des bactéries hôtes de qualité alimentaire certifiées GRAS comme vecteurs biocatalytiques, notamment Bacillus subtilis, levures, bactéries lactiques, etc.; (3) donner le plein jeu au potentiel de la catalyse multi-enzymatique dans la biosynthèse et la transformation, équilibrer les niveaux d’expression de diverses molécules enzymatiques et le flux du métabolisme intermédiaire, augmenter l’effet synergique entre diverses molécules enzymatiques, et utiliser des substrats à faible coût pour produire en série D-tagatose; (4) optimiser les processus de séparation, de purification et de cristallisation de D-tagatose. Grâce à ces efforts, un procédé simple, efficace et innovant pour la production industrielle de D-tagatose a été mis en place.
Référence:
[1] [traduction] SURAPUREDDI S,RAVINDHRANATH K, KUMAR G, Et al. Les méthodes analytiques à haute résolution et à haut débit pour le d-tagatose et les impuretés liées au procédé au moyen de l’électrophorèse capillaire [J]. Biochimie analytique, 2020, 609: 11398 1.
[2] [traduction] BAPTISTA S, roman
[3] [traduction] BEERENS K, DESMET T, T,T,T,SOETAERT W. Enzymes pour la production biocatalytique de sucres rares [J]. Journal of Industrial La microbiologieand Biotechnology, 2012, 39(6): 823-834.
[4] LAKSMI F, À propos de nous S, TSURUMARU H, et al. amélioré substrate specificity for D-galactose of L-arabinose isomérase for Application industrielle [J]. Biochimica et Biophysica Acta (BBA) - protéines et protéomique, 2018, 1866(11): 1084-1091.
[5] [traduction] DAI Y,L lM,JIANG B, et al. Biosynthèse en cellules entières de D-tagatose à partir de maltodextrine par Escherichia coli avec système de co-expression multi-enzyme [J]. Enzyme and Microbial Technology, 2021, 145: 109747.
[6]WANG J. Production de l’édulcorant D-tagatose et son application dans les aliments [J]. Condiment de Chine, 2016, 41(01): 140-143.
[7] [traduction] ROY S, CHIKKERUR J, J,ROY S, et Al. Tagatose en tant que nutraceutique potentiel: production, propriétés, rôles biologiques et applications[J]. Journal of Food Science, 2018, 83(11): 2699-2709.
[8] [traduction] LAKSMI F, ARAI S, ARAKAWA T, et al. Expression et caractérisation de la L-arabinose isomérase de Geobacillus stearothermophilus pour une activité améliorée en condition acide [J]. Expression des protéines et Purification, 2020, 175: 105692.
[9] [traduction] BOBER Mon fils, N ° de catalogue NU. Nü. Galactose to tagatose isomérisation at modéré Les températures with high conversion and Productivité [J]. Nature Communications, 2019, 10(1): 4548.
[10] GUO Q,AN Y,YUN J, et al. Amélioration de la production de D-tagatose par l’isomérase de L-arabinose affichée en surface par spore à partir de Lactobacillus brevis PC16 isolé et biotransformation[J]. Bioresource Technology, 2018, 247: 940 -946.
[11] DE/enSOUSA M, MELO V, HISSA D,et al. Immobilisation et stabilisation en une étape d’un Enterococcus faecium DBFIQ E36 L- arabinose isomérase pour la synthèse D-tagatose [J]. appliquéBiochemistry and Biotechnology, 2019, 188(2): 310 -325.
[12] DE SOUZA T, OLIVEIRA R,BEZERRA S, et al. Expression hétérologue Alternative de l’isomérase de L-arabinose d’enterococcus faecium DBFIQ E36 par induction résiduelle du lactosérum [J]. Molecular Biotechnology, 2021, 63(4): 289 -304.
[13] DAI Y. biosynthèse de D-tagatose à partir de maltodextrine par système catalytique multi-enzyme [D]. Université de Jiangnan, 2021.
[14] GUO Q. la production de D-tagatose à partir du lactose à l’aide de β-galactosidase et de L-arabinose isomérase [D]. Université du Shandong, 2018.
[15] IZUMORI K. Izumoring: a strategy for bioproduction of all hexoses[J]. Journal of Biotechnology, 2006, 124 (4): 717-722.
[16] LIU Y, L lS, XU H et al. Production efficace de D-tagatose à l’aide d’un système d’affichage de surface de qualité alimentaire [J]. Journal of Agricultural and Food Chemistry, 2014, 62(28): 6756-6762.
[17] ZHENG Z, XIE J, LIU P et al. Biotransformation élégante et efficace pour la production double de D-tagatose et de bioéthanol à partir de poudre de lactosérum de fromage [J]. Journal de chimie agricole et alimentaire, 2019, 67(3): 829 -835.
[18] WANG Z, WANG M, LYU X et al. Préparation de recyclage de tagatose de haute pureté à partir de galactose en utilisant une isomérisation assistée par adsorption à base d’adsorbant à affinité de boronate à un pot et une purification simultanée [J]. Chemical Engineering Journal, 2022, 446: 137089.
[19] BORTONE N ° de catalogue «FIDALEO» M. :: stabilisation Des immobilisés L-arabinose isomérase for the production of D-tagatose from D-galactose[J]. Biotechnology Progress, 2020, 36(6): e3033.
[20] DE SOUSA M, SILVA GURGEL B, PESSELA B, et al. Préparation de CLEAs et CLEAs magnétiques d’une isomérase de L -arabinose recombinante pour la synthèse de D-tagatose [J]. Enzyme and Microbial Technology, 2020, 138: 109566.
[21] en savoir plus L, U u L, l, ZHANG T, et al. un L-arabinose isomérase from Acidothermus cellulolytics ATCC 43068: journal officiel Le clonage, Expression, purification et caractérisation [J]. Applied Microbiology and Biotechnology, 2010, 86(4): 1089 -1097.
[22] KIM J, PRABHU P, JEYA M, et al. caractérisation of an L-arabinose isomérase from Bacillus Subtilis [J]. Applied Microbiology And Biotechnology, 2010, 85(6): 1839-1847.
[23] RHIMI M, ILHAMMAMI R, BAJIC G, Et al. La L-arabinose isomérase tolérante à l’acide de la Lactobacillus sakei 23K de qualité alimentaire est un producteur de D-tagatose attrayant [J]. Bioresource Technology, 2010, 101(23): 9171 -9177.
[24] XU Z, QING Y, LI S, et al. Une nouvelle isomérase de L-arabinose de Lactobacillus fermentum CGMCC2921 pour la production de D-tagatose: clonage de gènes, purification et caractérisation [J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 70(1): 1 -7.
[25] en savoir plus M. caractérisation of an L-arabinose isomérase from Bacillus thermoglucosidasius for D-tagatose Production [J]. Bioscience Biotechnology and Biochemistry, 2013, 77(2): 385-388.
[26] ventilateurC, LIU K, ZHANG T et al. Caractérisation biochimique d’une isomérase de L-arabinose thermostable d’une bactérie thermoacidophile, Alicyclobacillus hesperidum URH17-3-68[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 102: 120-126.
[27] MEI L, l,WANG L, ZANG Y et al. Caractérisation d’une isomérase de L-arabinose de Bacillus coagulans NL01 et son application pour la production de d-tagatose [J]. BMC Biotechnology, 2016, 16(1): 55.
[28] [traduction] W, FAN C, ZHANG T, et al. Le clonage, expression, and caractérisation De a Le roman L-arabinose isomérase from the Bactérie psychrotolérante Pseudoalteromonas haloplanktis[J]. Molecular Biotechnology, 2016, 58(11): 695-706.
[29] NGUYEN T, HONG kong M, CHANG CHANG P, et al. Propriétés biochimiques De L-arabinose isomérase from Clostridium hylemonae to produce D- tagatose en tant qu’édulcorant fonctionnel [J]. PLoS One, 2018,13(4): e0196099.
[30] DU M, ZHAO D, CHENG S, et al. Vers une conversion enzymatique efficace du D-galactose en D-tagatose: purification et caractérisation de l’isomérase de L-arabinose de Lactobacillus brevis[J]. Bioprocess and Biosystems Engineering, 2019, 42(1): 107 -116.
[31] MANZO R, ANTUNES A, DE SOUSA M, et al. biochimique caractérisation De recombinant résistant à la chaleur L-arabinose isomerase De la souche DBFIQ E36 d’enterococcus faecium avec des applications réalisables dans la production de D-tagatose [J]. Molecular Biotechnology, 2019, 61(6): 385-399.
[32] ZHANG G, AN Y, PARVEZ A, et al. Exploration d’une isomérase de L-arabinose hautement spécifique du D-galactose de Bifidobacterium adolescentis pour la production de D-tagatose [J]. Frontières en bioingénierie et biotechnologie, 2020, 8: 377.
[33] SHIN K, SEO M, KIM S, et al. Caractérisation de la L-arabinose isomérase de Klebsiella pneumoniae et son application dans la production de D-tagatose à partir de D-galactose[J]. Applied Sciences, 2022, 12(9): 4696.
[34] KIM H,HYUN E, KIM Y, Et al. Caractérisation d’une Agrobacterium tumefaciens D-psicose 3-epimerase qui convertit le D-fructose en D-psicose [J]. Applied and Environmental Microbiology, 2006, 72(2): 981 -985.
[35] YOSHIHARA A, KOZAKAI T, SHINTANI T, et al. Purification et caractérisation de D-allulose 3-epimérase dérivé d’arthrobacter globiformis M30, un micro-organisme GRAS [J]. Journal of Bioscience and Bioengineering, 2017, 123(2): 170 -176.
[36] LI S, CHEN Z, ZHANG W et al. Caractérisation d’une D-tagatose 3-epimerase à partir de Caballeronia fortuita et son application dans la production rare de sucre [J]. International Journal of Biological Macromolecules, 2019,138: 536 -545.
[37] JAGTAP S, SINGH R, KANG Y et al. Clonage et caractérisation d’une galactitol 2-déshydrogénase de Rhizobium legumenosarum et son application dans la production de D-tagatose [J]. Enzyme and Microbial Technology, 2014, 58 -59: 44-51.
[38] ZHANG S, GUO T, XIN Y et al. Production biotechnologique de D-tagatose à partir du lactose à l’aide de Lactiplantibacillus plantarum[J]. LWT - Food Science and Technology, 2021, 142: 110995.
[39] RAI S, KAUR H, KAULDHAR B, et al. Cristal hybride métallique à double enzyme pour la transformation directe du lactosérum en D-tagatose de sucre rare de haute valeur: synthèse, caractérisation, et un processus durable [J]. ACS Biomaterials Science and Engineering, 2020, 6(12): 6661-6670.
[40] ZHANG G, ZABED H, YUN J, et al. Biosynthèse en deux étapes de D-tagatose à partir de lactosérum en poudre par une souche fabriquée d’escherichia coli qui exprime la L-arabinose isomérase de Lactobacillus plantarum[J]. Bioresource Technology, 2020, 305: 123010.
[41] ZHANG G, ZABED H, AN Y, Et al. La conversion biocatalytique d’un déchet laitier riche en lactose en D-tagatose, D-arabitol et galactitol à l’aide de technologies séquentielles de cellules entières et de fermentation [J]. Bioresource Technology, 2022, 358: 127422.
[42] DAI Y, LI C, ZHENG L et al. Biosynthèse améliorée de D-tagatose à partir de maltodextrine par l’ingénierie modulaire de voies de recombinaison Escherichia coli[J]. Journal d’ingénierie biochimique, 2022, 178: 108303.
[43] HUANG W, MU W, JIANG B. étude sur la séparation et la purification de d-tagatose [J]. Food and Fermentation Industries, 2008, 34(06):168-171.
[44] mon Q, LI H, Le ZHA X, et al. Simulation étude on separation of D-tagatose and D-galactose in simulé déménagement Lit [J]. Industrie chimique contemporaine, 2014, 43(07): 1379-1381+1385.
[45] WANG D, WANG Y, LI Y, et al. découvrir the role of impurity sugars on the crystallization of D-tagatose Cristal: expériences Et des simulations de dynamique moléculaire [J]. Chimie alimentaire, 2022, 397: 133762.
-
Précédent précédent
Quelles sont les utilisations du D Tagatose?
-
Suivant:
Quels sont les avantages de D Tagatose?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




