Quels sont les avantages de Centella Asiatica?
Centella asiatiqueis the dried whole herb of the plant Centella asiatica (L.) Urb. in the family Apiaceae. It has the effects of clearing away heat and dampness, detoxifying and reducing swelling. It is mainly used to treat damp-heat jaundice, heatstroke diarrhea, stone dysuria, hematuria, carbuncle and swelling caused by toxin, bruises and contusions, etc.[1]. When previous scholars analyzed the chemical composition of Centella asiatica, they found that its main components include triterpenoids, essential oils, polyacetylenes, flavonoids, etc., and triterpenoids are the most abundant [2]. Madecassoside is a triterpenoid compound found in Centella asiatica. Its molecular formula is C48H78O19 and molecular weight is 959.12[3]. As one of the main pharmacologically active ingredients in Centella asiatica, madecassoside has a variety of pharmacological effects, such as anti-tumor, anti-inflammatory, protecting the nervous system, and promoting wound healing[4].

1. Effet anti-tumoral et mécanisme de Centella asiatica extrait
1.1. Inhiber la prolifération des cellules tumorales
Zhou et al. [5] ont montré que l’asiaticoside peut inhiber la prolifération des cellules cancéreuses colorectelles en inhibant la voie de signalisation du facteur de transcription nucléaire κB (NF-κB). En outre, l’asiaticoside peut également inhibe la prolifération des cellules cancéreuses du pancréas en inhibant la phosphorylation de la protéine kinase activée par mitogène p38 (p38MAPK) et NF-κB p65 [6].
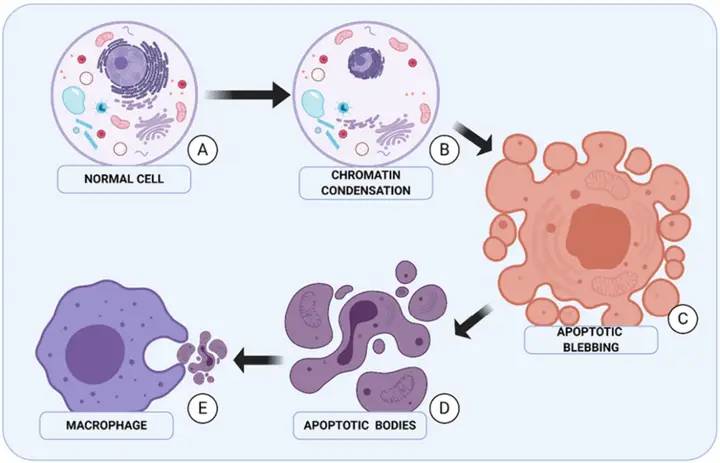
1.2 induire l’apoptose dans les cellules tumorales
Zeng Manhong et al. [7] ont utilisé différentes concentrations d’asiaticoside pour traiter les cellules SGC-7901 du cancer gastrique, et les cellules ont montré un pic apoptotique significatif. La microscopie électronique à Transmission a révélé des caractéristiques typiques de l’apoptose, telles que la concentration cytoplasmique, le retrait et la rupture nucléaires, et l’agrégation mitochondriale. L’extrait de Centella asiatica favorise également l’apoptose dans les cellules MCF-7 du cancer du sein: au fur et à mesure que le temps d’intervention de l’extrait de Centella asiatica se prolonge, la morphologie des cellules MCF-7 devient irrégulière, le cytoplasme se répand progressivement, les noyaux fusionnent d’abord puis disparaissent progressivement, formant finalement des corps apoptotiques. D’autres recherches ont révélé que l’asiaticoside peut réduire de manière significative les niveaux d’expression des protéines du facteur de croissance endothélial vasculaire (VEGF) et du facteur de croissance basique du fibroblaste (bFGF) dans les cellules MCF-7 [8]. Wu Qian et al. [9] ont découvert que différentes concentrations d’asiaticoside peuvent induire l’apoptose dans les cellules de l’ostéosarcoma Saos-2, et peuvent réduire les niveaux d’expression de phosphatidylinositol 3-kinase (PI3K), protéine kinase B (Akt), Akt phosphorylé (p-Akt), glycogène synthase kinase 3β (GSK-3β), glycogène synthase kinase 3β phosphorylé (p-GSK-3β), ce qui indique que l’asiaticoside peut induire l’apoptose dans les cellules de l’ostéosarcoma Saos-2 en régulant l’activité de la voie de signalisation PI3K/Akt/GSK-3β. D’autres études ont également montré que l’asiaticoside peut induire l’apoptose dans les cellules du cancer du foie QGY-7703 et Bel-7402 en inhibant l’activité des voies de signal PI3K/Akt et MAPK/ extracellulaire signal-regulated kinase (ERK) [10].
Bax, une protéine X liée au Bcl-2, appartient à la famille des Bcl-2 et est le principal régulateur d’apoptose dans le corps humain [11]. Pan Jinli [12] a constaté que l’induction de l’apoptose dans les cellules cancéreuse de l’ovaire A2780 par l’asiaticoside peut être liée à la régulation défavorable de l’expression du facteur anti-apoptotique Bcl-2 et à la régulation ascensionnelle du facteur pro-apoptotique Bax. Des études connexes ont montré qu’après 48 heures d’action sur les cellules MCF-7 du cancer du sein, l’asiaticoside induit significativement l’apoptose dans les cellules, et le niveau d’expression de la caspase-3 (c-asiaticoside p-asiaticoside e-3) dans les cellules est significativement augmenté, le facteur de nécrose tumorale (TNF-α) et l’interleukine 1β (IL-1β) ont été significativement réduits [13-14]. En outre, Li et al. [15] ont constaté que l’asiaticoside peut exercer des effets antitumoraux sur les cellules résistantes aux médicaments de la lignée cellulaire du myélome KM3/BTZ. Le mécanisme est lié à l’induction de l’autophagie, à l’activation de l’activité c-asiaticoside p-asiaticoside e-3, et à l’inhibition de la migration cellulaire, de l’invasion, et du transducteur de signal et de l’activateur de la voie de signalisation de la transcription 3 (STAT-3). Ainsi, l’asiaticoside peut induire l’apoptose dans les cellules tumorales en régulant l’expression des protéines liées à l’apoptose et en médiant des voies de signaux liées à l’apoptose (telles que la voie de signal PI3K/Akt/GSK-3β), inhibant ainsi la prolifération, la migration et l’invasion des cellules tumorales.
2. Effet anti-fibrose et mécanisme d’asiaticoside
Des études connexes ont révélé que lorsque la concentration massique de l’asiaticoside est de 400 μg/mL, il présente des effets inhibiteurs sur les fibroblastes cutanés embryonnaires humains et les fibroblastes pulmonaires humains [16-17]. Dans une expérience de fibrose mésenchimateuse pulmonaire de rat induite par le pimécrolimus, il a été constaté que l’asiaticoside a amélioré la fibrose mésenchimateuse pulmonaire induite par le pimécrolimus en augmentant le niveau d’expression des récepteurs de l’adéneosine 2A (A2AR) et en diminuant les niveaux d’expression de l’il-4, du TNF-α et du facteur de croissance de transformation bêta 1 (TGF-β1) [18]. Zhu Dewei et al. [19] ont constaté que l’asiaticoside peut inhiber la production de cytokines inflammatoires, réduire le niveau d’expression de l’arnm TGF-β1, et exercer un effet anti-fibreuse.
Wang Ce [20-21] a constaté que l’asiaticoside peut considérablement améliorer la fibrose rénale chez les rats avec une obstruction urétérale unilatérale. Le mécanisme peut être lié à la régulation vers le bas de l’expression du facteur de croissance du tissu conjonctif (CTGF) et du collagène de type III (Col III) dans l’interstitium rénal. En outre, le même auteur a également constaté que l’asiaticoside peut améliorer la fibrose du myocarde après un infarctus du myocarde chez le rat. Zhao Sixia et al. [22] ont établi un rat modèle de fibrose hépatique immunitaire pour étudier l’effet de l’asiaticoside sur les concentrations d’alanine aminotransférase (ALT) et d’aspartate aminotransférase (asiaticoside T) dans le sérum et d’hydroxyproline (Hyp) dans le tissu hépatique du rat modèle. Les résultats ont montré que l’asiaticoside peut réduire le degré de fibrose dans le tissu hépatique du rat et réduit de manière significative les taux d’alt et de T asiaticoside dans le sérum et le taux d’hyp dans le tissu hépatique des rats, ce qui indique que l’asiaticoside a un effet bénéfique sur la fibrose hépatique à médiation immunitaire. Ji et al. [23] ont constaté que l’asiaticoside peut améliorer la fibrose pulmonaire induite par la BLM chez le rat, et que le mécanisme d’action peut être lié à la régulation de la voie TGF-β1/Smad.
Une autre étude a révélé queAsiaticoside peut réduire considérablement le degré de fibroseDans le tissu pulmonaire de souris avec modèle de fibrose pulmonaire. Et le mécanisme d’action pourrait être d’améliorer la fibrose pulmonaire en activant la voie de signalisation a2ar (cAMP) cyclique adenosine monophosphate (cAMP)/R asperulosid-associated protein 1 (RAP1) assisté [24]. Zhang et al. [25] ont induit la fibrose pulmonaire chez des souris de type sauvage (WT) et des souris knockout A2AR (A2AR-/-) à l’aide du BLM, puis ont étudié l’effet d’intervention de l’asiaticoside. Les résultats ont montré que les niveaux d’expression de la protéine morphogénétique osseuse 7 (BMP7) et de la protéine p-Smad1/5 dans le tissu pulmonaire des souris WT et des souris A2AR-/- étaient significativement élevés, ce qui suggère que l’asiaticoside peut réduire le degré de fibrose pulmonaire en augmentant la régulation de la voie de signalement BMP7/p-Smad1/5 à travers A2AR. Ainsi, l’asiaticoside peut réduire le degré de fibrose dans divers tissus et organes tels que le poumon, le foie, les reins et le cœur. Son mécanisme d’action est lié à la régulation vers le bas de l’expression TGF-β1, CTGF, ALT, asiaticoside T et Hyp.
3 effet anti-inflammatoire et mécanisme d’asiaticoside
La voie de signalisation NF-κB est étroitement liée aux réponses inflammatoires et joue un rôle important dans la régulation des réponses inflammatoires cellulaires. Lorsque les cellules sont stimulées, le NF-κB peut être activé, ce qui provoque la surexpression de facteurs inflammatoires en aval de la voie de signalisation NF-κB, tels que le TNF- α, IL- 1β, IL-2, IL-6, l’oxyde nitrique synthase (iNOS), et la cyclooxygénase-2 (COX-2) [26]. Des études connexes ont montré que d’une part, l’asiaticoside peut exercer un effet anti-inflammatoire en inhibant la voie de signalisation NF-κB et en régulant à la baisse l’expression de l’oxyde nitrique (NO), du TNF-α et de l’il-6 [27-28]. D’autre part, l’asiaticoside peut également exercer un effet anti-inflammatoire en régulant la voie de signalisation hémie oxygénase 1 (HO-1), en inhibant la production de facteurs pro-inflammatoires et l’activité de la peroxydase [29].
En tant que tel, il peut réduire la réponse inflammatoire causée par des conditions hypoxiques en inhibant la voie de signalisation NF-κB/p38 [30], et réduire la réponse inflammatoire causée par des conditions hyperoxyques en régulant à la baisse l’expression de microRNA-155 (miR-155) et en régulant à la hausse l’expression de la protéine 1 transductrice de signaux et inhibiteur (SOCS1) [31]. L’effet protecteur de l’asiaticoside sur les lésions des cellules endothéliales induites par la β-amyloïde 1-42 (Aβ1-42) peut être obtenu en inhibant la libération d’il-1, d’il-6 et de TNF-α à partir des cellules endothéliales [32]. Il a également été rapporté que l’asiaticoside peut inhiber l’inflammation allergique induite par les mastocytes, et le mécanisme peut être lié à la voie du récepteur à haute affinité IgE (FcεRI) [33]. Wu et al. [34] ont utilisé la toxine de la grenouille de pluie pour reproduire un modèle souris de pancréatite aiguë légère pour étudier l’effet d’intervention de l’asiaticoside. Les résultats ont montré que l’asiaticoside peut exercer un effet anti-inflammatoire en inhibant la voie TLR4 et en réduisant les niveaux d’expression de la protéine kinase 3 réactive (RIP3) et de la protéine contenant le domaine de la kinase de lignée mixte phosphorylée (p-MLKL) dans le tissu pancréatique. Ainsi, asiaticoside peut améliorer diverses réponses inflammatoires. Son mécanisme d’action est lié à la diminution de l’expression de l’il-6, de l’il-1β et du TNF-α dans la voie NF-κB et à l’inhibition du stress oxydatif.
4. Anti-Alzheimer&#Effet de la maladie et mécanisme de l’asiaticoside
Alzheimer&#La maladie S (ma) est une maladie neurodégénérative courante caractérisée par un dysfonctionnement cognitif progressif. La pathogenèse de la ma s’est révélée liée à la réponse inflammatoire, au dépôt anormal d’aβ et à l’apoptose [35].
Selon la littérature, l’asiaticoside peut soulager la neuroinflammation en réduisant le niveau de NO et l’expression de l’arnm iNOS dans les astrocytes [36]. Cai Pengfei [37] a constaté que l’asiaticoside peut améliorer les dommages causés par Aβ aux cellules endothéliales des veines ombilicales humaines (HUVEC), et que son mécanisme d’action peut être lié à l’inhibition de l’apoptose et à l’expression de l’il-1, de l’il-6 et du tnf-α. Song et al. [38] ont étudié l’effet d’intervention de l’asiaticoside sur l’apoptose induite par aβ1-42 des cellules endothéliales microvasculaires du cerveau humain (hBMECs). Les résultats ont montré que l’asiaticoside peut inhiber l’apoptose des hBMECs, et que le mécanisme d’action est lié à l’inhibition de la voie de signalisation TLR4/NF-κB, à l’expression de TLR4, au facteur de différenciation myeloïde 88 (MyD88), au facteur de nécrose tumorale associé au récepteur 6 (TRAF6), à la protéine p-NF-κB p65 et à la translocation nucléaire de NF-κB, ainsi qu’à l’expression de TNF-α et d’il-6.
Extrait de Centella asiatica can regulate the production of Aβ before neuropathy, thereby preventing the occurrence of AD [39]. Centella asiatica extract has a protective effect on HUVEC damage caused by Aβ1-42, and its mechanism of action may be related to up-regulating Bcl-2 expression and down-regulating Bax expression [40]. Xu et al. [41] found that aspertilloside has a significant reversing effect on 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced AD, and its mechanism of action is related to the increase in the Bcl-2/Bax ratio. Aspertilloside also has strong blood-brain barrier penetration and has the potential to treat neurodegenerative diseases [42]. Thus, asiaticoside can improve AD, and its mechanism of action is related to the inhibition of HU-VEC apoptosis, the activity of the TLR4/NF-κB signaling pathway, and the expression of the inflammatory factors IL-1, IL-6, and TNF-α.

5. L’effet et le mécanisme de asiaticoside dans l’amélioration de l’apprentissage et de la mémoire
Centella asiatica extract can improve learning and memory in mice, and its mechanism of action may be related to reducing the deposition of Aβ in hippocampal tissue and upregulating the expression of synaptophysin (SYN) protein [43-44]; it may also be related to upregulating the expression of peroxisome proliferator-activated γ receptor (PPARγ) protein and downregulating the expression of inflammatory factors IL-6, TNF-α, and IL-1 [45]. Related studies have found that asiaticoside also has a good preventive effect on cognitive dysfunction in diabetes, and its mechanism of action may be related to the regulation of oxidative stress and the PI3K/Akt/NF-κB pathway [46].
6. Effet antidépresseur et mécanisme d’asiaticoside
Wang et al. [47] ont utilisé des souris modèles de stress doux chronique (CMS) pour étudier l’effet antidépresseur de l’asiaticoside. Les résultats ont montré que l’asiaticoside peut exercer un effet antidépresseur en régulant la voie de signalisation cAMP/ protéine kinase A (PKA). Une autre étude a révélé que l’asiaticoside peut exercer un effet antidépresseur en activant la voie de signalisation du facteur neurotrophique dérivé du cerveau (BDNF) [48]. Hou et al. [49] ont comparé les effets antidépresseurs de l’asiaticoside et d’une formule asiaticoside-bornéol (FAB), et ont constaté que les deux ont un certain effet antidépresseur, le FAB étant plus efficace que l’asiaticoside. FAB a également un effet plus significatif sur l’augmentation de l’expression BDNF et sérotonine (5-HT).
7 l’effet et le mécanisme d’asiaticoside dans l’inhibition de l’hyperplasie de cicatrice et la réparation des dommages de peau
Des études ont révélé que l’asiaticoside a des avantages uniques dans l’inhibition de la prolifération des cicatrices et la réparation des dommages de la peau: d’une part, asiaticoside peut améliorer l’activité de migration cellulaire et augmenter le taux de cicatrisation de la plaie [50-51]; D’autre part, l’asiaticoside peut inhiber la prolifération des fibroblastes et la synthèse du collagène, inhiber la prolifération des cicatrices [52]. Des expériences In vitro ont montré que le mécanisme par lequel l’asiaticoside inhibe la prolifération des fibroblasts cicatriciaux peut être lié à l’inhibition de l’expression des protéines impliquées dans la voie de signalisation RhoA/Rho kinase
Wu Yanwen [58] a établi un modèle profond de rat brûlé au deuxième degré et est intervenu avec asiaticoside. Les résultats ont montré que les niveaux d’expression de cycline et d’antigène nucléaire cellulaire proliférant (PCNA) dans le tissu cutané de la plaie de rat étaient élevés. En même temps, l’asiaticoside peut inhiber une réponse inflammatoire excessive en inhibant la translocation nucléaire de la protéine NF-κB p65, favorisant ainsi la cicatrisation des plaies et raccourcissant le temps de cicatrisation. Zhu et al. [59] ont constaté que les nanofibres coaxiales chargées en asiaticoside peuvent favoriser la cicatrisation des brûlures profondes du deuxième degré chez les rats en régulant plus haut l’expression du VEGF, du PCNA et des molécules d’adhérence des cellules endothéliales (CD31) et en dérégulant l’expression du tnf-α et de l’il-6. De plus, le rôle de l’asiaticoside aux différents stades de la réparation de la plaie est différent: il peut favoriser la prolifération des cicatrices pendant la phase proliférative de la réparation de la plaie, mais inhiber la formation de cicatrices pendant la phase plastique de la réparation de la plaie [60]. Une autre étude a révélé que l’asiaticoside peut également favoriser la production de protéine chimiotactique monocyte 1 (MCP-1) pour favoriser la cicatrisation des plaies [61].
Nie et al. [62] found that the asiaticoside complex can reduce the inflammatory response in the wound of rats with diabetic skin ulcers (DCU) model, inhibit bacterial growth in the wound, promote wound healing, and upregulate the expression of VEGF, iNOS, endothelial nitric oxide synthase (eNOS) and CD34. The mechanism of action is related to downregulating the Wnt/β-catenin signaling pathway. Free skin flaps are a common means of skin burn and surgical repair. A skin flap is selected according to the skin defect, an area similar to the damaged skin is selected, and the flap is then transferred to the defect area for repair to achieve the purpose of repairing the skin defect [63]. A study found that asiaticoside can increase the survival area of skin flaps in rats, and the mechanism of action may be related to up-regulating the expression of superoxide dismutase (SOD) and VEGF and down-regulating the expression of inflammatory factors [64]. It has also been found that Centella asiatica-sodium alginate repair patches [65] and Centella asiatica nanoemulsions [66] prepared from asiaticoside have a good repair effect on skin damage.
Cela montre que l’asiaticoside peut inhiber l’hyperplasie des cicatrices et réparer les dommages de la peau. Son mécanisme d’action est lié à l’inhibition de l’expression de collagène de types I et III et de TNF-α, IL-6, et IL-1β, ainsi que l’activité de la voie de signalisation Wnt/ β-caténine, et à l’augmentation de l’expression de TGF-β1, VEGF, iNOS, et MCP-1.
8 l’effet et le mécanisme d’amélioration de l’asiaticoside sur les lésions hépatiques, pulmonaires et rénales
Des études ont montré que l’asiaticoside a un effet amélioré sur les dommages pulmonaires induits par les sepsies et les lésions rénales aiguës dans la sepsis. D’une part, l’asiaticoside peut inhiber l’activité des voies de signaux MAPK et NF-κB en augmentant l’expression de PPAR-γ, améliorant ainsi les lésions pulmonaires [67]. D’autre part, la saponine de centella asiatica peut améliorer les lésions rénales en régulant vers le bas l’expression de l’il-6 dans le sérum et l’expression de la protéine iNOS dans le tissu rénal [68]. Zhang et al. [69] ont utilisé une souris modèle de lésions hépatiques induites par le lipopolysaccharide/ d-galactosamine et sont intervenus avec la saponine de centella asiatica. Les résultats ont montré que l’asg peut améliorer les lésions hépatiques en inhibant l’expression du TNF-α et du MAPK. En outre, Wang et al. [70] ont constaté que l’asg peut améliorer les lésions rénales chez les rats atteints d’insuffisance rénale, et le mécanisme peut être lié à une augmentation de l’expression d’arnm de la synaptophysine, des endorphines et de la podocine et à une diminution de l’expression d’arnm de la protéine junctionnelle.
Dang et al. [71] ont étudié l’effet de l’asiaticoside sur l’amélioration des lésions pulmonaires causées par l’hyperoxye au moyen d’expériences in vitro et in vivo. Les résultats ont montré que l’asiaticoside peut réduire les niveaux de myélooperoxydase (MPO) et de malondialdéhyde (MDA) dans le sérum de rats présentant des modèles de lésions pulmonaires, ainsi que les niveaux de TNF-α, IL-1β et IL-6, et augmenter la capacité antioxydant totale (TAOC), afin d’exercer son effet sur l’amélioration des lésions pulmonaires chez les rats. D’autres expériences in vitro utilisant des cellules alvéolaires de type II (AEC II) isolées de tissus pulmonaires de rat ont montré que l’asiaticoside peut inhiber significativement l’apoptose des cellules AEC II. Le mécanisme d’action peut être lié à une augmentation de l’expression du facteur nucléaire E2-related factor 2 (Nrf2) et HO-1. Ainsi, l’asiaticoside peut améliorer les dommages au foie, aux poumons et aux reins, et son mécanisme d’action est lié à l’inhibition du stress oxydatif et de l’inflammation et à l’amélioration de la capacité antioxydante.
9 autres
Des études connexes ont révélé que l’asiaticoside peut être utilisé pour prévenir les dommages à l’adn induits par les rayonnements: après le traitement par rayonnement, les souris traitées avec l’asiaticoside ont augmenté les taux de survie et les taux sériques de TAOC, les taux de TGF-β1 ont été réduits, et le mécanisme d’action peut être lié à une capacité antioxydante accrue [72]. Luo et coll. [73] ont étudié l’effet d’intervention de l’asiaticoside sur des rats présentant un modèle de lésion de la moelle épinière (SCI). Les résultats ont montré que les niveaux d’inos, de TNF-α, d’il-1β, d’il-6 et de NF-κB p65 dans le sérum de rat étaient réduits, et les niveaux de MDA, de SOD, de glutathion réduit (GSH) et de glutathion peroxydase (GSH-Px) étaient augmentés. D’autres études ont révélé que le niveau d’expression de p38MAPK dans le tissu de la moelle épinière du rat était significativement réduit, ce qui indique que l’asiaticoside peut améliorer les lésions de la moelle épinière chez les rats par le biais d’antioxydant, d’anti-inflammatoire et d’inhibition de la voie de signalisation p38MAPK. Fan et al. [74] ont constaté que l’ascorboside peut restaurer la fonction motrice chez les rats atteints de SCI et améliorer les dommages aux neurones de la moelle épinière. Le mécanisme d’action est lié à l’expression réduite de la protéine TNF-α et c-ascorboside p-ascorboside e-3 dans le tissu de la moelle épinière. Eka et al. [75] ont étudié l’effet hypoglycémique de l’ascorboside sur les souris diabétiques. Les résultats ont montré qu’après une intervention avec l’asiaticoside, les taux de glycémie à jeun et d’hémoglobine glycosylée chez les souris modèles diabétiques ont été réduits, et le taux d’insuline a été augmenté, ce qui suggère que l’asiaticoside pourrait avoir un bon effet thérapeutique sur le diabète.
10 Conclusion
Ces dernières années, avec l’approfondissement de la recherche sur l’asiaticoside par des chercheurs au pays et à l’étranger, les principaux effets pharmacologiques et mécanismes de l’asiaticoside ont été initialement clarifiés: l’asiaticoside peut exercer des effets anti-tumoraux en inhibant la prolifération des cellules tumorales et en induisant l’apoptose des cellules tumorales; Il peut exercer des effets anti-fibrose en régulant vers le bas les niveaux de TGF-β1, CTGF, ALT, asiaticoside T, et les niveaux de Hyp, il exerce un effet anti-fibrose; Il exerce un effet anti-inflammatoire en régulant vers le bas l’expression de l’il-6, de l’il-1β et du TNF-α dans la voie de signalisation NF-κB et en inhibant le stress oxydatif; Il exerce un effet anti-AD en inhibant l’apoptose des cellules endothéliales vasculaires, l’activité de la voie de signalisation TLR4/NF-κB et l’expression des facteurs inflammatoires IL-1, IL-6 et TNF-α; Il exerce un effet anti-AD en inhibant l’expression du collagène de types I et III et de l’expression de TNF-α, d’il-6, d’il-1β et de l’activité de la voie de signal Wnt/ β-caténine, en surgulant TGF-β1, VEGF, iNOS, expression MCP-1, et en jouant un rôle dans l’inhibition de l’hyperplasie de cicatrice et la réparation des dommages de peau; En médiant la voie du signal MAPK/NF-κB, inhiber l’expression de MDA, iNOS, TNF-α, IL-6 et améliorer la capacité antioxydant, en exerçant un rôle dans l’amélioration des dommages au foie, aux reins et aux poumons.
À l’heure actuelle, la plupart des recherches sur l’asiaticoside ' S effets antitumoraux se concentre sur les mécanismes moléculaires des cellules in vitro, tandis que les études pharmacologiques basées sur des expériences in vivo font défaut. Par conséquent, les recherches antitumorales ultérieures peuvent se concentrer sur des modèles animaux. En outre, la recherche sur l’asiaticoside 's anti-inflammatory and anti-fibrosis effects most of the research focuses on the expression of related proteins, lacking research on the mechanism of action of specific signal pathways. Therefore, subsequent research can be conducted on the pharmacological effects and mechanisms of Centella asiatica extract from the perspective of signal pathways.
Références:
[1] [traduction] Commission nationale de la pharmacopée. Pharmacopée du peuple ' république de Chine: partie I [S]. Édition 2020. Beijing: Chine Medical Science and Technology Press, 2020: 296.
[2] Weng Xiaoxiang, Huang Wenwu, Kong Deyun. Progrès de la recherche sur les composants triterpénoïdes et les activités pharmacologiques de Centella asiatica [J]. Chinese Journal of Pharmaceutical Industry, 2011, 42 (9): 709-716.
[3] Li Yanan, Li Zhihui, Huo Lini, et al. Recherche sur la composition chimique de Centella asiatica[J]. Guangxi Traditional Chinese Medicine, 2015, 38(2): 78-80.
[4] DING Y, ZHANG Z, WANG S. progrès de la recherche d’asiaticoside [J]. Shizhen National Medicine, 2016, 27(3): 697-699.
[5] [traduction] ZHOU X, KE C L, LV Y, et al. L’asiaticoside supprime la prolifération cellulaire en inhibant la voie de signalisation NF-κB dans le cancer colorectal [J]. Int J Mol Med, 2020, 46(4):
De 1525 à 1537.
[6] HE Y G, PENG X H, ZHENG L, et al. L’asiaticoside inhibe la transition épithélial-mésenchique et les propriétés de type cellules souches des cellules PANC-1 du cancer du pancréas en bloquant l’activation de p65 et p38MAPK[J]. J Gastrointest Oncol, 2021, 12(1): 196-206.
[7] Zeng Manhong, Chen Lingfeng. Étude sur l’effet de l’asiaticoside sur la lignée de cellules cancéreuses gastriques humaines SGC-7901 [J]. Journal of Jiangxi College of Traditional Chinese Medicine, 2011, 23(6): 57-59.
[8] Liu Chenxu, Qin Sida, Xu Tao, et al. Effets de l’asiaticoside sur l’apoptose et les niveaux d’expression des protéines VEGF et bFGF dans les cellules MCF-7 du cancer du sein [J]. Advances in Modern Biomedicine, 2018, 18(7): 1314-1317.
[9] Wu Qian, Jiang Bo. L’effet de l’asiaticoside sur l’apoptose des cellules Saos-2 de l’ostéosarcome humain [J]. Modern Medicine and Clinical, 2019, 34(8): 2262-2267.
[10] MA Y, WEN J, WANG J, et al. L’asiaticoside antagonise la prolifération et la résistance médicamenteuse chimiothérapeutique dans les cellules du carcinome hépatocellulaire (CHC) [J]. Moniteur Med Sci, 2020, 26: e924435.
[11] Yang Lianjun. Bcl-2, Bax et apoptose des cellules tumorales [J]. Chinese Journal of Cancer Biotherapy, 2003, 3 (3): 232-234.
[12] Pan Jinli. Étude sur le mécanisme de l’apoptose induisant l’asiaticoside des cellules cancéreuses de l’ovaire humain A2780 [J]. Journal de médecine traditionnelle chinoise, 2018, 33(4): 521-524.
[13] AL-SAEEDI F J. étude de la cytotoxicité de l’asiaticoside sur les rats et les cellules tumorales [J]. BMC Cancer, 2014, 14(1): 220.
[14] AL-SAEEDI F J, BITAR M, PARIYANI S. effet de l’asiaticoside sur l’absorption de 99mtc-tétrofosmin et de 99mTc- sestamibi dans les cellules MCF- 7 [J]. J Nucl Med Technol, 2011, 39 (4): 279-283.
[15] Li Y C, WANG H H, ZHANG R, et al. L’activité antitumorale de l’asiaticoside contre les cellules cancéreuses résistantes aux médicaments à myélome multiple est médiée par l’induction d’autophagie, l’activation de caspases efficaces et l’inhibition de la migration cellulaire, de l’invasion et de la voie de signalisation STAT-3 [J]. Med Sci Monit, 2019, 25: 1355-1361.
[16] Qi Luyu. Effets de l’asiaticoside et du madecassoside sur les fibroblastes embryonnaires humains in vitro [D]. Taiyuan: université de médecine du Shanxi, 2012.
[17] Qian Xingjia. Étude expérimentale sur l’effet d’intervention du matrine et de l’asiaticoside sur les fibroblastes pulmonaires humains [D]. Nanjing: université de médecine traditionnelle chinoise de Nanjing, 2012.
[18] Ye Wenjing, Zhu Xiaochun, Wang Xiaobing, et al. L’asiaticoside atténue la fibrose mésenchymateuse pulmonaire induite en inhibant l’inflammation et la fibrose [J]. Chinese Journal of Pharmacology and Toxicology, 2016, 30 (1): 29-37.
[19] Zhu Dewei, Shen Yunhui. Effet protecteur de l’asiaticoside sur la fibrose pulmonaire induite par le mycophénolate mofétil chez la souris [J]. Journal of Shanghai University of Traditional Chinese Medicine, 2020, 34 (6): 41-46.
[20] Wang Ce. Étude sur l’effet de l’asiaticoside sur la fibrose rénale chez les rats présentant une obstruction urétérale unilatérale [J]. Chinese Medicine Clinical Research, 2017, 9(20): 1-4.
[21] Wang Ce. Étude expérimentale sur l’effet de l’asiaticoside sur la fibrose du myocarde chez les rats atteints d’infarctus du myocarde [J]. Chinese Journal of Biochemical Drugs, 2014, 34(8): 19-22.
[22] Zhao Sixia, Zhang Ruzong, Yang Subei. Étude sur l’effet de l’asiaticoside sur la fibrose immunitaire du foie chez le rat [J]. Chinese Journal of Modern Applied Pharmacy, 2017, 34(5): 666-670.
[23] Ji Qijian, Xu Tie. Effet protecteur de l’asiaticoside sur la fibrose pulmonaire induite par la bleomycine chez le rat [J]. Modern Medicine, 2014, 42 (11): 1304-1309.
[24] LUO J, ZHANG T, ZHU C W, et al. L’asiaticoside pourrait atténuer la fibrose pulmonaire induite par la bleomycine en activant la voie de signalisation cAMP et RAP1 assistée par A2AR [J]. J Cell Mol Med, 2020, 24(14): 8248-8261.
[25] ZHANG T, DAI J Y, YE W J, et al. Asiaticoside atténue la fibrose pulmonaire induite par la bleomycine chez les souris A2AR-/- en favorisant la voie de signalisation BMP7/Smad1/5 [J]. Biochem Biophys Res Commun, 2020, 527(3): 662-667.
[26] Guo Limin, Lv Jieli, Zhang Laibin. Progrès de la recherche sur le mécanisme anti-inflammatoire des sesquiterpénoïdes naturels [J]. Chinese Journal of Traditional Chinese Medicine, 2018, 43(20): 3989-3999.
[27] Linghu Lang, Jia Youjing, Chen Jing et al. L’effet de l’asiaticoside sur les lésions inflammatoires induites par les lipopolysaccharides chez les astrocytes [J]. Journal du collège médical de Zunyi, 2018, 41(2): 160-164.
[28] Jiang Chengcheng, Zhao Hengguang, Wu Yamei. Effets de l’asiaticoside sur l’activation induite par les lipopolysaccharides du facteur de transcription nucléaire κB et la réponse inflammatoire dans les cellules RAW264.7 [J]. Chinese Journal of Respiratory and Critical Care Medicine, 2010, 9 (4): 422-425.
[29] WAN J Y, GONG X, JIANG R et al. Effets antipyrétiques et anti-inflammatoires de l’asiaticoside chez le rat traité par lipopolysaccharide grâce à la régulation de l’hémie oxygénase-1 [J]. Phytother Res, 2013, 27(8): 1136-1142.
[30] Zhang T, Cai HJ, Yang L, et al. L’ Asperulosid réduit l’ hypertension pulmonaire hypoxique chez la souris en inhibant la voie NF-κB/p38. Journal chinois de physiologie pathologique, 2019, 35(9): 1600-1607.
[31] MAI L J, FU X X, HE G, et al. Effet de l’asiaticoside sur la dysplasie bronchopulmonaire induite par l’hyperoxye chez les rats néonataux et mécanisme associé [J]. Zhongguo Dang Dai Er Ke Za Zhi, 2020, 22(1): 71-76.
[32] ZHANG Z, CHEN L J, SUN Y H, et al. Effets de l’asiaticoside sur l’expression de facteurs inflammatoires dans les cellules endothéliales induites par Aβ1-42 [J]. Chinese Journal of Biochemical Drugs, 2015, 35(1): 46-48.
[33] JIANG J Z, YE J, JIN G Y, et al. L’asiaticoside attérit l’inflammation allergique en abrogeant la dégranulation des mastocytes [J]. J Agr Food Chem, 2017, 65(37): 8128 — 8135.
[34] WU K Y, YAO G H, SHI X L, et al. L’asiaticoside améliore la nécrose cellulaire acinaire dans la pancréatite aiguë par la voie du récepteur toll type 4 [J]. Mol Immunol, 2020, 130: 122-132.
[35] Liu Chang, Meng Xianyong, Dong Xiaohua. La pathogenèse de l’alzheimer' S maladie et progrès de la recherche sur les médicaments thérapeutiques [J]. Journal of Neuropharmacology, 2020, 10(4): 36-40.
[36] Mo Jucai, Ying Na, Xu Changliang et al. Effets de l’asiaticoside sur la libération de médiateurs inflammatoires des astrocytes induits par aβ [J]. Zhejiang Traditional Chinese Medicine Journal, 2012, 47(11): 835-837.
[37] CAI P. effets et mécanisme de l’asiaticoside sur les lésions des cellules endothéliales induites par aβ1-42 [D]. Luzhou: collège médical de Luzhou, 2014.
[38] SONG D, JIANG X, LIU Y et al. L’asiaticoside atténue l’inhibition de la croissance cellulaire et l’apoptose induite par aβ1-42 en inhibant la voie de signalisation TLR4/NF- κB dans les cellules endothéliales asculaires du cerveau humain [J]. Avant Pharmacol, 2018, 9: 28.
[39] HOSSAIN S, HASHIMOTO M, KATAKURA M, et al. Valeur médicinale de asiaticoside pour Alzheimer' la maladie S évaluée à l’aide de la spectroscopie de corrélation de fluorescence à détection de molécule unique, de la microscopie à balayage laser, de la microscopie électronique à transmission et de l’attelage in silico [J]. BMC complément Altern Med, 2015, 15(1): 118.
[40] ZHANG Z, CAI P, ZHOU J, et al. Effets de l’asiaticoside sur l’apoptose des cellules endothéliales des veines ombilicales humaines induite par Aβ1-42 [J]. Int J Clin Exp Med, 2015, 8(9): 15828-15833.
[41] XU C L, WANG Q Z, SUN LM, et al. Asiaticoside: atténuation de la neurotoxicité induite par le MPTP dans un modèle de parkinsonisme chez le rat par le maintien de l’équilibre redox et la régulation du rapport Bcl-2/Bax [J]. Pharmacol Biochem Behav, 2012, 100(3): 413-418.
[42] HANAPI NA, MOHAMAD A S, ABDULLAH J M, et al. Perméabilité barrière hémato-encéphalique de l’asiaticoside, du madecassoside et de l’acide asiatique dans le modèle de cellules endothéliales du cerveau porcin [J]. J Pharm Sci, 2020, 110(2): 698-706.
[43] Ying N, Yin ZJ, Yu H et al. Effet d’intervention de l’asiaticoside sur la fonction cognitive chez les souris atteintes du modèle du diabète [J]. Zhejiang Journal of Integrated Traditional and Western Medicine, 2014, 24(3): 203-206, 184.
[44] Wang Xiaojing, Wang Dongxing, Xu Chunjing, et autres. Effet thérapeutique de asiaticoside sur Alzheimer' S maladie [J]. Chinese Journal of Pharmaceutical Sciences, 2016, 6(13): 37-39,92.
[45] HUANG Y L. corrélation entre le PPARγ et l’expression des facteurs inflammatoires après injection intrapéritonéale d’aβ1-42 chez le rat et étude d’intervention de l’asiaticoside [D]. Luzhou: université médicale du sud-ouest, 2017.
[46] YIN Z J, YU H Y, CHEN S, et al. Asiaticoside atténue les déficits cognitifs induits par le diabète en régulant la voie PI3K/Akt/NF-κB [J]. Behav Brain Res, 2015, 292: 288-299.
[47] WANG L Q, GUO T, GUO Y F, et al. Asiaticoside produit un effet de type antidépresseur dans un modèle de dépression chronique imprévisible de stress léger chez la souris, impliquant l’inversion de l’inflammation et la voie de signalisation PKA/pCREB/BDNF [J]. Mol Med Rep, 2020, 22(3): 2364-2372.
[48] LUO L, LIU X L, MU R H, et al. La signalisation BDNF hippocampique restaurée avec un traitement Asiaticoside chronique chez des souris dépressives [J]. Brain Res Bull, 2015, 114: 62-69.
[49] HOU T H, LI X B, PENG C S. Borneol améliore les effets antidépresseurs de l’asiaticoside en favorisant sa distribution dans le cerveau [J]. Neurosci Lett, 2017, 646: 56-61.
[50] WARINTORN R, CHIRANAN K, et al. Extraction dépigmentée de centella asiatica par prétraitement avec un fluide de dioxyde de carbone supercritique pour application cicatrisant des plaies [J]. Processus, 2020, 8(3): 277.
[51] LEE J H, KIM H L, LEE M H, et al. Asiaticoside améliore la migration cellulaire normale de la peau humaine, l’attachement et la croissance in vitro modèle de cicatrisation des plaies [J]. Phytomedicine, 2012, 19(13): 1223-1227.
[52] Ouyang Danwei, Shao Yan, Kong Deyun et autres. Effet inhibiteur de l’asiaticoside et de ses constituants chimiques sur la prolifération des fibroblastes cicatriciels [J]. World Clinical Drugs, 2014, 35(4): 215-220.
[53] Dai Libing, Pan Shu, Shen Yan et al. Effets de l’asiaticoside sur le facteur de croissance du tissu conjonctif et les signaux de régulation RhoA/ROCK-I dans les fibroblastes de cicatrices prolifératives [J]. Chinese Journal of Pharmacy, 2010, 45 (14): 1067-1072.
[54] Li Shanshan. Effets de l’asiaticoside sur la prolifération des fibroblastes cicatriciels et l’expression du collagène et de l’arnm TGF-β1 [D]. Wuhan: université de médecine traditionnelle chinoise du Hubei, 2011.
[55] Zhou Z, Xiong W, Huang X et al. Effets de l’asiaticoside sur les fibres de collagène et l’expression de TGF-β1 dans les tissus cicatriciels prolifératifs des oreilles de lapin [J]. Chinese Journal of Aesthetic Medicine, 2015, 24(21): 32-37.
[56] HUANG J, ZHOU X B, XIA L L, et al. Inhibition de la formation de cicatrices hypertrophiques avec un traitement Asiaticoside oral dans un modèle de cicatrices d’oreille de lapin [J]. Plaie Int J, 2021 [2021-06-12].
[57] HU R, JIANG R. Effects of asiaticoside on wound healing and expression of heat shock protein 47 in cicatrice formation in rats with burns [J]. Zhejiang Medical Journal, 2020, 42(1): 36-38, 101.
[58] WU Y. Research on the mechanism of asiaticoside in the treatment of burn wounds [D]. Nanjing: université de médecine traditionnelle chinoise de Nanjing, 2019.
[59] ZHU L F, LIU X Y, DU L et al. Préparation de nanofibres d’asiaticosi - déchargées par électrofilage coaxial et leur effet sur les brûlures profondes d’épaisseur partielle [J]. Biomed Pharmacother, 2016, 83: 33-40.
[60] Chen L, Wang T, Liu M, et al. Effets de l’asiaticoside sur l’intervention à différents stades de la réparation des plaies et l’expression immunohistochimique du facteur de transformation β1 et Smad3 de croissance dans les plaies d’oreille de lapin [J]. Hebei médecine traditionnelle chinoise, 2019, 41(10): 1532-1535, 1539.
[61] HOU Q, LI M, LU Y H, et al. Brûler les propriétés curatives de blessure d’asiaticoside et madec Assoside [J]. Exp Ther Med, 2016, 12(3): 1269-1274.
[62] NIE X U, ZHANG H, SHI X J et al. Le gel d’oxyde nitrique iaticoside de Centella asiatica accélère la guérison des ulcères cutanés diabétiques en activant la voie de signalisation Wnt/ β-caténine [J]. Int Immunopharmacol, 2020, 79: 106109.
[63] CHENG X F, WANG Z Y. Application de clapet cutané local dans la réparation des défauts de la peau du visage [J]. World Latest Medical Information Digest, 2017, 17(11): 53.
[64] FENG X G, HUANG D, LIN D S, et al. Effets du traitement asiatico-coside sur la survie des rabats cutanés aléatoires chez les rats [J]. J Invest Surg, 2021, 34(1): 107-117.
[65] Guo Jiaqi, Guo Minhui, Kong Songzhi et autres. Préparation du patch réparateur de l’alginate de glycoside de sodium de Centella asiatica et de son effet réparateur de plaies [J]. Chinese Herbal Medicine, 2020, 51(19): 4934-4942.
[66] PENG Q, LI J Y, LI H M, et al. Préparation et évaluation de la qualité des nanolaits asiaticoside [J]. Journal chinois des nouveaux médicaments, 2019, 28(10): 1276-1280.
[67] ZHANG LN, ZHENG JJ, ZHANG L, et al. Effets protecteurs de l’asiaticoside sur les lésions pulmonaires septiques chez la souris [J]. Exp Toxicol Pathol, 2011, 63(6): 519-525.
[68] ZHENG J J, ZHANG L N, WU M J et al. Effets protecteurs de l’asiaticoside sur les lésions rénales aiguës induites par la sepsie chez la souris [J]. Zhongguo Zhong Yao Za Zhi, 2010, 35(11): 1482-1485.
[69] ZHANG L, LI H Z, GONG X et al. Effets protecteurs de l’asiaticoside sur les lésions hépatiques aiguës induites par le lipopolysac- charide/D-galactosamine chez la souris [J]. Phytomedicine, 2010, 17(10): 811-819.
[70] WANG Z, LIU J T, SUN W S. effets de l’asiaticoside sur les niveaux de protéines du cytosquelette podocytaire et de protéines du diaphragme de fente rénale dans la néphropathie du rat induite par l’adriamycine [J]. Life Sci, 2013, 93(8): 352-358.
[71] DANG J W, LEI X P, LI Q P, et al. L’asiaticoside atténue les lésions pulmonaires induites par l’hyperoxyde in vitro et in vivo [J]. Iran J Basic Med Sci, 2019, 22(7): 797-805.
[72] SHEN H Y, ZHU F, LI J S, et al. Effet protecteur de l’asiaticoside sur l’inhibition de la prolifération induite par les rayonnements et les dommages à l’adn des fibroblastes et la mort de souris [J]. Open Life Sci, 2020, 15(1): 145-151.
[73] LUO Y, FU C F, WANG Z Y, et al. L’asiaticoside atténue les effets des lésions de la moelle épinière par des effets antioxydants et anti-inflammatoires, et l’inhibition du mécanisme p38-MAPK [J]. Mol Med Rep, 2015, 12(6): 8294-8300.
[74] FAN L, LI X B, LIU T. Asiaticoside inhibe l’apoptose neuronale et favorise la récupération fonctionnelle après une lésion de la moelle épinière chez le rat [J]. J Mol Neurosci, 2020, 70(12): 1988-1996.
[75] EKA F, ELIN Y S, ELFAHMI E, et al. Activité antidiabétique de l’extrait de fractions et du composé Asaticoside isolé de Centella Asiatica Linn. Feuilles chez des souris diabétiques induites par l’alloxan [J]. Asian J Pharm Sci, 2017, 10(10): 268-272.
-
Précédent précédent
Quels sont les avantages de Centella Asiatica extrait Asiaticoside?
-
Suivant:
Étude sur l’extrait de Gotu Kola Asiaticoside pour la guérison des plaies


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




