Quel est l’usage médicinal de la poudre de curcuma?
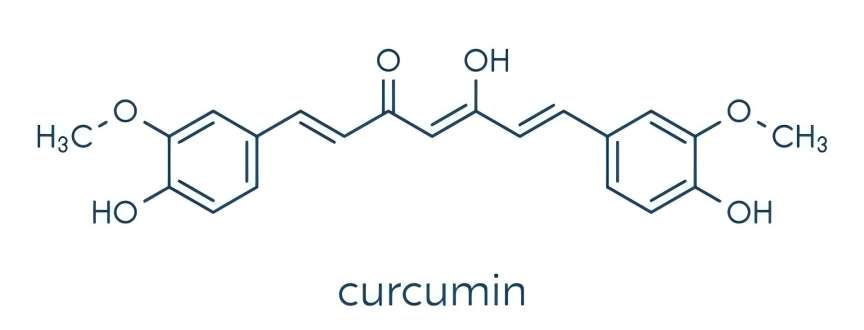
La curcumine is a natural phenolic active ingredient dansthe rhizome De laturmeric Et en plusis the madansphenolic substance extracted À partir dethe rhizome De laturmeric. Turmeric can be divided into three curcuminoids, namely bisdemethoxycurcumin, demethoxycurcumin Et en plusferulic acid methyl ester (Figure 1). The three curcuminoids have similar structures and similar pharmacological effects, including antibacterial, antioxidant, anti-apoptotic, anti-tumor and anti-metastasis effects [1,2]. Turmeric is used as an herbal remedy for a variety De laailments [3] and is also used as a spice, food coloring and preservative. Curcumin is not only used as an anti-inflammatory agent, but also to treat gastrointestinal disorders such as indigestion, flatulence, diarrhea and stomach and duodenal ulcers [4,5].
1 Composition chimique de la curcumine
La curcumine est un composé polyphénolique à structure dicétone. Il contient un squelette spécial de 1,7-dioxane et se compose de deux phénols o-méthylés et β-dicétone. En raison de la présence de plusieurs groupes actifs tels que les liaisons phénoliques hydroxyle, carbonyle et doubles dans la molécule de curcumine, les propriétés chimiques de la curcumine sont relativement actives. Il a été signalé que les propriétés antioxydantes plus fortes de la curcumine pourraient être dues à la chélation des métaux de transition entre l’o-méthoxy et le dikétophorol [6]. La curcumine contient deux tautomères: les formes céto et enol. Le premier est stable dans les phases solide et liquide et apparaît de couleur brun-rougeâtre; Ce dernier composant biologiquement actif est présent dans des conditions acides et neutres sous la forme de la dicétone 1,7-bis(4-hydroxy-3-méthoxyphényl) -1,6-heptadiène-3,5-dione et semble jaune brillant, de sorte qu’il peut être utilisé comme indicateur d’acide chimique [7,8].
Des études ont montré que curcumin can exert a variety of beneficial effects in the gastrointestinal tract, such as preventing reflux esophagitis, Barrett&#Les lésions des muqueuses gastriques induites par l’œsophage et les anti-inflammatoires non stéroïdiens (ains). La curcumine peut empêcher l’l’invasiondes cellules cancéreuses gastriques et la prolifération de divers facteurs cancérogènes, tels que p23 et le récepteur 2 du facteur de croissance épidermique humain. Au cours des dernières années, la curcumine a reçu une attention considérable dans le traitement du Le stressoxydatif et des maladies liées à l’inflammation, y compris la gastrite, les ulcères gastriques et le Le cancergastrique. La curcumine peut également être utilisée pour améliorer les maladies liées à l’âge telles que l’athérosclérose, le diabète, les maladies cardiovasculaires et les maladies rénales chroniques. Des dérivés du curcuma ont été trouvés pour soulager l’inflammation chronique comme l’arthrite, l’uvéite et les maladies inflammatoires de l’intestin [9]. La curcumine a été identifiée comme ayant de fortes propriétés antibactériennes, avec des effets antimicrobiens à large spectre contre une gamme de bactéries [10]. La curcumine s’est avérée efficace dans le traitement de Helicobacter pylori lorsqu’elle est utilisée seule ou en combinaison avec d’autres antibiotiques existants. Il a été démontré que la curcumine est un agent antimicrobien à large spectre dans les études in vitro et in vivo, et il a été démontré qu’elle a un effet synergique avec certains antibiotiques lorsqu’elle est utilisée comme traitement d’appoint [11].
Cette revue vise à analyser la composition chimique de la curcumine et à mettre en évidence ses différents effets pharmacologiques.
2 Effets pharmacologiques de la curcumine
2.1 curcuminet et#39; S effet contre Helicobacter pylori
Helicobacter pylori a été découvert pour la première fois en 1983. Il s’agit d’une bactérie pathogène gram-négative hautement mobile, en forme de spirale, mesurant 0,6 hm 3,5 hm. Helicobacter pylori est un cancérogène procaryote pour l’homme reconnu par l’organisation mondiale de la santé et est un agent pathogène principal pour l’homme [12]. En Chine, le taux d’infection de H. pylori est d’environ 56%. De nombreuses maladies gastro-intestinales supérieures sont liées à Helicobacter pylori, telles que le Le cancerde l’estomac, la dyspepsie, la gastrite, les ulcères gastro-intestinaux supérieurs et les maladies gastro-intestinales supérieures [13]. La haute pathogénicité de H. pylori est principalement due à ses divers facteurs de virulence, tels que l’uréase, la cytotoxine A vacuolante (VacA), le gène A associé à la cytotoxine (CagA) et la transpeptidase -glutamyl (HpGGT).
2.1.1 infection à Helicobacter pylori
CagA est une protéine Helicobacter pylori et un important facteur de virulence de H. pylori. Pendant l’infection chronique à H. pylori, le CagA est directement administré aux cellules cibles (p. ex., les cellules épithéliales gastriques) par le système de sécrétion de type IV (T4SS) codé par l’île de pathogénicité cag [14, 15]. La protéine CagA peut fonctionner comme une protéine adaptatrice Gab1 eucaryote et aider à activer certaines voies intracellulaires, telles que la prolifération cellulaire et la migration [16,17]. Après la livraison à la cellule hôte, CagA subit une phosphorylation de tyrosine à son motif EPI-YA de séquence caractéristique (Glu-Pro-Ile-Tyr-Ala) [18]. La protéine de CagA phosphorylée joue un rôle très important dans le déclenchement des voies de signalisation cellulaire et la cause des lésions cellulaires.
L’activité biologique induite par l’acga peut être divisée en trois catégories: la dispersion/phénotype colibri, la rupture des jonctions étroites entre les cellules et l’activation de plusieurs facteurs de transcription qui contrôlent la prolifération cellulaire, l’inflammation et la survie [19]. Par conséquent, par des voies dépendantes de l’acga, H. pylori modifie les signaux intracellulaires des cellules cibles et favorise son infection et sa pathogénicité. Par conséquent, l’infection à H. pylori est un facteur important menant à la gastrite.
La Phosphorylation de la protéine de CagA et l’activation des voies de signalisation en aval sont les principaux moyens par lesquels la protéine de CagA exerce ses effets pathogènes, et le site de la Phosphorylation est le résidu de tyrosine de la protéine de CagA EPIYA motif. Une fois que CagA entre dans la cellule hôte, il est immédiatement phosphorylé par la tyrosine kinase Src non récepteur. 2 à 4 heures après l’infection, la kinase Src peut être inactivée par l’inhibition de la rétroaction de la protéine de CagA phosphorylée à laquelle elle est liée. À ce moment, une autre tyrosine kinase non récepteur, Abl, est activée pour continuer à phosphoryler CagA[20]. La Phosphorylation de différents sites d’epiya provoque le degré de changement de forme cellulaire est également différent, ce qui indique que la Phosphorylation de CagA est strictement contrôlée pendant l’infection par H. pylori. L’interaction entre CagA et les protéines cibles entraîne l’activation de voies de signaux anormales, perturbant ainsi la fonction cellulaire [21].
Le gène codant pour le récepteur de la tyrosine kinase (MET) est un proto-oncogène. La protéine du récepteur transmembranaire MET codée par elle a une activité de tyrosine kinase, donc MET est un membre de la famille des tyrosines kinases récepteurs. Helicobacter pylori induit des réactions précancéreuses proinflammatoires et malignes par la signalisation CagA-MET, induit le mouvement des cellules épithéliales, et MET activé utilise CagA comme protéine adaptatrice, qui induit ensuite la phosphorylation de CagA, ce qui conduit à des voies de phospholipase C (PLC) et MAPK en aval pour réduire le mouvement cellulaire induit par Helicobacter pylori-induit [22]. CagA peut également activer la signalisation MET de manière non phosphorylée, auquel cas un motif conservé dans la région c-terminale de CagA appelé motif de l’activité répétition conservée indépendante de la phosphoinosite (CRPIA) peut interagir avec le MET activé, conduisant à l’activation de la signalisation PI3K/Akt, qui favorise la migration cellulaire et la motility, conduisant finalement à la prolifération cellulaire et aux réponses inflammatoires, Entraînant la prolifération de cellules cancéreuses gastriques après une infection par Helicobacter pylori [23]. Par conséquent, les formes phosphorylées et non phosphorylées de CagA peuvent interagir avec le MET et stimuler les voies de signalisation en aval dans la progression du cancer gastrique.
En outre, l’activation du MET induite par l’infection à H. pylori affecte les cellules immunitaires entourant les cellules cancéreuses gastriques. Il a été rapporté que l’infection par Helicobacter pylori dans les cellules cancéreuses gastriques augmente la production d’exosomes contenant des formes actives de MET [24]. Les Exosomes sont des corps de signalisation extracellulaires qui sont largement produits dans des conditions physiologiques normales et médient la communication entre les cellules eucaryotes. Les cellules tumorales peuvent transférer des facteurs induisant le MET tels que l’il-6, l’akt et le TNF-a par l’intermédiaire d’exosomes, induisant le MET dans les cellules tumorales voisines et induisant ainsi des effets cancérigènes sur l’estomac.
2.1.2 effet antibactérien de la curcumine
Le rôle de la curcumie dans l’infection par Helicobacter pylori est principalement d’inhiber le facteur nucléaire kb induit par Helicobacter pylori, l’amélioration de la chaîne k-lumière des lymphocytes B activés par le facteur nucléaire (NF-KB), la mort cellulaire induite par l’activation (AICD), l’interleukine-8 (IL-8), MMP-3 et MMP-9 dans les cellules épithéliales de l’hôte, empêchant ainsi les réactions inflammatoires [25], voir Figure 2. Des études ont montré que la curcumine est plus efficace contre la COX-2 et le TXA2 que contre la COX-1. La curcumine peut inhiber l’activité de la COX-2 et du TXA2 mais n’affecte pas l’activité de la COX-1. L’effet anti-inflammatoire de la curcumie peut être obtenu en inhibant les principaux médiateurs inflammatoires tels que la cyclooxygénase (COX-1 et COX-2), la lipoxygénase (LOX), le facteur de nécrose tumoral (TNF2), l’interféron (IFN2) et l’oxyde nitrique synthase inductible (iNOS) [26]. Parmi ceux-ci, COX-2, LOX et iNOS sont des enzymes importantes qui médient les réponses inflammatoires [27]. Des études ont montré que la curcumine affecte la phosphorylation de la phospholipase A2 cytosolique et réduit l’expression de la COX-2 en bloquant le métabolisme de l’acide arachidonique, tout en inhibant l’activité catalytique du 5-LOX.
Chez Helicobacter pylori, les composants du système de sécrétion de type IV transportent la protéine CagA dans les cellules épithéliales gastriques. Par la suite, la protéine CagA est phosphorylée. Ce CagA phosphorylé interagit avec la phosphatase SHP-2 de l’hôte, provoquant des réarrangements du cytosquelette et entraînant des changements morphologiques dans la cellule hôte [28].
Des études ont montré que H. pylori exposé à la curcumine pendant 6 heures peut conduire à l’inhibition réversible de la croissance de la bactérie, réduisant efficacement la translocation de CagA [29,30]. En réduisant la translocation de CagA, il peut réduire les réarrangements cytosquelettiques, conduisant à l’inhibition presque complète de la phosphorylation de CagA [31,32]. Ces résultats sont liés à l’effet inhibiteur de la curcumine sur la croissance de H. pylori. Un grand nombre d’études expérimentales chez des souris ont montré que l’administration orale de curcumine peut inhiber de manière significative l’inflammation gastrique causée par l’infection à H. pylori [33,34]. De nombreuses études ont souligné l’effet de la curcumine sur H. pylori. En raison de sa forte activité antibactérienne, la curcumine peut effectivement inhiber la croissance bactérienne, offrant ainsi une nouvelle voie pour le traitement de H. pylori dans le domaine du traitement des maladies [35]. Par conséquent, la curcumine peut être un médicament efficace pour la prévention et le traitement de l’infection à H. pylori.
2.2 effets anticancéreux de la curcumine
Des études ont montré que, par rapport aux patients infectés par des isolats de H. pylori négatifs pour le virus caga-négatif, la colonisation par des isolats de H. pylori positifs pour le virus caga-positif est associée à un risque accru de gastrite grave, d’ulcère gastroduodénale et de cancer de l’estomac [36]. Helicobacter pylori peut initier des voies d’activation anormales des signaux cellulaires. Le CagA phosphorylé peut induire la régulation up de l’expression -énolase en activant la voie de signalisation ERK/MAPK. -énolase est une nouvelle protéine associée aux tumeurs qui est impliquée dans le processus de prolifération tumorale illimitée, provoque l’autophagie cellulaire et induit l’apparition du cancer de l’estomac [37,38]. Ceci prouve en outre le rôle important du CagA phosphorylé dans le mécanisme du cancer gastrique induit par H. pylori.
L’activité anti-inflammatoire de la curcumine est similaire à celle des anti-inflammatoires non stéroïdiens (ains) tels que l’indométacine. Les ulcères causés par les anti-inflammatoires non stéroïdiens (ains) sont un processus complexe impliquant l’inhibition de la synthèse de la prostaglandine dans le tractus gastro-intestinal, entraînant une augmentation de la sécrétion d’acide gastrique, une réduction de la sécrétion de mucus de bicarbonate, une diminution de l’effet trophique sur la muqueuse épithéliale [39], ainsi qu’une perméabilité microvasculaire accrue, un déséquilibre de l’oxyde nitrique et la production de radicaux libres. Ces médicaments anti-inflammatoires bloquent la synthèse de la prostaglandine en inhibant l’activité de la cyclooxygénase (COX), qui augmente la sécrétion d’acide gastrique, ce qui entraîne une diminution du mucus et une augmentation des dommages à la paroi muqueuse [40]. Leurs propriétés anti-inflammatoires et anticancéreuses sont mediées par l’inhibition de COX-2, LOX et iNOS, la production de cytokines telles que IFN- et TNF-, et l’activation de facteurs de transcription tels que NF-KB et AP-1 [41,42]. Par conséquent, les médicaments qui interfèrent avec les voies de signal impliquées dans la transcription de la COX-2 peuvent également réduire l’inflammation et l’apparition de tumeurs.
D’autres études ont montré que les métabolites de l’acide arachidonique provenant de la voie LOX jouent un rôle important dans la transduction des signaux liés à la croissance, ce qui signifie qu’une intervention dans ces voies devrait être utile pour prévenir la progression du cancer [43]. La curcumine présente de fortes propriétés antioxydantes et anticancéreuses en régulant l’expression des gènes activés par la protéine activatrice (AP-1) et le facteur nucléaire KB (NF-B). Comme l’inflammation est étroitement liée à la promotion des tumeurs, la curcumine devrait exercer des effets chimiopréventifs sur le développement du cancer en raison de ses fortes propriétés anti-inflammatoires [44]. Les mécanismes anticancéreux potentiels de la curcumine comprennent l’inhibition du NF-KB et de la COX-2 (des taux élevés de COX-2 sont associés à divers cancers); Inhibition du métabolisme de l’acide arachidonique via la lipoxygénase, qui élimine les radicaux libres produits par cette voie; Suppression de la croissance des cellules cancéreuses due à une expression réduite des cytokines inflammatoires telles que IL-1β, IL-6 et TNF-; Et la régulation décroissante des enzymes qui médient l’inflammation et la prolifération des cellules tumorales, telles que la protéine kinase C [45]. Par conséquent, la curcumine peut empêcher, inhiber la croissance tumorale et favoriser l’apoptose des cellules tumorales par de multiples voies de signaux.
2.3 effet antioxydant de la curcumine
La curcumine est un antioxydant efficaceDans le tube digestif supérieur et un récupérateur de composés azotés [46,47]. L’effet antioxydant de la curcumine se reflète principalement dans l’élimination des radicaux libres d’oxygène actifs, l’inhibition de la peroxydation lipidique, l’activité accrue de la superoxyde dismutase (SOD) et de la catalase (CAT), etc., et un effet inhibiteur significatif sur la peroxydation lipidique de la lécithine et les dommages oxydatifs induits de l’adn. Helicobacter pylori provoque des dommages gastriques par l’intermédiaire de médiateurs inflammatoires, ce qui conduit à la production de grandes quantités de radicaux libres d’oxygène et d’espèces réactives d’oxygène. Après la rupture de la membrane lysosomale, le corps et#39; S hydrolases sont libérées dans les cellules, hydrolysant ainsi toute la cellule et endommageant les cellules épithéliales gastriques [48]. Ces dommages peuvent entraîner une constriction des veines et des artères de la muqueuse gastrique, entraînant une congestion, une inflammation et des lésions tissulaires. Des expériences ont montré que l’effet protecteur de la curcumine sur les lésions des muqueuses gastriques induites par l’indométhacine chez les rats dépend de la régulation défavorable de l’expression de la cytokine pro-inflammatoire induite par la curcumine (IL-6, TNF-) et des lésions histologiques est considérablement réduit.
Among them, curcumin inhibits apoptosis and increases mucosal epithelial resistance, therePar:increasing gastriquemucosal celluledifferentiation. Curcumin is a unique antioxidant containing many functional groups, including phenolic hydroxyl groups, methoxy groups and 1,3-β-diketones, as determined Par:chemical structure analysis. Curcuminoids can undergo nucleophilic addition via various complex mechanisms, which confers their antioxidant properties [49,50]. Curcumin is unstable under alkaline conditions, but its stability increases significantly under acidic conditions. In an in vivo study, curcumin was compared with lansoprazole, a proton pump inhibitor (PPI) that is the recommended standard drug for the treatment of gastrointestinal diseases such as gastroesophageal reflux disease (GERD) [51]. It was found that curcumin can effectively prevent the formation of acute mixed reflux esophagitis, reduce neutrophil infiltration, and reduce its severity. Although curcumin is less effective than the proton pump inhibitor (PPI) lansoprazole in inhibiting acid reflux esophagitis, it is effective in preventing bile acid reflux esophagitis. This protective mechanism of curcumin in the esophagus can be attributed to the antioxidant properties of curcumin.
3 Conclusion
Analysis of the chemical structure and pharmacological effects of curcumin shows that it has anti-inflammatory, anticancer and antioxidant biological effects. As research continues, the overall efficacy of curcumin in treating various diseases such as gastric inflammation and cancer is expected to be promising. The role and mechanism of curcumin powder in the development and progression of diseases will provide new ideas for the prevention and treatment of various diseases, which is of great significance for the diagnosis and prevention of diseases.
Référence:
[1] LIU W H, YUAN J B, ZHANG F, et al. La curcumine inhibe la fermentation, Migration et invasion de cellules cancéreuses gastriques par la voie de signalisation wnt3a/ p-caténine /EMT [J]. China Revue de presseof Chinese Materia Medica, En 2019,44(14): 3107-3115.
[2] IVY B R, j
[3] HE C Y, CHEN M Y, LIU J Y, et al. Les facteurs génétiques de l’hôte sont liés aux facteurs de virulence pathogènes de Helico- bacter pylori dans la cancérogenèse gastrique [J]. Mutation Research — revues dans Mutation Research, 2014, 759(1): 14-26.
[4] [traduction] NANJUNDASWAMY S, JAYASHANKAR J, RENGANA- THAN R R A, et al. Analogues pyrazole couplés à la Pyridine comme arme létale contre le sarm: une approche in-vitro et in-silico [J]. Microbien Pathogenesis, 2022, 166: 105508.
[5]NAUMANN M, SOKOLOVAO, TEGTMEYER N, et al. Heli- cobacter Pylori: un pathogène paradigme pour subverter la transmission sig- nale de cellules hôtes [J]. Trends in Microbiolgy, 2016, 25(4): 316-328.
[6] SANAEI M J, SHIRZAD H, SOLTANI A, et al. L’expression CCL18, CCL28 et CXCL13 réglée à la hausse est associée au risque de gastrite et d’ulcère gastro-duodénaux dans l’infection par Helicobacter Pylori [J]. The American Journal of The Medical Sciences, 2020, 361(1): 43-54.
[7] GORGIEVAO S, TRCEK J. cellulose bactérienne: production, modification et perspectives dans les applications biomédicales [J]. Nanomatériaux, En 2019,9(10): 1352.
[8] WANG J, TAVAKOLI J, TANG Y. production de cellulose bactérienne, propriétés et applications avec différentes méthodes de culture - une revue [J]. Glucides polymères, 2019, 219: 63-76.
[9] KHAN H, KADAMA, DUTT D. études sur la cellulose bactérienne produite par une nouvelle souche du genre Lactobacillus [J]. Carbohy- drate Polymers, 2020, 229(22) : 115513-115523.
[10] CHENG H, XU T. Macrophage polarisation dans le développement et la progression des cancers de l’ovaire: une vue d’ensemble [J]. Fron- tiers en oncologie, 2019, 9: 421.
[11] RUFFELL B, COUSSENS L M. Macrophages et résistance thérapeutique dans le cancer[J]. Cancer Cell, 2015, 27(4): 462-472.
[12] BISWAS S K, MANTOVANI A. plasticité des macrophages et interaction avec les sous-ensembles iymphocytes: le cancer comme paradigme [J]. Nature Immunology, 2010, 11(10): 889-896.
[13] CAO X, CHEN J, LI B et al. Promouvoir la phagocytose cellulaire dépendante des anticorps pour une immunothérapie efficace contre le cancer à base de macrophages [J]. Science Advances, 2022, 8(11): l91-201.
[14] WENG WH, GoelA. Curcumine et cancer colorectal: une perspective à jour et actuelle sur cette médecine naturelle [J]. Sem- inars en biologie du Cancer, 2022, 80: 73-86.
[15] TURCHI R, TORTOLICI F, Monica B, et coll. L’ami à faible teneur en soufre - pas d’acide, un régime riche en acides gras polyinsaturés inhibe la croissance du cancer du sein [J]. International Journal of Molecular Scien- ces, 2022, 24(1) : 249.
[16] LIM, GUO T, LIN J et al. La curcumine inhibe l’invasion et les métastases du cancer du sein triple négatif par la voie de signalisation hérisson /Gli 1 [J]. Journal d’ethnopharmacologie, 2022, 283: 114689.
[17] WANG N Z, FENG T, LIU X N, et al. La curcumine inhibe la migration and invasion of Non petit cell poumon cancer Cellules par une régulation supérieure du miR-206 et la suppression de la voie de signalisation PI3K/ AKT/mTOR [J]. Acta Pharmaceutica, 2020, 70(3): 399-409.
[18] GHASEMI F, SHAFIEE M, ZARRIN S, et al. Curcumine in- hibits NF-kB et Wnt/ p-caténine voies dans les cellules cancéreuses du col de l’utérus [J]. pathologie-recherche Et la pratique, 2019, 215 (10): 152556.
[19] DA W, ZHANG J, ZHANG R, et al. Curcumine inhibe le ly- mphangiogenesis of gastric cancer cellules by l’inhibition De signalisation HMGB1/VEGF-D [J]. International Journal of Im- munopathologie et pharmacologie, 2019,33: 3107-3115.
[20] KHONCHE A, BIGLARIANO, PANAHIY et al. Traitement d’appoint avec curcumine pour l’ulcère gastroduodénal: un essai contrôlé randomisé mené [J]. Drug Research, 2016, 66(8) : 444-448.
[21] JIANG C, LUO P. Nrf2/ARE est une voie clé pour la curcumine - médiation Protection des données De TMJ Les chondrocytes from Stress oxydatif et inflammation[J]. Cell Stress and Chaperones, 2020, 25(3): 395-406.
[22] JIANG X, LI S, QIU X et al. La curcumine inhibe la viabilité cellulaire et augmente l’apoptose des cellules SW620 d’adénocarcine - ome du côlon humain par la voie cautale Homeobox-2 (CDX2)/Wnt/ - caténine [J]. Moniteur des sciences médicales: International Medical Journal of expérimental and clinique Recherche, 2019, 25: 7451-7458.
[23] KWIECIEN S, MAGIEROWSKI M, MAJKA J, et al. Curcu- min: un puissant protecteur contre les troubles oesophagien et gastrique [J]. International Journal ofMolecular Sciences, 2019, 20 (6): 1477.
[24] LATHAM A, SRINIVASAN P, KEMEL Y. la stabilité Microsatellite est associée à la présence du syndrome de lynch pancancer [J]. Journal de la clinique Oncologie, 2019, 37 (4): 286-295.
[25] LIU J, ZHANG J, REN L et al. Les particules fines dans l’apoptose par l’intermédiaire de l’atm /P53/CDK2 et des mitochondries ap- optose parcours déclenchée by oxydatif stress in rat Et la cellule GC-2spd [J]. Ecotoxicologie et sécurité environnementale, 2019, 180: 280-287.
[26] YU Y T, TIAN L Q, XIAO Y Y, et al. Effet de la supplémentation en vitamine D sur certains biomarqueurs inflammatoires chez des sujets diabétiques de type 2: revue systématique et méta-analyse des essais contrôlés randomisés [J]. Annals ofNutrition and Metabolism, 2018, 73(1): 62-73.
[27] NI Y, NI L, ZHU F, et al. Yissue adipeux macrophages pheno- types et caractéristiques: la clé de la résistance à l’insuline dans l’obésité et les troubles métaboliques [J]. Obésité, 2020, 28(2): 225-234.
[28] JEFFRY A, ANDREW M J, BODDY AV. Curcumine en tant qu’agent anticancéreux très prometteur: pharmacocinétique et interactions médicamenteuses [J]. Avis d’experts sur le métabolisme et la toxicologie, 2017, 13(9) : 953-972.
[29] ZHANG J L, ZHANG J, ZHANG R, et al. Implications de l’im - munoglobuline G depositin glomeruli chez les patients chinois atteints de néphropathie diabétique [J]. Pharma clinique et expérimentale - cologie et physiologie, 2020, 47(6) : 919-926.
[30] FENG J, LU S Y, OU B, et al. Le rôle de la signalisation pat- hway dans la résistance à l’insuline induite par l’obésité [J]. Diabète, Syndrome métabolique et obésité: objectifs et thérapie, 2020, 13: 1399-1406.
[31] XIAO H, KANG S. The role of gut microbiome in energy balance with a focus on The gut-adipeuxtissusaxis[J]. Fronti- ers in Genetics, 2020, 11(7): 297.
[32] HERSOUG L, möller P, LOFT S. rôle du microbiote -de rived lipopolysaccharide in adipose tissue Inflammation, taille des adipocytes et pyroptose pendant l’obésité [J]. Nutrition Re- recherche commentaires, 2018, 31(2): 153-163.
[33] RACHDAOUI N. Insulin: l’ami et l’ennemi dans le développement du diabète sucré de type 2 [J]. International Journal of Molecular Sciences, 2020, 21(5) : 1770.
[34] MOHAMAD A, VAHIDEH HZ. IL-6 voies de signalisation et développement du diabète de type 2 [J]. Inflflammopharmacology, 2018, 26(3) : 685-698.
[35] AKASH M SH, REHMAN K, Liaqat A. nécrose tumorale fac- tor-alpha: rôle dans le développement de la résistance à l’insuline et pat- hogenèse du diabète sucré de type 2 [J]. Journal of Cellular Biochemistry, 2018, 119(1): 105-110.
[36] VOLPE C M O, VILLAR D, PAULA M, et al. Mort cellulaire, espèces réactives d’oxygène (ROS) et complications diabétiques [J]. Cell Death and Disease, 2018, 9(2): 119.
[37] WANG J, WANG H. stress oxydatif dans la régénération des cellules bêta pancréatiques [J]. Oxydative Medicine and Cellular Longevity, 2017, 120(9): 193-201.
[38] HESARI AR, MITRA A, ALIREZA S, et al. Potentiel chimiopréventif et thérapeutique de la curcumine dans le cancer œsophagien: état actuel et futur [J]. International Journal of Cancer, 2019, 114(6): 1215-1226.
[39] KARBALAEI M, TALEBI B. Clinical relevance of CagA and VacA s1m1 status and antibiotic resistance in Helicobac- ter pylori: a systematic review and meta-analysis[J]. BMC In- fectious Diseases, 2022, 22(1): 573.
[40] couverture T L, LACY D B, OHI M D. le système de sécrétion de Helicobacter pylori cag type IV [J]. Trends in Microbiology, 2020, 28(8): 682-695.
[41] UMAR B, ROUTHUN K, KUMAR A. rôles multifacettes des inhibiteurs de petites molécules dérivés de plantes sur le cycle de réplication du SARS-CoV-2[J]. Microbien Pathogenesis, 2022, 168: 105512.
[42] KARKHAN A. Helicobacter pylori stratégies d’évasion de l’hôte réponses immunitaires innées et adaptatives pour survivre et développer des maladies gastro-intestinales [J]. Microbiological Research, 2018, 218: 49-57.
[43] MENTIS A, BOZIKI M, GRIGORIADISN. Helicobacter py- lori infection et cancer gastrique biologie: tempérer une cellule à double tranchant [J]. Cellular and Molecular Life Sciences, 2019, 76(13): 2477-2486.
[44] [traduction] PEREIRA M. J. Infection à Helicobacter Pylori, The gastric microbiome and gastric cancer[J]. Avances en médecine expérimentale et biologie, 2019, 1149: 195-210.
[45] TANG X Q, BIH, FENG J Q, et al. Effet de la curcumine sur la multirésistance aux médicaments chez l’homme carcinome Ligne cellulaire SGC7901/VCR[J]. Acta Pharmacologica Sinica, 2005, 26(8): 1009-1016.
[46] PIWOCKA K, BIELAK M A, EWA S. curcumine induit cas- pase-3 indépendant Apoptose chez l’homme Cellules multirésistantes [J]. Annals of New York Academy of Sciences, 2002, 973: 250-254.
[47] PAL S, TANYA D, GAURISANKAR S. Curcumin induit sélectivement l’apoptose dans les cellules seregulated cyclin d1-exprimé à la phase G2 du cycle cellulaire d’une manière dépendante de p53 [J]. Journal of Biological Chemistry, 2005, 280(20): 20059-20068.
[48] CHEN Y, KUO T C. Induction de l’expression du gène HSP70 par modulation de l’ion Ca(12) et de la protéine p53 cellulaire par curcu- min dans des cellules de carcinome colorectal [J]. Molecular Carcinogen- esis, 1996, 17(4) : 224-234.
[49] KATO K, ITO H, KAMEI K et al. Stimulation de la wxpression induite par le stress des protéines de stress par la curcumine dans des cellules de culture et des tissus de rat in vivo[J]. Cell Stress and Chaperones, 1998, 3(3) : 152-160.
[50] SUNDAR D K S, HOURELD N N, MHEIDI A, et al. Potentiel théra - péutique et progrès récents de la curcumine dans le traitement des maladies associées au vieillissement [J]. Molécules, 2018, 23(4): 835.
-
Précédent précédent
Quelle est l’émulsification et l’encapsulation de la poudre de curcumine?
-
Suivant:
Le curcuma est-il bon pour les reins?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais



