Quelle est l’utilisation de l’extrait Polysaccharide d’astragale?
l’astragaleis the root De lal’astragalemembranaceus in the genus Astragalus, family Leguminosae....... Astragalus polysaccharideis a substance proposed from Astragalus membranaceus, and the content of astragalus polysaccharide varies among different places of origin, with the highest content in Astragalus membranaceus produced in Gansu [1]. In recent years, astragalus polysaccharides have been found to have antioxidant[6], anti-apoptotic[7], anti-inflammatory[8], immunomodulatory[9], and antimicrobial[10] effects in pigs[2], chickens[3], and rats[4], as well as in vitro experiments[5] .

Avec le développement rapide de l’élevage porcin Et etde l’industrie des aliments pour animaux, "anti-réduction" est devenu une tendance de nos jours. En tant qu’additif vert, le polysaccharide d’astragale peut améliorer les performances de production et éviter les problèmes environnementaux causés par les antibiotiques. Par conséquent, cet article résume les fonctions physiologiques et les mécanismes des polysaccharides Astragali au pays et à l’étranger au cours des dernières années, et donne un aperçu des effets d’application dans la production porcine, en vue de fournir des références pour l’utilisation des polysaccharides Astragali dans l’élevage porcin.
1 propriétés physico-chimiques du polysaccharide d’astragale
Astragalus polysaccharide is the active ingredient in the traditional Chinese medicine Astragalus, yellow-brown in color, composed of rhamnose, arabinose, xylose, mannose, galactose and common sugar [11]. The molecular weight of Astragalus polysaccharide is between 80-160 kDa, which has obvious biological activity [12].
2 fonctions physiologiques et mécanismes d’action des polysaccharides d’astragale
2.1 propriétés antioxydantes
Dans le processus du métabolisme énergétique, les mitochondries dans les cellules généreront un grand nombre de radicaux libres, qui causeront divers dommages cellulaires. Les polysaccharides d’astragali peuvent détruire directement ou indirectement les radicaux libres et leurs produits oxydés. 2.1.1 captage Direct des radicaux libres
2.1.1 captage Direct des radicaux libres
En présence d’oxygène et d’ions métalliques (par exemple, Fe2+ et Cu2+), les mitochondries produisent un groupe de groupes oxydants puissants dans le métabolisme énergétique, tels que l’anion superoxyde (O2-), le radical hydroxyle (OH-) et le radical 1,1-diphényl-2-phénylhydrazine (DPPH-). Ni Huiyan et Al., et al.[13] ont constaté que les polysaccharides d’astragale avaient des effets piégants sur la DPPH-, OH- et O2- dans un essai in vitro sur les antioxydants. L’efficacité des polysaccharides d’astragale dans le piégeage des radicaux libres était fonction de la concentration.
Luo Nan et al.[14] ont constaté que la concentration de la solution de polysaccharide d’astragali augmentait de 0,1 mg/mL à 0,9 mg/mL, et que l’efficacité du captage de l’oh augmentait avec l’augmentation de la concentration.Concentration de polysaccharide d’astragali, et l’efficacité de récupération la plus élevée a été trouvée à 0,9 mg/mL. Cependant, on ne sait pas si la capacité de captation des radicaux libres du polysaccharide d’astragali a une limite.
Le piégement des radicaux libres par les polysaccharides d’astragale est principalement causé par les deux aspects suivants: OH- et O2- peuvent se combiner avec OH- et H+ fournis par chaque groupe monosaccharide dans les polysaccharides d’astragale pour former de l’eau composée stable, ainsi piéger les radicaux libres [15- 16]; Polysaccharides d’astragale, comme une sorte d’extraits de plantes polysaccharides, l’oh - des polysaccharides peut être complexé avec Fe2+ et Cu2+, qui sont nécessaires à la génération de radicaux libres, réduisant ainsi la génération de radicaux libres [17]. Les polysaccharides OH- on peuvent se compliquer avec Fe2+ et Cu2+, qui sont essentiels pour la production de radicaux libres, réduisant ainsi la production de radicaux libres [17]. Cependant, les études ci-dessus ont toutes été menées in vitro, et le captage in vivo des radicaux libres par les polysaccharides d’astragale n’est pas encore parfait et nécessite des recherches plus poussées.
2.1.2 inhiber le niveau d’espèces réactives d’oxygène (ROS) et augmenter l’activité de la peroxydase
Reactive oxygen species (ROS) are derivatives of free radicals. In the process of electron transfer in the mitochondrial respiratory chain, part of the oxygen is not fully oxidized to produce ROS [18]. It has been found that astragalus polysaccharide reduces the generation of ROS in myocytes[19] and endothélialcells[20] [en]Par:maintaining the stability of the mitochondrial respiratory chain. When the content of ROS and free radicals increases in the body, the content of peroxides will also increase. Therefore, various peroxidases [e.g., superoxide dismutase (SOD), glutathione peroxidase (GSH- PX)] are produced in the body to scavenge excess peroxides and free radicals.
Xu Shengming et al. [21] ont augmenté les activités de gazon et de GSH-P1 dans le sang des porcs sevrés de 8,8 % et de 104,5 %, respectivement, avec l’ajout de polysaccharide d’astragale à leur alimentation. Chen Wei et al [22] ont trouvé que le polysaccharide d’astragale pourrait améliorer le dysfonctionnement du gène peroxydase chez les souris transgéniques SOD2+/- en augmentant le niveau d’expression de SOD2mRNA et l’activité de SOD2. Le mécanisme est que le polysaccharide d’astragale active la protéine kinase activée par l’adénylate-(AMPK) pour augmenter le niveau d’expression du gène peroxydase, puis augmenter l’activité peroxydase [23]. Cependant, le mécanisme spécifique par lequel l’ampk régule l’activité de la peroxydase reste à étudier.
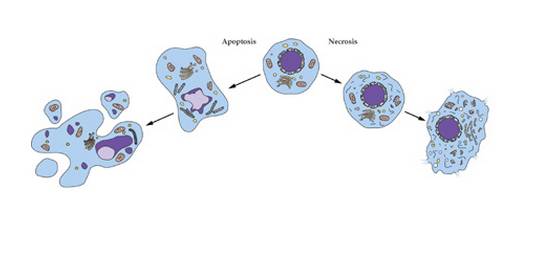
2.2 anti-apoptose
Apoptosis is mainly realized through the mitochondrial pathway, endoplasmic reticulum stress and death receptor pathway. In the present study, only the mitochondrial pathway and endoplasmic reticulum stress were found to have the anti-apoptotic function of Astragali polysaccharides.
2.2.1 stabilisation de la membrane mitochondriale
The stability of mitochondrial membrane plays an important role in the process of apoptosis. Excessive Ca2+, B-cellulelymphoma-2 protein (Bcl-2) and Bcl-2-related X protein (Bax) can alter the permeability of mitochondrial membranes, resulting in the release of cytochrome C from mitochondria into the cytosol, and ultimately activating the cysteine-aspartate protease caspase3 to induce apoptosis. Fan Zongjing et al.[24] found that astragalus polysaccharide could significantly reduce the concentration of Ca2+ in cardiomyocytes during transient ischemia and hypoxia, alleviate the damage of transient ischemia and hypoxia on the outer membrane of mitochondria, and avoid apoptosis of cardiomyocytes.
Sun et al.[25] ont constaté que le polysaccharide d’astragali pouvait inhiber l’apoptose en améliorant l’expression de Bcl-2 et en inhibant l’expression de Bax, augmentant ainsi le rapport de Bcl-2 à Bax dans les mitochondries, et donc en inhibant l’apoptose. Liu et al.[26] ont constaté que les polysaccharides d’astragali pouvaient avoir un certain effet protecteur sur les mitochondries dans un Parkinson' S maladie souris modèle, réduisant ainsi la libération de cytochrome C à partir des mitochondries. Liu et al.[26] ont constaté que le polysaccharide d’astragale pourrait avoir un certain effet protecteur sur les mitochondries, réduisant ainsi la libération de cytochrome C par les mitochondries et évitant l’apoptose. Wei Pingting et al.[27] ont constaté que le polysaccharide d’astragale pouvait réduire significativement l’expression de la protéine caspase3 dans le tissu rénal des rats touchés par l’éphédrine, et réduire l’apoptose des cellules du tissu rénal, ralentissant ainsi les dommages causés par l’éphédrine au tissu rénal des rats.
2.2.2 Stress endoplasmique du réticulum (ERS)
Le stress du réticulum endoplasmique (ERS) est l’une des principales voies de l’apoptose, et le ERS induit l’apoptose principalement par la protéine homologue C/EBP (CHOP), la voie amino-kinase terminale c-Jun (JNK) et la caspase 12 [28]. Apoptose par voie amino-kinase terminale c-Jun (JNK) et caspase 12 [28]. Sous l’effet fort du ERS, l’augmentation du facteur de transcription activé (ATF)6 et la surexpression du réticulum kinase endoplasmique de type PRKR (PERK) ont provoqué l’augmentation du CHOP, qui peut inhiber le Bcl-2 pour induire l’apoptose. CHOP peut inhiber Bcl-2 pour induire l’apoptose.
Dans un modèle de rat diabétique, le polysaccharide d’astragale a réduit la synthèse des protéines happées en inhibant l’activation de l’atf6 [29] et en diminuant l’expression de PERK [30] [31]. L’ers prolongé active continuellement l’inositol need enzymes (IER)1, qui à son tour transmet des signaux apoptotiques à la voie JNK pour provoquer l’apoptose [32]. Ouyang Jingping et al [33] ont constaté que le polysaccharide d’astragale pouvait inhiber l’activation de l’ier1 dans un modèle de rat diabétique. Dans un modèle de perfusion d’ischémie cardiaque, les polysaccharides d’astragali ont augmenté le rapport Bcl-2 / Bax dans les cardiomyocytes en inhibant l’activation de JNK et ont empêché l’apoptose des cardiomyocytes [34]. Pendant ce temps, la caspase 12, l’initiateur de l’apoptose, peut activer la caspase 3 et induire l’apoptose. Dans un modèle de rat diabétique, le polysaccharide d’astragali a inhibé l’expression de la caspase 12 pour réduire le taux d’apoptose des cardiomyocytes[35].
In summary, astragaloside can reduce apoptosis by maintaining the stability of mitochondrial membrane and reducing endoplasmic reticulum stress. However, the specific mechanism of astragalus polysaccharide in reducing apoptosis through the death receptor pathway needs to be further investigated.
2.3 anti-inflammatoire
Le facteur de transcription nucléaire -κ B (NF-κ B) joue un rôle important dans l’inflammation. Sous stimulation des médiateurs inflammatoires, la protéine inhibiteur -κ B (Iκ B) du cytosol est phosphorylée et détachée du NF-κ B, activant ainsi le NF-κ B [36]. Le NF-κ B activé peut pénétrer dans le noyau cellulaire et réguler l’expression d’une série de gènes pro-inflammatoires, renforçant ainsi la réponse inflammatoire [37]. Il a été constaté que le polysaccharide d’astragale peut inhiber l’activation de NF-κ B dans les cellules [38] et empêcher la phosphorylation d’iκ B [39], réduire le niveau de NF-κ B activé dans les cellules, et donc ralentir l’inflammation. Cheng Yan[40] et d’autres ont constaté que les polysaccharides d’astragale inhibaient l’expression des médiateurs inflammatoires et réduisaient la libération de médiateurs inflammatoires dans un modèle de sepsis de la souris, empêchant ainsi les dommages de la sepsis aux cardiomyocytes. Certaines protéases sont également impliquées dans le processus inflammatoire, comme la cyclooxygénase (COX), qui catalyse la production de prostaglandines à partir de l’acide arachidonique, permettant à l’inflammation de se propager. Liu Ling et al.[41] ont constaté que les polysaccharides astragale inhibent l’expression du gène COX, réduisant ainsi la production de l’enzyme COX et jouant un rôle anti-inflammatoire.
En résumé, le polysaccharide d’astragale peut être utilisé comme agent anti-inflammatoire de trois façons: premièrement, il peut réduire le niveau de NF-κ B activé, réduisant ainsi la production de médiateurs pro-inflammatoires; Deuxièmement, il peut inhiber l’expression de médiateurs inflammatoires, abaissant ainsi le niveau de médiateurs inflammatoires; Et troisièmement, il peut modifier l’activité des enzymes inflammatoires par la régulation des gènes des enzymes liées à l’inflammation, exerçant ainsi son effet d’inhibition de l’inflammation.
2.4 réglementation de l’immunité
2.4.1 améliorer le développement des organes immunitaires
La force d’un animal&#L’ immunité est déterminée par le développement de ses organes immunitaires (par exemple la rate, le thymus, la bourse). Xiang Shuangyun et al. [3] ont augmenté significativement les indices de rate et de bursa des poules pondeuses en leur injectant du polysaccharide d’astragale pendant 3 jours consécutifs avant la vaccination contre la maladie de Newcastle. Zhang et al. [42] ont constaté que l’alimentation en solution polysaccharidique d’astragali chez des rats vaccinés contre le virus de la fièvre aphteuse stimulait la prolifération des cellules de la rate de rat, et LI et al. [43] ont constaté que l’injection de solution polysaccharidique d’astragali chez des porcs vaccinés contre le virus de la fièvre aphteuse augmentait considérablement la qualité de leurs spleens.
2.4.2 amélioration des cellules immunitaires
Les cellules immunitaires comprennent principalement les lymphocytes T, les lymphocytes B, les macrophages, etc. Parmi eux, les lymphocytes T sont les principales cellules de l’immunité cellulaire, qui sont principalement divisées en deux sous-populations — CD4+ et CD8+ selon leurs fonctions [44], et le rapport CD4+/CD8+ peut être utilisé pour mesurer la performance immunitaire de l’organisme [45]. Il a été constaté que le polysaccharide d’astragale augmentait le nombre de lymphocytes T en augmentant le rapport CD4+/CD8+ chez les truies reproductrices, ce qui à son tour améliore la performance immunitaire des truies reproductrices [9]. Wang Chaofeng et al.[46] ont montré que l’ajout de polysaccharide d’astragale aux régimes alimentaires augmentait significativement le taux de CD4+ dans le sang des porcelets sevrés, ce qui augmentait à son tour le rapport CD4+/CD8+ et augmentait l’immunité des porcelets.
Hou Xi' E et al.[47] ont injecté des porcelets en lactation avec une solution de polysaccharide d’astragali et ont constaté que le polysaccharide d’astragali réduisait le CD8+ chez les porcelets et induisait les cellules B à sécréter plus de globulines. γ-interféron -γ (IFN-γ) est une glycoprotéine soluble dans l’eau, produite par des lymphocytes T activés. IFN-γ peut favoriser la différenciation des lymphocytes T et améliorer l’immunité cellulaire en régulant le facteur de transcription T-bet. Yao Jingming et al [48] ont injecté des porcs vaccinés contre la peste porcine avec une solution polysaccharidique d’astragale, ce qui pourrait augmenter significativement la teneur en IFN-γ chez les porcs vaccinés contre la peste porcine, favoriser la différenciation des lymphocytes T, puis améliorer l’immunité cellulaire. Les récepteurs de type toll (TLR4) jouent un rôle important dans la fonction immunitaire des phagocytes, et il a été constaté que la structure polysaccharidique des polysaccharides astragale active les phagocytes en se liant à TLR4 à la surface des phagocytes, stimulant ainsi la sécrétion d’effecteur immunitaire par les phagocytes, et augmentant ainsi la capacité immunitaire des phagocytes [49-51].
2.5 antibactérien
Astragalus polysaccharide has antibacterial properties [10]. In vitro antimicrobial tests showed that astragalus polysaccharides inhibited Escherichia coli, Streptococcus and Staphylococcus aureus, but the inhibitory effect was most obvious in E. coli [52]. Xie Hongbing et al [53] added 800 mg/kg astragalus polysaccharide to the diet of weaned piglets and found that the number of E. coli in the intestinal tract of weaned piglets in the astragalus polysaccharide group was significantly reduced compared with that of the control group.Li [54] et al. added 200 mg/kg astragalus polysaccharide to the diet of 1-day-old hens and carried out a feeding trial for 42 days, and found that the number of E. coli in the ileum and the cecum of the hens was reduced by 4% and 6%, respectively.5
L’effet antibactérien du polysaccharide astragale sur le tractus intestinal des poules d’un jour s’est également avéré significatif. Le mécanisme principal de l’effet antibactérien du polysaccharide astragale est le suivant: le polysaccharide astragale favorise le développement des villosités intestinales, augmente le nombre d’amygdalles et de ganglions lymphatiques dans l’intestin, et améliore la fonction immunitaire intestinale, qui à son tour induit la prolifération de Lactobacillus et Bifidobacterium dans le tractus intestinal [55]. En conséquence, l’efficacité de la production de Lactobacillus et de Bifidobacterium dans la décomposition des aliments pour produire des acides organiques est considérablement accrue, ce qui à son tour abaisse le pH dans l’intestin pour inhiber la croissance de bactéries pathogènes dans l’intestin [56]. En résumé, dans le test In vivo sur l’animal, l’effet du polysaccharide d’astragali sur E. coli était significatif, mais il manque des données précises sur l’effet inhibiteur sur d’autres bactéries pathogènes, qui doit être étudié.
3 effets du polysaccharide d’astragale sur la production porcine
3.1 effet sur la production porcine en croissance
From Table 1, it can be seen that adding Astragalus polysaccharide to feedPeut améliorer la performance de production des porcs en croissance. Le mécanisme est principalement causé par deux aspects, d’une part, astragale polysaccharide peut favoriser la croissance des cellules épithéliales intestinales et les petites villoses intestinales, favorisant ainsi le développement du tractus intestinal, et améliorer directement l’efficacité de la digestion intestinale et l’absorption des nutriments [60]; D’autre part, polysaccharide astragale pour augmenter le nombre de bactéries bénéfiques, de sorte que les bactéries bénéfiques décomposition des hydrates de carbone dans le tractus intestinal peut être facilement absorbée par l’acide organique, favorisant ainsi indirectement le tractus intestinal à l’absorption des nutriments [56].
D’autre part, le polysaccharide astragale augmente le nombre de bactéries bénéfiques, ce qui les fait décomposer les glucides en acides organiques, favorisant ainsi indirectement l’absorption intestinale des nutriments [56]. Cependant, lorsque la quantité de polysaccharide d’astragale ajoutée à l’alimentation est trop importante, le polysaccharide d’astragale augmente la viscosité de la nourriture dans le tractus gastro-intestinal, réduit l’interaction entre les enzymes digestives et la nourriture, puis réduit la digestibilité, ce qui aura une incidence sur le rendement de production des porcs en croissance [61]. En résumé, l’ajout d’une concentration appropriée de polysaccharide d’astragale à l’alimentation peut améliorer la performance des porcs en croissance.

3.3 effets sur le sperme du sanglier
Il a été constaté que l’ajout de 0,3 mg/mL de polysaccharide d’astragale à la solution de cryodilution pourrait améliorer considérablement l’effet de conservation de la cryoconservation du sperme de sanglier [67]. Liu Ying et al. [68] ont ajouté 0,04 mg/mL, 0,06 mg/mL, 0,08 mg/mL, 0,10 mg/mL de polysaccharides d’astragale à la solution de cryodilution et ont constaté que 0,08 mg/mL de polysaccharides d’astragale avait le meilleur effet de conservation sur le sperme de sanglier. Comme le processus de congélation peut induire la production de ROS dans les spermatozoïdes porcins et la peroxydation lipidique des acides gras insaturés dans la membrane plasmatique, entraînant des dommages oxydatifs [69], le polysaccharide d’astragale peut augmenter l’activité de la catalase et son expression d’arn dans les spermatozoïdes [70], et en même temps, il peut éliminer l’excès de ROS dans les mitochondries des spermatozoïdes [71], ce qui peut augmenter le spermatozoïde.#39; S résistance au stress oxydatif. Cependant, différents chercheurs ont des opinions différentes sur la concentration appropriée de polysaccharide d’astragale. Cela peut être dû aux différents poids moléculaires des polysaccharides d’astragale. L’origine, la méthode d’extraction et le poids moléculaire des polysaccharides d’astragale doivent être pris en considération lors de l’ajout de polysaccharides d’astragale aux aliments. On ne dispose pas de données détaillées sur l’effet des astragalosides sur la formation du sperme.
4 résumé
En résumé, les polysaccharides d’astragale ont des fonctions physiologiques spécifiques, et leur application dans la production porcine a obtenu des résultats préliminaires au cours des dernières années. Afin de mieux atteindre l’objectif futur d’ "agriculture sans antimicrobiens" et de mieux utiliser les astragalosides, des études approfondies sont nécessaires sur les aspects suivants: 1) explorer une nouvelle méthode d’extraction des astragalosides et améliorer l’efficacité de l’extraction de l’astragalosides; 2) étudier la concentration appropriée d’astragalosides dans l’alimentation des différentes races de porcs et à différents stades de croissance et étudier les effets secondaires et leurs mécanismes causés par des additions excessives; 3) étudier l’effet des astragalosides sur l’alimentation des porcs de différentes races et stades de croissance. 2) étudier la concentration appropriée de polysaccharide d’astragale dans les aliments pour différentes races de porcs et différents stades de croissance, et étudier les effets secondaires causés par l’addition excessive de polysaccharide d’astragale et son mécanisme; 3) explorez l’effet et le mécanisme de l’application combinée du polysaccharide d’astragale avec d’autres polysaccharides de plantes, des bactéries probiotiques, et des médecines chinoises traditionnelles pour améliorer la performance des porcs.
Références:
[1] ZHU Shangwen, WEI Jia, XU Yongzhen et al. Contenu des polysaccharides d’astragale dans l’astragale d’origines différentes et leurs effets anti-fatigue et hypoxie-résistants normobariques [J]. Journal of Shaanxi University of Traditional Chinese Medicine, 2016,39(1):86-89.
[2] LI Xingru,LI Shaowei,ZHANG Yamei et al. Vaccin à forte dose contre la peste porcine combiné à un polysaccharide d’astragale pour le traitement de l’hyperthermie chez les porcs [J]. Journal of Chinese Veterinary Medicine,2011,13(6):63-63.
[3] XIANG Shuangyun, ZHOU Zhenhui, CAO Jinyuan. Effets du polysaccharide d’astragale sur l’effet immunitaire du vaccin contre la maladie de Newcastle du poulet [J]. Feed Research,2017(24):38-41.
[4] HAN Lin,WANG Hongxin,RU Meiwei. Le polysaccharide d’astragale atténue l’apoptose induite par les LPS dans les cardiomyocytes de souris en inhibant les voies de signalisation NF-κB et JNK [J]. Bulletin de pharmacologie chinoise,2018,34(2):243-249.
[5] MA Jinyun,WANG Jinying,SUN Yu,et al. Étude expérimentale sur l’inhibition de l’eae et la modulation de l’activation de la neuromicroglia BV-2 par le polysaccharide d’astragale chez la souris [J]. Chinese Journal of Immunology, 2018,34(3):381- 387.
[6] Yang F,Yan G,Li Y,et al. Astragalus Polysaccharide atténué le dysfonctionnement induit par la surcharge en fer des cellules souches mésenchalmiques par la suppression du ROS Mitochondrial.[J]. Physiologie cellulaire & Biochemistry, 2016,39(4):1369-1379.
[7] Zheng J, Ma L T, Ren Q Y,et al.la influence du polysaccharide astragale et du β-élémene sur la croissance cellulaire LX-2, l’apoptose et l’activité [J]. Bmc Gastroenterology,2014,14(1):224.
[8] Yue S, Jian L, Lei W,et al. Amélioration des effets des Polysac - charides d’astragale sur la fonction cardiaque via la voie du Signal Keap1/Nrf2-ARE chez des Rats arthritiques adjuvants [J]. Chinese Herbal Medicines,2016,8 (2):143- 153.
[9] LIU Xinping, CHEN Chong, FU Shuguang, CHEN Ling, YUAN Jiuxiang. Amélioration de l’effet immunosuppresseur du polysaccharide astragale chez les truies mixtes sensibles à la peste porcine [J]. Journal of Jiangxi Normal University of Science and Technology,2015(6):36-39.
[10] SUN Bo, CHEN Jing, LIU Jiang et al. Effets de l’ajout de polysaccharide d’astragale pour se nourrir de la flore intestinale et de l’indice d’organe immunitaire des poulets de chair [J]. Heilongjiang Animal Husbandry and Veterinary Medicine,2014(13):86-88.
[11] LIU Yanzhong, ZHANG Fujun. Introduction à l’application du médicament vétérinaire astragalus polysaccharide[J]. Modern Animal Husbandry Science and Technology, 2010(6):210-210.
[12] JIANG Guangzhi. Recherche sur l’immunomodulation et la résistance à l’infection par le virus de l’oreille bleue par les polysaccharides d’astragale [D]. Hefei: université agricole d’anhui,2015.
[13] Ni Huiyan, Chen Wei, Song Wenjing. Étude sur l’effet antioxydant du polysaccharide d’astragale [J]. Journal de médecine chinoise, 2017,32(9):1705-1707.
[14] Luo N, Xu LY, Ruan HH, et al. Étude sur l’activité antioxydante du polysaccharide d’astragale [J]. Recherche sur l’activité antioxydante des polysaccharides d’astragale [J].
[15] SUN Chengwen, JIANG Yan, ZHONG Guo Gan, et al. Étude sur les dommages antioxydants du polysaccharide d’astragale [J]. Chinese Journal of Pharmacology,1996(2):161-163.
[16] WANG Jianhang, LI Yu, LIU Anjun. Extraction et activité antioxydante des polysaccharides de Pinus sylvestris [J]. Food Research and Development,2006,27(11):53-56.
[17] ZHAO Linjing, SONG Xiaoping, LAI Fangya. Progrès des recherches sur les propriétés antioxydantes des polysaccharides et de leurs dérivés [J]. Journal of Shanghai University of Engineering and Technology,2008(1):44-47.
[18] GENG Junwei, YU Han, Han,LIN Zhi. Génération et métabolisme d’espèces réactives d’oxygène dans les cellules animales [J]. Life Science,2015,27(5):609-617.
[19] Huang Y F,Lu L,Zhu D J,et al.effets des Polysaccharides sur la fonction Dys of mitochondriale La dynamique induit by oxydatif Stress [J]. Médecine oxydative & Cellular Longevity,2016(10):1-13.
[20] Han, Tang, en Lu, Lu, et al. Astragalus polysaccharide Améliore le H2O2 induit humain ombilical veine endothelial cell blessure [J]. Molecular Medicine Reports, 2017, 15(6):4027-4034.
-
Précédent précédent
Quelles sont les utilisations de l’extrait d’astragale Astragalus Polysaccharides?
-
Suivant:
Quelles sont les utilisations du bleuet en tamoul?


 Anglais
Anglais français
français espagnol
espagnol russe
russe coréen
coréen japonais
japonais




